Содержание
- 2. План: Понятие о дисперсных системах. Классификация дисперсных систем. Взвеси. Коллоидные системы. Растворы. Классификация растворов. Растворение. Термодинамика
- 3. Дисперсные системы - гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено
- 4. Дисперсная фаза - вещество, которое присутствует в меньшем количестве и распределено в объёме другого. Дисперсионная среда
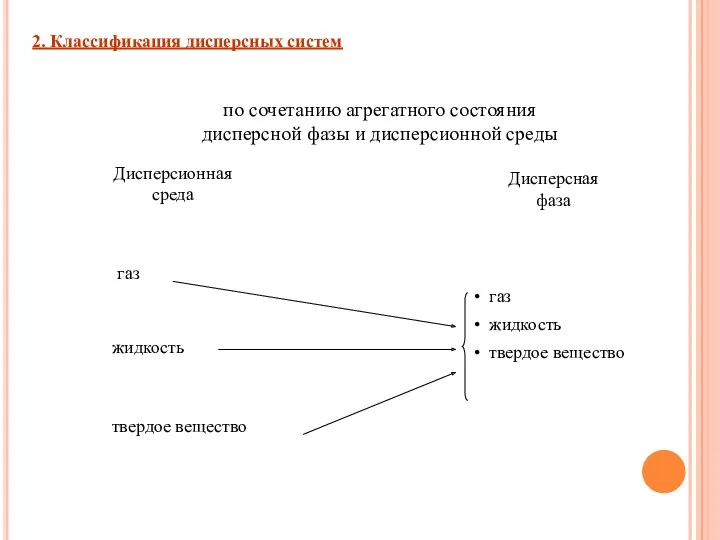
- 5. 2. Классификация дисперсных систем по сочетанию агрегатного состояния дисперсной фазы и дисперсионной среды Дисперсионная среда Дисперсная
- 6. 2. Классификация дисперсных систем Примеры дисперсных систем Природный газ Д.с. – газ Д.ф. -газ Дым, смог
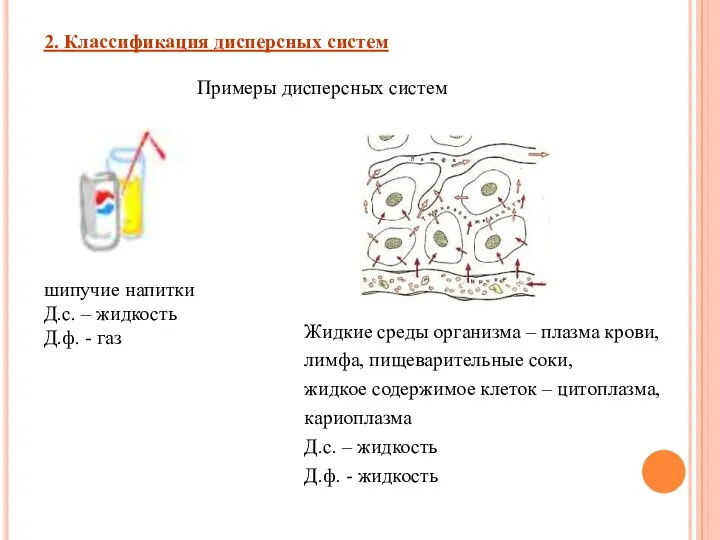
- 7. 2. Классификация дисперсных систем Примеры дисперсных систем шипучие напитки Д.с. – жидкость Д.ф. - газ Жидкие
- 8. 2. Классификация дисперсных систем Примеры дисперсных систем Пористый шоколад Д.с. – твердое Д.ф. - газ Медицинские
- 9. 2. Классификация дисперсных систем по степени дисперсности, т.е. среднему размеру частиц дисперсной фазы грубодисперсные (взвеси) тонкодисперсные
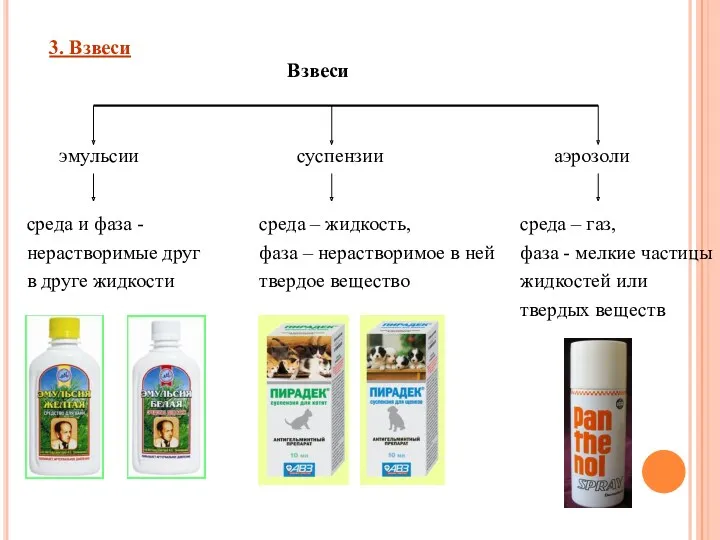
- 10. 3. Взвеси Взвеси – это дисперсные системы, в которых размер частиц фазы более 100 нм. это
- 11. Взвеси 3. Взвеси эмульсии среда и фаза - нерастворимые друг в друге жидкости суспензии среда –
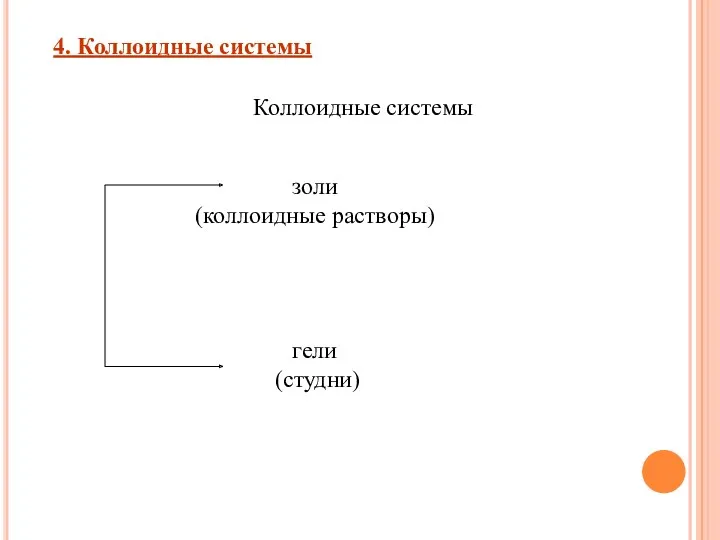
- 12. Коллоидные системы – это такие системы, в которых размер частиц фазы от 100 до 1 нм.
- 13. гели (студни) 4. Коллоидные системы Коллоидные системы золи (коллоидные растворы)
- 14. Золь - коллоидный раствор, жидкий при комнатной температуре и содержащий в качестве дисперсионной среды – воду,
- 15. К коллоидным растворам (золям) относятся: большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов
- 16. 4. Коллоидные системы Строение мицеллы AgNO3 + KI=AgI↓ + KNO3 Ag+ + NO3- + K+ +
- 17. Свойства коллоидных растворов (золей): 3оли занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями).
- 18. Джон Тиндаль – английский физик. Изучал рассеяние света в мутных средах. Открыл явление рассеяния света при
- 19. Эффект Тиндаля— оптический эффект, рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается
- 20. Ге́ли (студни) - студенистые осадки, образующиеся при коагуляции золей гели образуются при коагуляции золей; со временем
- 21. природные гели: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. К
- 22. 5. Истинные растворы дисперсионное вещество раздроблено до молекул или ионов менее 1 нм.; растворы называют истинными,
- 23. 5. Истинные растворы Растворитель - вещество, агрегатное состояние которого не изменяется при образовании раствора. если раствор
- 24. Контрольные вопросы для закрепления: 1. При повреждении кожи (ранке) наблюдается свертывание крови – коагуляция золя. В
- 26. Скачать презентацию



















 Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Протеины: плюсы и минусы
Протеины: плюсы и минусы Химическое равновесие. Классификация реакций по признаку обратимости
Химическое равновесие. Классификация реакций по признаку обратимости Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Виды химической связи
Виды химической связи Побутові хімікати
Побутові хімікати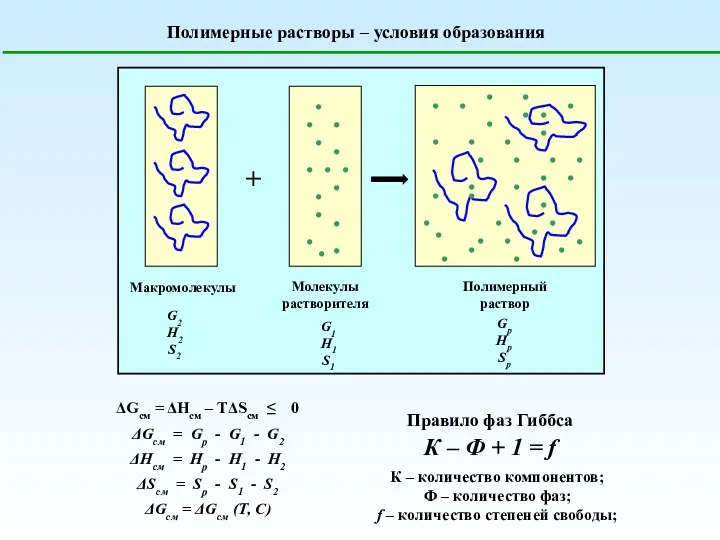 Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Основи. Хімія
Основи. Хімія Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Амфотерные соединения
Амфотерные соединения Карбоновые кислоты
Карбоновые кислоты Ауыр түсті металдар
Ауыр түсті металдар Органическая химия. Альдегиды и кетоны
Органическая химия. Альдегиды и кетоны Железо и его соединения
Железо и его соединения Квантовые процессы и химия в космосе
Квантовые процессы и химия в космосе Общие химические свойства металлов. Химия. 11 класс
Общие химические свойства металлов. Химия. 11 класс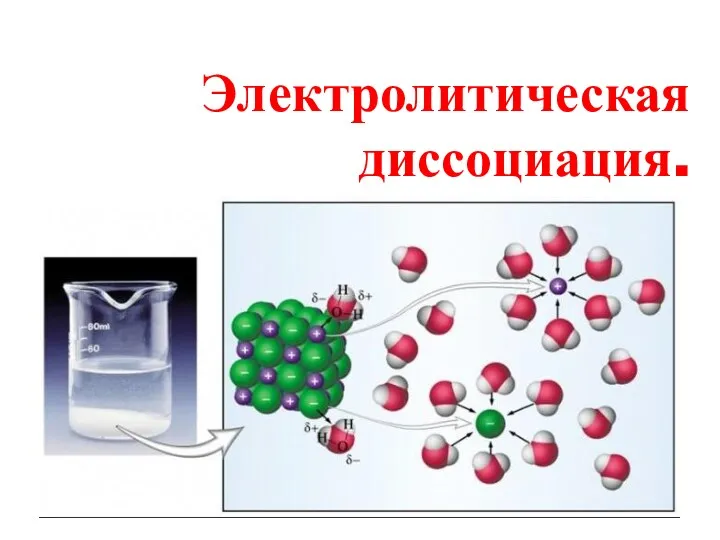 Электролитическая диссоциация
Электролитическая диссоциация алканы 170
алканы 170 Основы химической термодинамики
Основы химической термодинамики Химия. Химиялық термодинамика
Химия. Химиялық термодинамика Кафедра биохимии УГМУ в прошлом и настоящем. Локализация
Кафедра биохимии УГМУ в прошлом и настоящем. Локализация Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Материаловедение. Лекция 1
Материаловедение. Лекция 1 Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7)