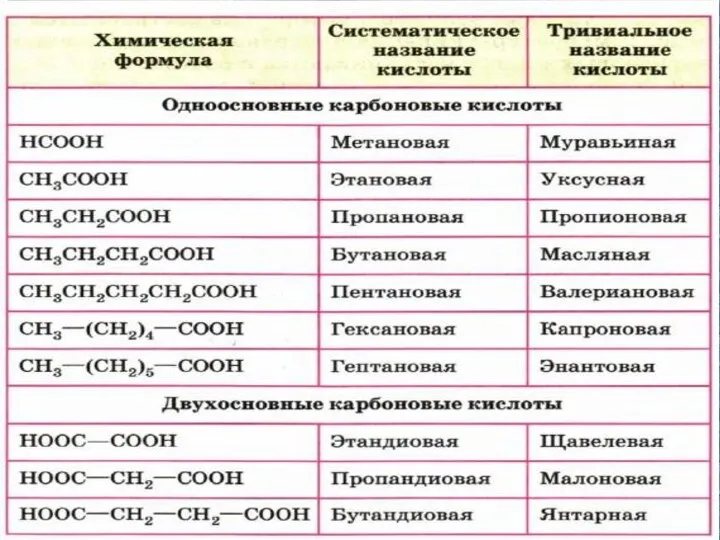
Слайд 2

Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или
несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
Слайд 3
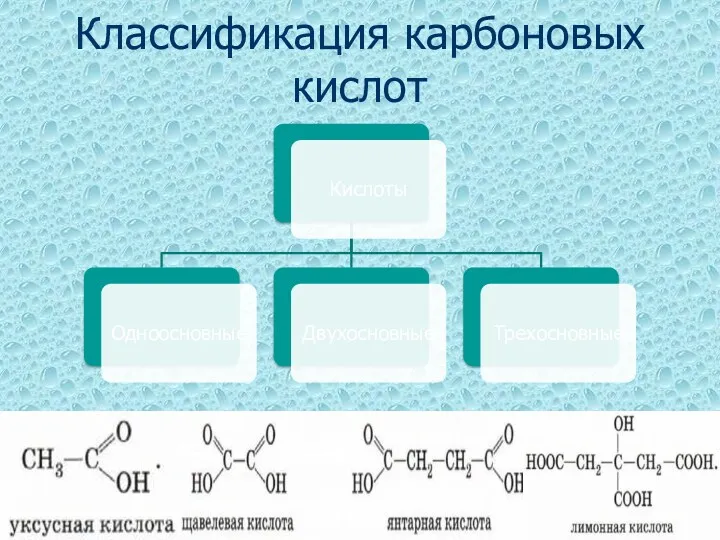
Классификация карбоновых кислот
Слайд 4
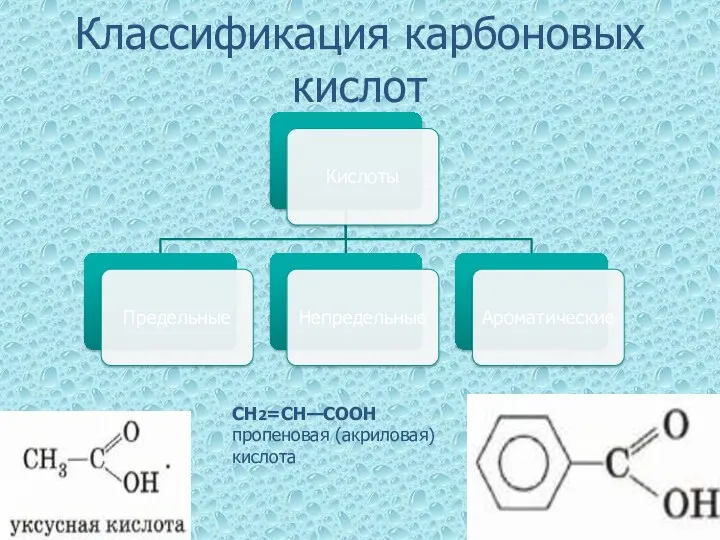
Классификация карбоновых кислот
СН2=СН—СООН
пропеновая (акриловая) кислота
Слайд 5
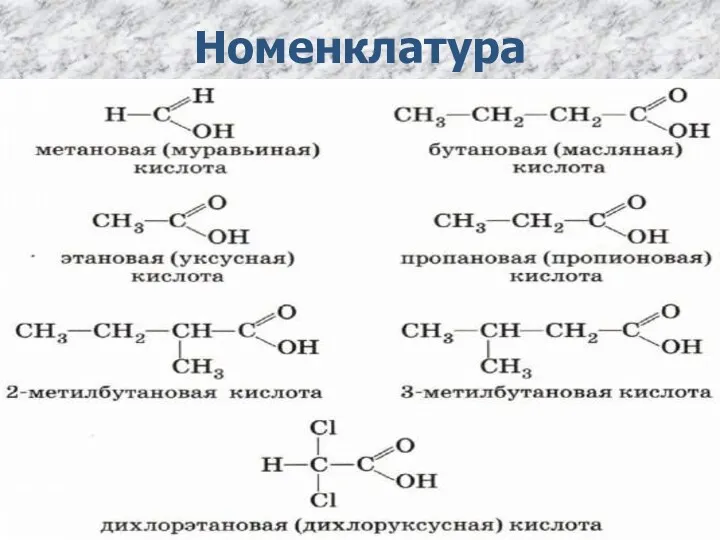
Слайд 6
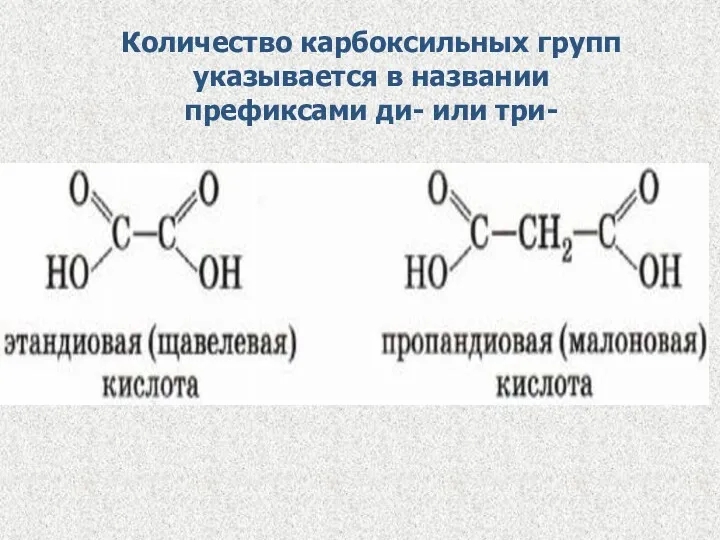
Количество карбоксильных групп указывается в названии префиксами ди- или три-
Слайд 7
Слайд 8

Изомерия
Для алифатических кислот - изомеризация углеводородного радикала.
Для ароматических - изомерия
положения заместителя при бензольном кольце.
Межклассовая изомерия со сложными эфирами (например, CH3-COOH и HCOO-CH3).
Слайд 9

Получение
1. Окисление альдегидов (кислородом на катализаторе; KMnO4; K2Cr2O7):
2. Каталитическое окисление алканов:
2CH4 + 3O2 → 2H–COOH + 2H2O
Слайд 10

Получение
3. Гидролиз сложных эфиров:
4. Гидролиз нитрилов:
5. Ароматические кислоты синтезируют окислением гомологов
бензола: в качестве окислителя можно использовать растворы KMnO4 или K2Cr2O7 в кислой среде:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Слайд 11

Физические свойства
С1- С3 жидкости с характерным резким запахом
С4- С9 вязкие
маслянистые жидкости с неприятным запахом
С С10 твердые нерастворимые вещества
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей и существуют в основном в виде димеров .
С ростом относительной молекулярной массы температура кипения предельных одноосновных кислот увеличивается
Слайд 12

Химические свойства
1. Карбоновые кислоты- слабые электролиты, в водном растворе диссоциируют:
R–COOH R–COO- + H+
2. Взаимодействие с металлами:
2СH3COOH + Mg → (CH3COO)2Mg + H2
3. Взаимодействие с основными оксидами:
2СH3COOH + СaO → (CH3COO)2Ca + H2O
4. Взаимодействие с основаниями:
H–COOH + NaOH → H–COONa + H2O
Слайд 13

5. Взаимодействие с солями более слабых и летучих кислот:
2СH3CH2COOH +
Na2CO3 → 2CH3CH2COONa + H2O + CO2
6. Взаимодействие со спиртами (этерификация):
CH3COOH+ C2H5OH CH3COOC2H5 + H2O
Слайд 14

7. Взаимодействие с галогенами:
При галогенировании карбоновых кислот, содержащих более одного атома
углерода в углеводородном остатке, возможно образование продуктов с различным положением галогена в молекуле. В присутствии небольших количеств красного фосфора, то она идёт селективно и водород замещается лишь в α-положении (у ближайшего к функциональной группе атома углерода) в молекуле кислоты.
Слайд 15

8. Реакции присоединения по кратной связи характерны для непредельных карбоновых кислот
Слайд 16
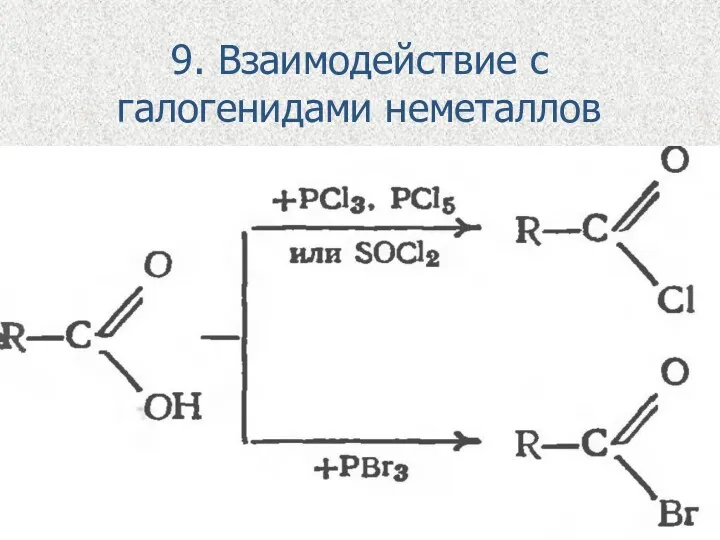
9. Взаимодействие с галогенидами неметаллов
Слайд 17

Слайд 18

Слайд 19

Применение
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота
– применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Слайд 20

Пятна ржавчины можно удалить раствором уксусной кислоты. Составьте молекулярные и ионные
уравнения происходящих при этом реакций, учитывая, что ржавчина содержит оксид и гидроксид железа (III) — Fe2O3 и Fe(OH)3. Почему такие пятна не удаляются водой? Почему они исчезают при обработке раствором кислоты?
Слайд 21

Расположите следующие кислоты: уксусную, пропионовую, хлоруксусную, дихлоруксусную и трихлоруксусную в порядке
усиления кислотных свойств. Обоснуйте своё мнение.
Слайд 22

Образец предельной одноосновной органической кислоты массой 3,7 г нейтрализовали водным раствором
гидрокарбоната натрия. При пропускании выделившегося газа через известковую воду было получено 5 г осадка. Какая кислота была взята? Вычислите объём выделившегося газа.
Ответ: С2Н5СООН; 1,12 л СO2.





















 Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Тепловой эффект химической реакции
Тепловой эффект химической реакции Переходные элементы
Переходные элементы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Химическая связь
Химическая связь Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Хімічні властивості кислот
Хімічні властивості кислот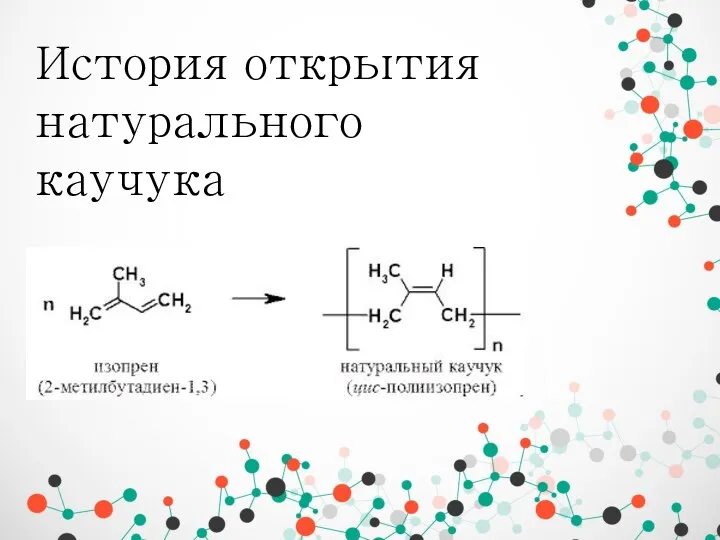 История открытия натурального каучука
История открытия натурального каучука Минералогический состав почв
Минералогический состав почв Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Химический элемент радий
Химический элемент радий Ask the right question to find the best answer
Ask the right question to find the best answer Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Водород
Водород Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Серная кислота
Серная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Щелочи
Щелочи Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Перманганат калия
Перманганат калия Химическая промышленность Донецкой области
Химическая промышленность Донецкой области