Содержание
- 2. Тема лекции № 2 «Кинетика процессов твердофазного взаимодействия» Основные вопросы 1. Методы изучения кинетики твердофазных реакций
- 3. Современные области применения твердофазового синтеза В настоящее время твердофазным синтезом получают: Люминофоры (способные светиться под влиянием
- 4. Особенности химического взаимодействия в смеси кристаллических реагентов Гетерогенное взаимодействие - протекает на поверхности раздела сосуществующих фаз
- 5. Основные термодинамические и кинетические закономерности гетерогенных химических реакций в смесях твердых веществ Направление реакции определяется изменением
- 6. Особенность топохимических реакций 1. Топохимические реакции начинаются не во всем объеме, а с отдельных, наиболее реакционно-способных
- 7. Особенности твердофазных реакций Твердофазный способ получения конструкционных и других материалов безотходен и более экологичен, чем растворный
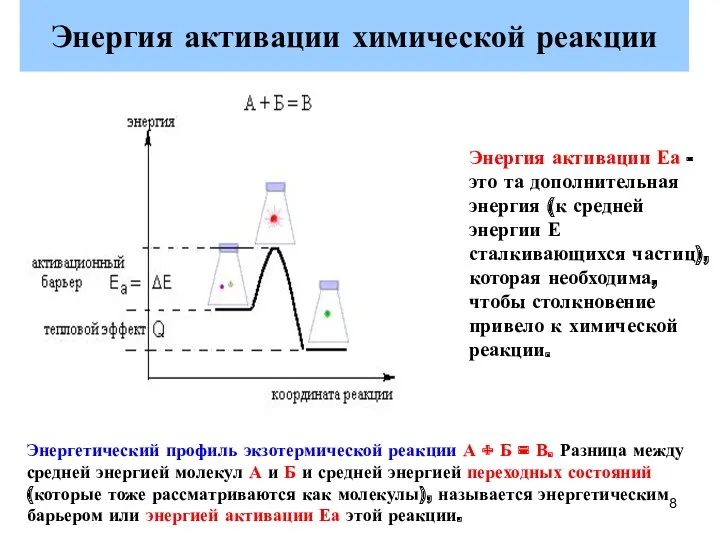
- 8. Энергия активации химической реакции Энергетический профиль экзотермической реакции А + Б = В. Разница между средней
- 9. Скорость химической реакции зависит от следующих факторов: концентрации реагирующих веществ; температуры реакции; природы реагирующих веществ; использования
- 10. Способ повышения реакционной способности твердых тел – активирование твердого тела (искусственного нарушения структуры кристаллов): 1. Изменение
- 11. Факторы, влияющие на интенсивность твердофазных реакций 1. Идеальная структура и энергия кристаллических решеток компонентов смеси; 2.
- 12. Особенности кинетического исследования твердофазного взаимодействия: 1. Состоит из 2-х этапов: А) Экспериментальное определение степени или скорости
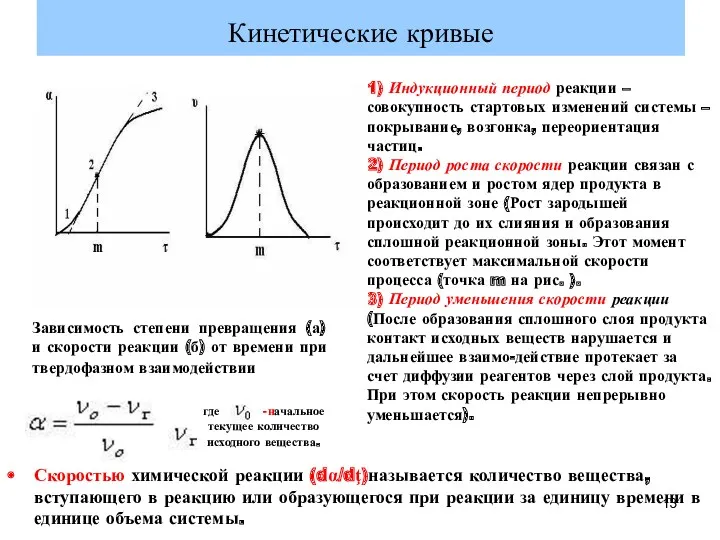
- 13. Кинетические кривые Зависимость степени превращения (а) и скорости реакции (б) от времени при твердофазном взаимодействии 1)
- 14. Кинетические модели и уравнения изотермической кинетики 1. Результат экспериментов в изотермических условиях – получение кинетической кривой
- 15. «Элементарные» стадии процесса физико-химических превращений при нагревании твердой смеси 1. Возникновение дефектов, разрыхление кристаллических решеток 2.
- 16. ЛИМИТИРУЮЩИЕ стадии твердофазного процесса: 1. Объемная диффузия реагентов через слой продукта реакции (взаимную или одностороннюю); 2.
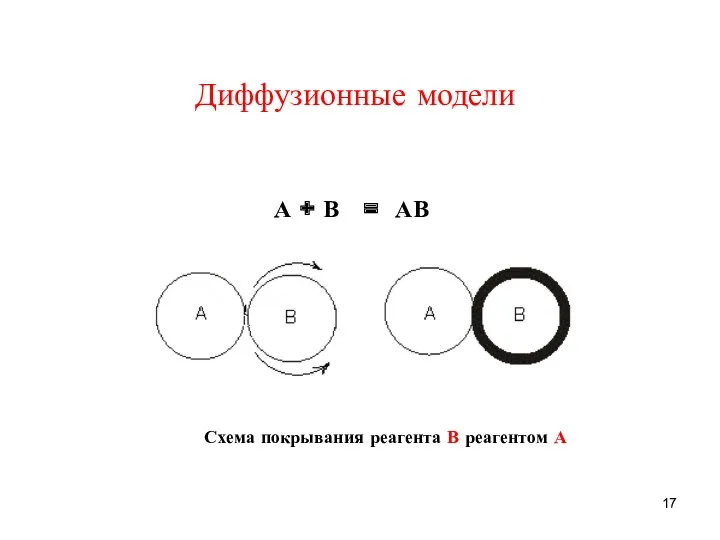
- 17. Диффузионные модели Схема покрывания реагента В реагентом А А + В = АВ
- 18. Предпосылки в моделе Яндера Продукт реакции АВ образует плотный сплошной слой на покрываемом агенте В, что
- 19. Механизмы реакционного массопереноса: объемный, зернограничный и поверхностный. Кроме того, если один из реагентов летуч, его доставка
- 20. Диффузионная модель Яндера (1927 г): Крупные зерна В окружены очень большим количеством мелких зерен А, то
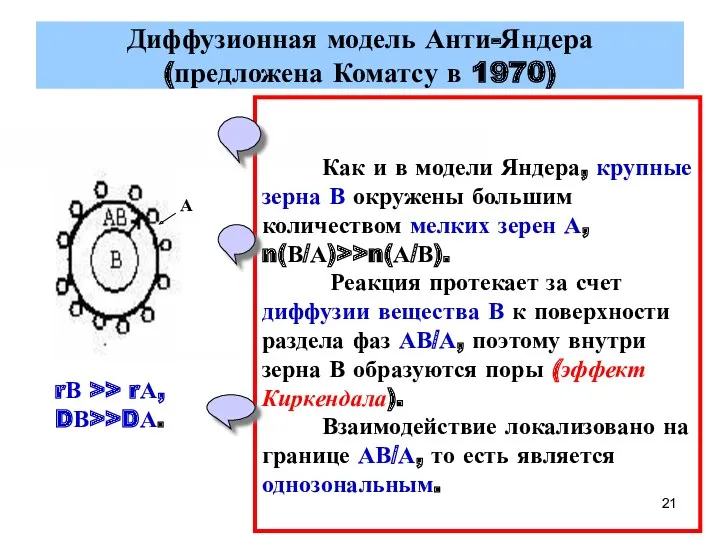
- 21. Диффузионная модель Анти-Яндера (предложена Коматсу в 1970) rВ >> rА, DВ>>DА. Как и в модели Яндера,
- 22. Диффузионная модель Вагнера rВ >> rА, DВ≈DА Как и в двух предыдущих моделях, число контактов зерен
- 23. Уравнения диффузионной кинетики Уравнение Яндера Уравнение Гинстлинга-Броунштейна Уравнение Картера -Валенси
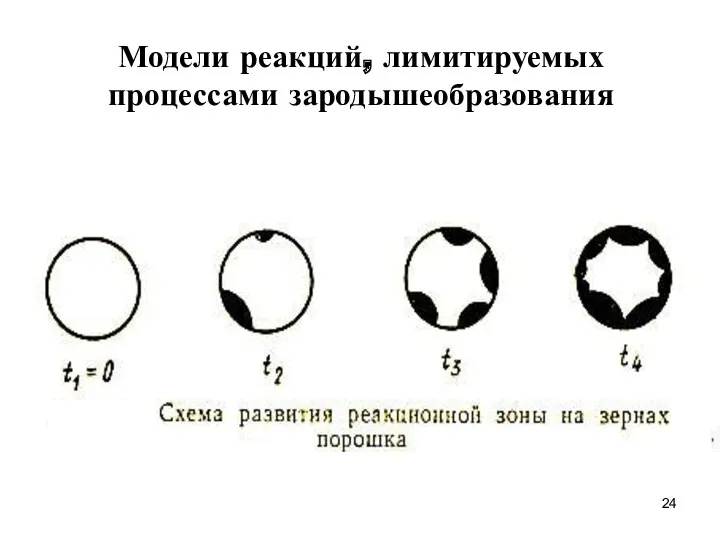
- 24. Модели реакций, лимитируемых процессами зародышеобразования
- 25. Лимитирование процесса образованием и ростом зародышей Образование ядер фазы твердого продукта может происходить не в любой
- 26. Модель твердофазной реакции, лимитируемой процессами кинетической природы Поскольку размер зерна В в ходе реакции постоянно уменьшается
- 27. Зависимость скорости реакции от температуры – γ = 2÷4- температурный коэффициент скорости реакции Уравнение Вант-Гоффа: При
- 28. Уравнение Аррениуса А –предэкспоненциальный множитель, фактор частоты. [А] - время -1 К – константа скорости реакции,
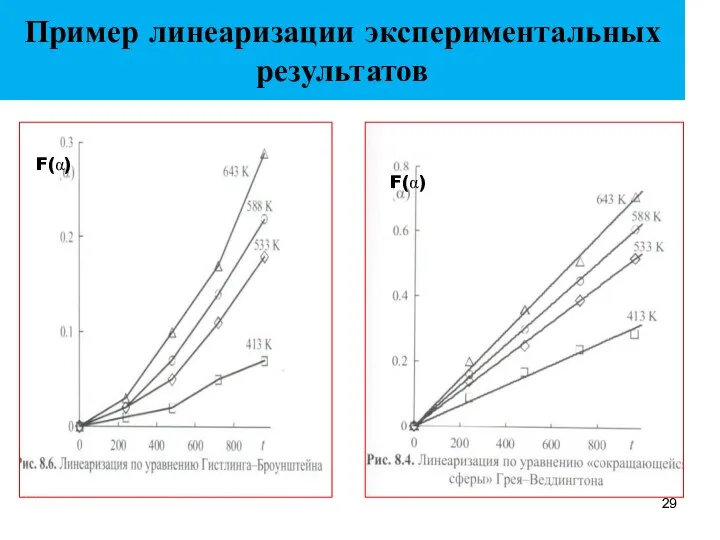
- 29. Пример линеаризации экспериментальных результатов F(α)
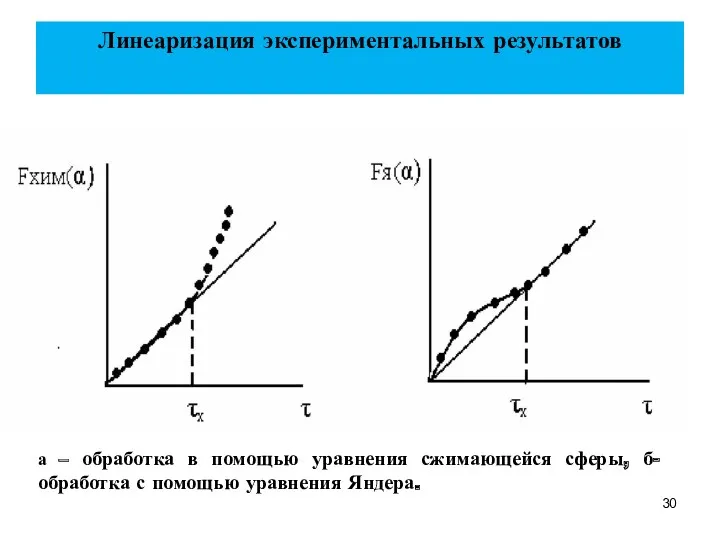
- 30. Линеаризация экспериментальных результатов а – обработка в помощью уравнения сжимающейся сферы, б- обработка с помощью уравнения
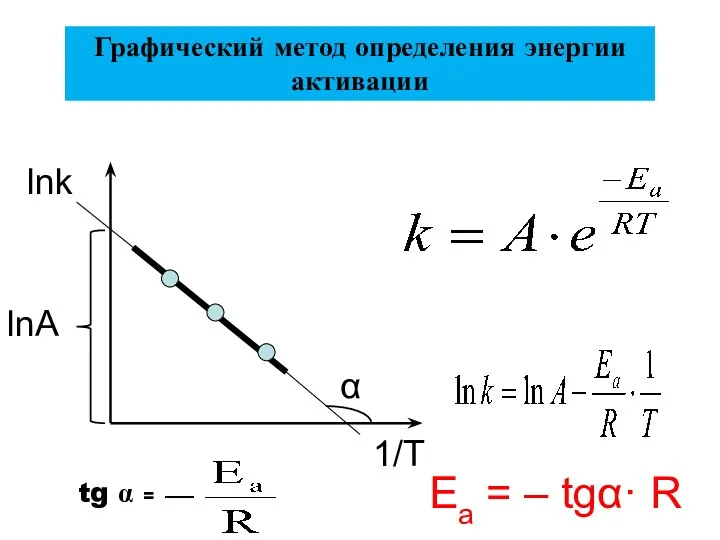
- 31. Ea = – tgα· R Графический метод определения энергии активации
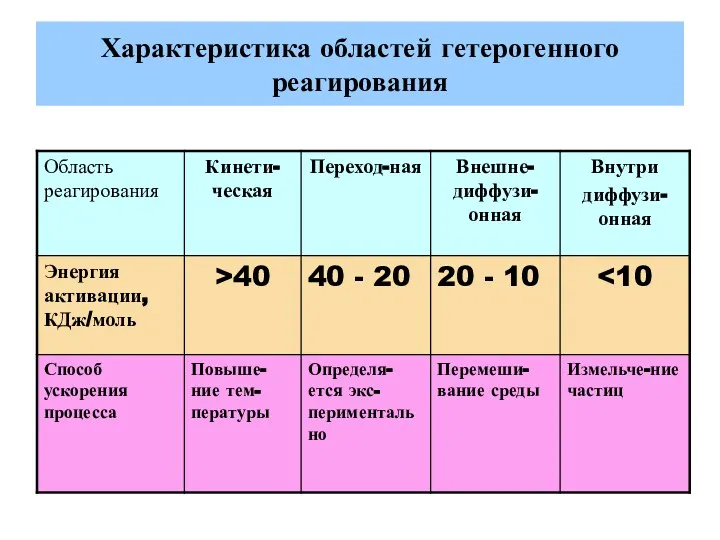
- 32. Характеристика областей гетерогенного реагирования
- 33. Выводы по лекции: Условием установления кинетики процесса твердофазового синтеза является определение: - лимитирующей стадии твердофазового взаимодействия;
- 35. Скачать презентацию




















![Уравнение Аррениуса А –предэкспоненциальный множитель, фактор частоты. [А] - время](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380083/slide-27.jpg)

 Молекулярные свойства жидкостей
Молекулярные свойства жидкостей Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний Металлы и сплавы
Металлы и сплавы Реакции ионного обмена
Реакции ионного обмена Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Степень окисления
Степень окисления Физические и химические явления
Физические и химические явления Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Алкадиены: гомологический ряд, общая формула, номенклатура. Сопряжённые, изолированные, кумулированные
Алкадиены: гомологический ряд, общая формула, номенклатура. Сопряжённые, изолированные, кумулированные Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Химическая идентификация
Химическая идентификация Координационные соединения
Координационные соединения Цикли трикарбонових кислот
Цикли трикарбонових кислот Фазовые диаграммы
Фазовые диаграммы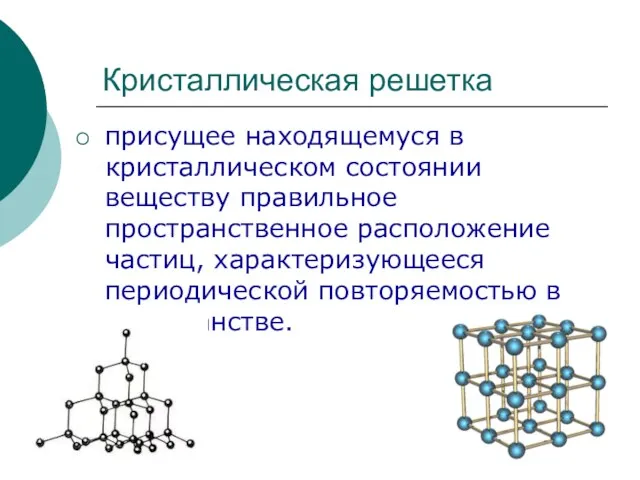 Кристаллическая решетка
Кристаллическая решетка Классификация химических элементов. Периодический закон Д.И. Менделеева
Классификация химических элементов. Периодический закон Д.И. Менделеева Соли. Определение солей
Соли. Определение солей Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации
Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации Введение в количественный анализ
Введение в количественный анализ Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Основания
Основания Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Промышленные типы месторождений железа
Промышленные типы месторождений железа Алюминий. 9 класс
Алюминий. 9 класс Технология производства хлорбензола
Технология производства хлорбензола