Содержание
- 2. Определения Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы (координационные единицы). Комплексная частица
- 3. Терминология и обозначения координационная единица (внутренняя сфера) 3KCN + Fe(CN)3 = K3[Fe(CN)6] внешняя сфера комплексообразователь лиганды
- 4. Альфред Вернер (Alfred Werner) (1866—1919) Швейцарский химик, создатель координационной теории, которая легла в основу химии комплексных
- 5. Теория Вернера (1893 г.) Большинство элементов могут быть комплексообразователями Комплексообразователь стремится насытить главную и побочную валентности
- 6. Характеристики КС Заряд комплексного иона – алгебраическая сумма зарядов комплексообразователя и лигандов Координационное число – число
- 7. Характеристики КС
- 8. Характеристики лигандов Координационная ёмкость (дентатность) – число координационных мест, занимаемых лигандом Лиганды бывают: Монодентатными Бидентатными Тридентатными
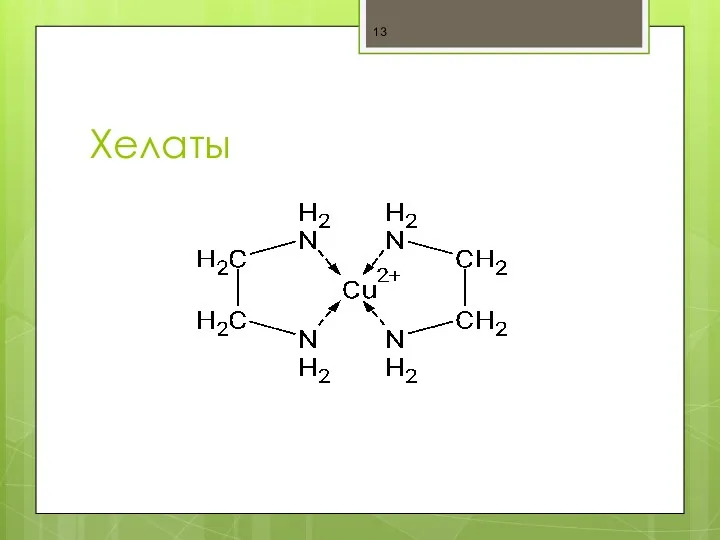
- 9. Классификация КС По заряду комплексного иона По типу лигандов По способности к ионизации Хелаты По числу
- 10. КС по заряду комплексного иона С комплексным катионом: [Cu(NH3)4]SO4, [Cr(H2O)6]Cl3, [Co(NH3)6](OH)2 С комплексным анионом: K2[PtCl6], H[AuCl4],
- 11. По типу лигандов Аминокомплексы: [Zn(NH3)4](OH)2 Аквакомплексы: [Co(H2O)6]Cl2 Гидроксидокомплексы (для амфотерных): Na3[Cr(OH)6], Na2[Zn(OH)4], Na2[Be(OH)4] Ацидокомплексы: K3[Fe(CN)6], Na3[Ag(S2O3)2]
- 12. По способности к ионизации Электролиты: Кислоты: H4[Fe(CN)6], H2[SiF6] Основания: [Ni(NH3)6](OH)2 r(Ni2+) = 0,078 нм, r([Ni(NH3)6]2+) =
- 13. Хелаты
- 14. По числу атомов комплексообразователя моноядерные - с одним атомом комплексообразователя) многоядерные (полиядерные) – с двумя и
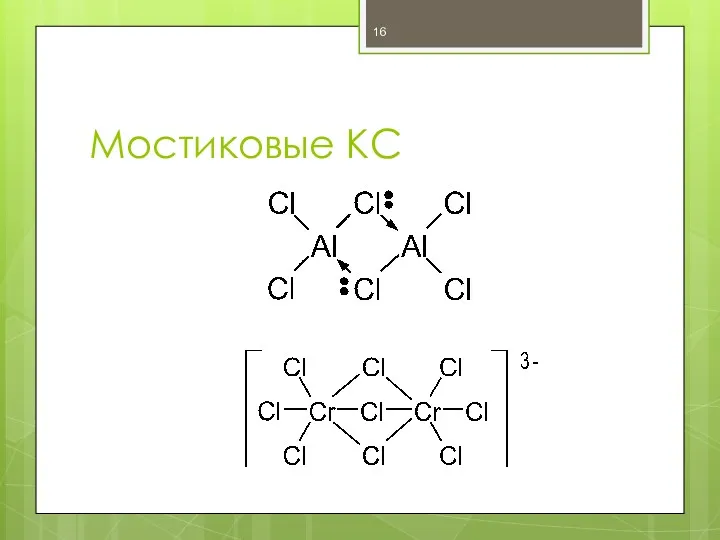
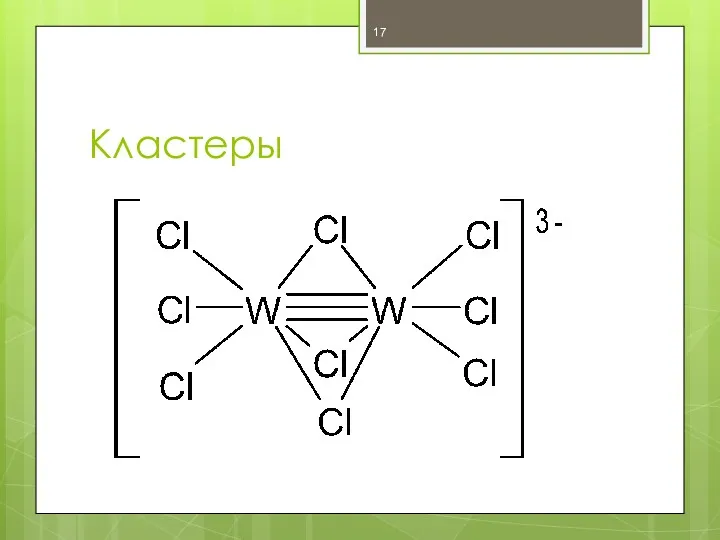
- 15. Полиядерные КС Мостиковые – лиганды частично или полностью находятся между атомами комплексообразователя Кластеры – КС, имеющие
- 16. Мостиковые КС
- 17. Кластеры
- 18. Номенклатура КС Название координационной единицы: перечисляют лиганды по алфавиту называют комплексообразователь в круглых скобках указывают его
- 19. Номенклатура КС Названия лигандов: анионных: фторидо (F-), оксидо (O2-), гидроксидо (OH-), пероксидо (O22-), цианидо (CN-),сульфато (SO42-),
- 20. Номенклатура КС Одинаковые лиганды Перед их названиями ставятся умножающие приставки, если лигандов: 2 – ди- 3
- 21. Примеры названий КС Нейтральные [CoCl3(NH3)3] – три(аммин)три(хлоридо)кобальт(III) [Co(H2O)4(NO2)2] – тетра(аква)ди(нитрито)кобальт(II) [Ni(CO)4] - тетракарбонилникель
- 22. Примеры названий КС С катионной координационной единицей: [Ag(NH3)2]Cl – хлорид диамминсеребра(I) [Pt(H2O)(NH3)2OH]NO3 – нитрат (аква)ди(аммин)(гидроксидо)платины(II) [CoCl2(NH3)4]Br
- 23. Примеры названий КС С анионной координационной единицей: Na3[Ag(S2O3)2] – бис(тиосульфато)аргентат(I) натрия K3[Co(NO2)6] – гексанитритокобальтат(III) калия FeK[Fe(CN)6]
- 24. Примеры названий КС С анионной и катионной координационными единицами: [Pd(NH3)4][PdCl6] – гексахлоридопалладат(IV) тетраамминпалладия(II) [Co(NH3)6][Co(NH3)2(NO2)4]3 – ди(аммин)тетра(нитрито)кобальтат(III)
- 25. Равновесия в водных растворах координационных соединений За счёт ионов внешней сферы КС являются сильными электролитами K3[Fe(CN)6]
- 26. Равновесия в водных растворах координационных соединений Ag+ + S2O32- [Ag(S2O3)]- [Ag(S2O3)]- + S2O32- [Ag(S2O3)2]3-
- 27. Равновесия в водных растворах координационных соединений Ag+ + 2S2O32- [Ag(S2O3)2]3- β0 = β1·β2 β1, β2 –
- 28. Равновесия в водных растворах координационных соединений Обратные константам образования величины K-1 называются константами нестойкости и характеризуют
- 29. Устойчивость комплексов Свойства комплексообразователя, определяющие прочность координационных связей: Электронное строение комплексообразователя Заряд иона комплексообразователя (чем больше
- 30. Устойчивость комплексов Свойства лигандов, определяющие устойчивость комплексов: Электронная структура Заряд Размеры Поляризуемость Дентатность Геометрические характеристики
- 31. Природа химической связи в КС Метод валентных связей Теория кристаллического поля Метод молекулярных орбиталей (теория поля
- 32. Метод валентных связей σ-Связь ковалентная двухэлектронная и двухцентровая образуется по донорно-акцепторному механизму Комплексообразователь – донор вакантной
- 33. Метод ВС Пример 1 Ион [BF4]- - тетраэдрический Степень окисления бора +III Электронно-графическая формула валентных электронных
- 34. Метод ВС Пример 2 Ион [Ag(CN)2]- - линейный Степень окисления серебра +I Электронно-графическая формула валентных электронных
- 35. Метод ВС Пример 3 Ион [Zn(OH)4]2- - тетраэдрический Степень окисления цинка +II Электронно-графическая формула валентных электронных
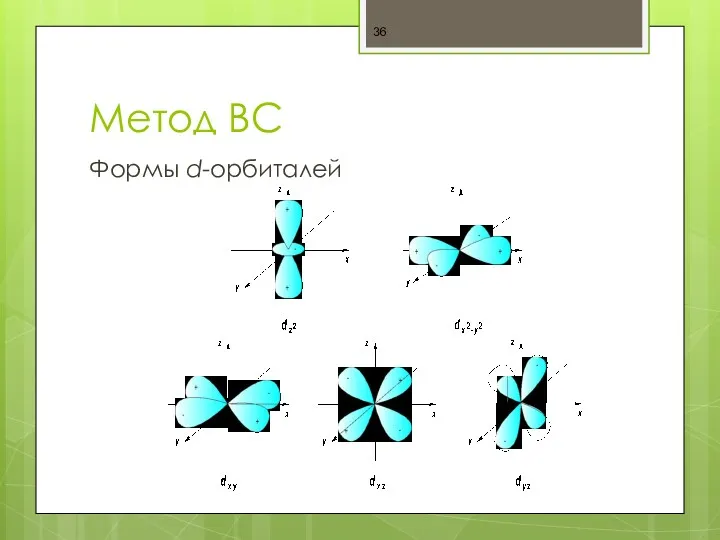
- 36. Метод ВС Формы d-орбиталей
- 37. Метод ВС Пример 4 Ион [Co(NH3)6]3+ - октаэдрический, диамагнитный, внутриорбитальный Степень окисления кобальта +III Электронно-графическая формула
- 38. Метод ВС Пример 5 Ион [CoF6]3- - октаэдрический, парамагнитный, внешнеорбитальный Степень окисления кобальта +III Электронно-графическая формула
- 39. Метод ВС Пример 6 Ион [SnCl6]2- - октаэдрический, диамагнитный, внешнеорбитальный Степень окисления олова +II Электронно-графическая формула
- 40. Теория кристаллического поля Механизм образования связей в координационных соединениях объясняется чисто электростатическим взаимодействием между центральным ионом
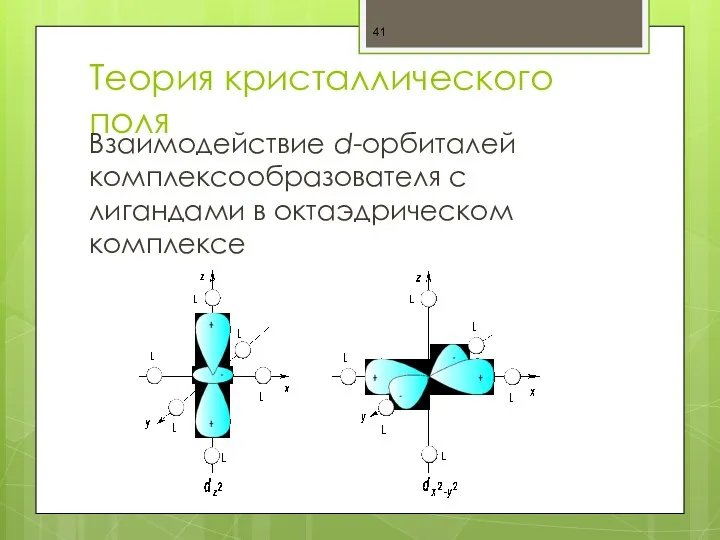
- 41. Теория кристаллического поля Взаимодействие d-орбиталей комплексообразователя с лигандами в октаэдрическом комплексе
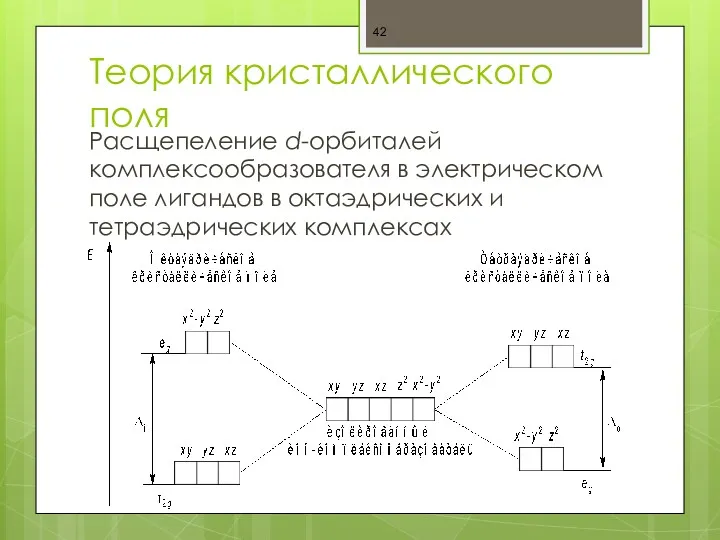
- 42. Теория кристаллического поля Расщепеление d-орбиталей комплексообразователя в электрическом поле лигандов в октаэдрических и тетраэдрических комплексах
- 43. Теория кристаллического поля Энергия расщепления с увеличением степени окисления комплексообразователя увеличивается Энергия расщепления при переходе от
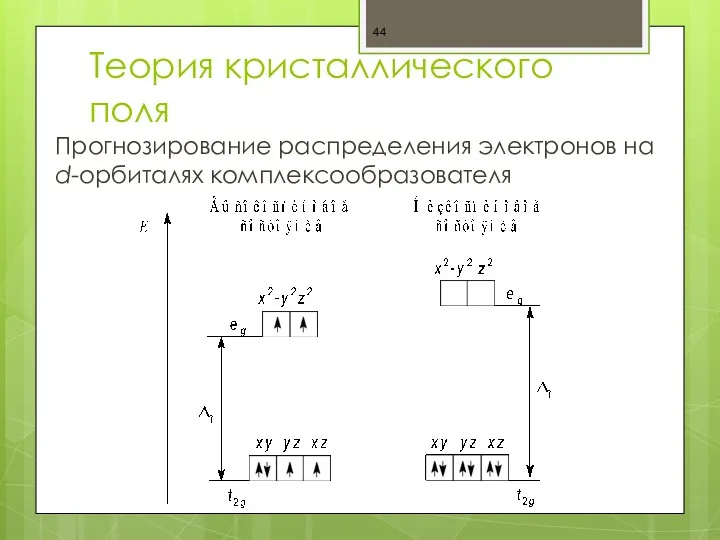
- 44. Теория кристаллического поля Прогнозирование распределения электронов на d-орбиталях комплексообразователя
- 45. Теория поля лигандов (метод МО) Орбитали комплексообразователя, участвующие в образовании комплекса: s-Орбиталь внешнего электронного слоя (1);
- 46. Теория поля лигандов (метод МО) Орбитали лигандов, участвующие в образовании комплекса: Орбитали с неподелёнными парами электронов
- 47. Теория поля лигандов (метод МО) Диаграмма уровней энергии нона [СоF6]3−
- 48. Дативная связь Свободные π*-МО лигандов и dxy-, dyz-, dxz-орбитали (t2g-орбитали) комплексообразователя с НЭП могут образовывать связывающие
- 49. Достоинства и недостатки МВС и ТКП МВС хорошо объясняет пространственное строение комплексов МВС не прогнозирует электронные
- 50. Достоинства и недостатки МВС и ТКП ТКП объясняет (но не прогнозирует) электронные спектры поглощения, магнитные и
- 51. Изомерия координационных соединений Изомеры — соединения, молекулы которых имеют одинаковый состав, но разное строение. В связи
- 52. Виды изомерии Пространственная Геометрическая; Конфигурационная (оптическая) Координационная Ионизационная Связевая Гидратная Трансформационная
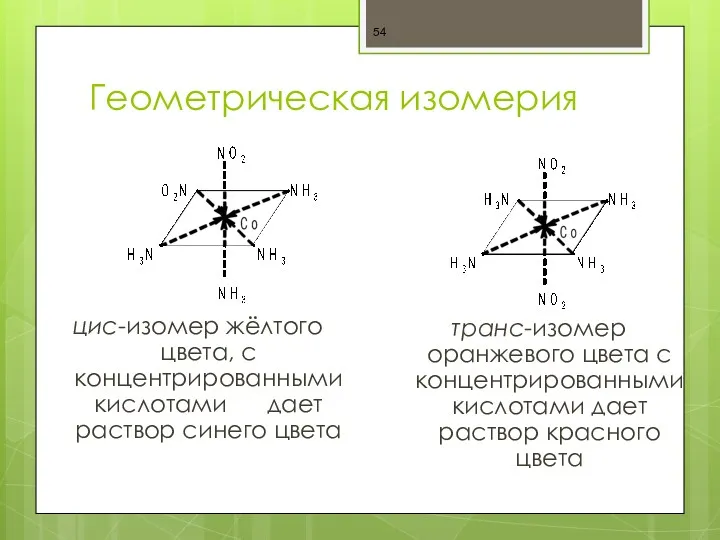
- 53. Геометрическая изомерия Диамминдихлоридоплатина(II) цис-изомер желтого цвета, c концентрированными кислотами дает раствор синего цвета транс-изомер оранжевого цвета,
- 54. Геометрическая изомерия цис-изомер жёлтого цвета, с концентрированными кислотами дает раствор синего цвета транс-изомер оранжевого цвета с
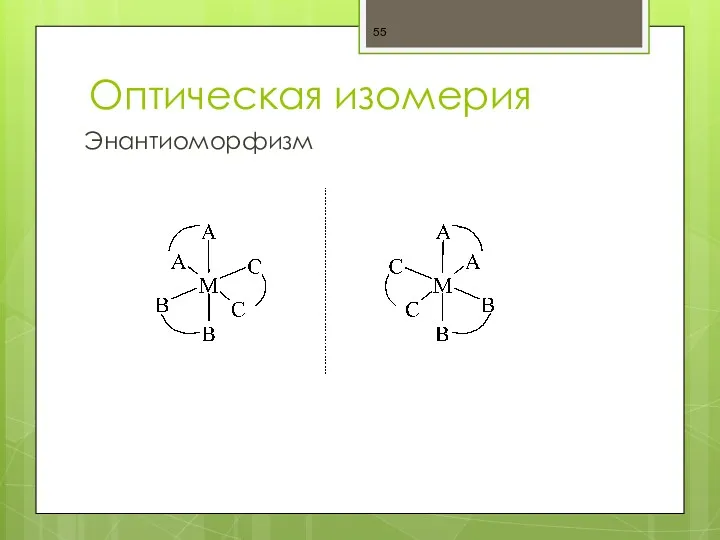
- 55. Оптическая изомерия Энантиоморфизм
- 56. Гидратная изомерия [Cr(H2O)6]Cl3 - фиолетовый [Cr(H2O)5Cl]Cl2·Н2O - светло-зелёный [Cr(H2O)4Cl2]Сl·2H2O - тёмно-зелёный
- 57. Координационная изомерия [Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4]
- 58. Ионизационная изомерия [Pd(NH3)4Cl2]Br2 → [Pd(NH3)4Cl2]2+ + 2Br- [Pd(NH3)4Br2]Cl2 → [Pd(NH3)4Br2]2+ + 2Cl-
- 59. Связевая изомерия или изомерия связи В случае амбидентатных лигандов (NO2-, NCS- и др.) [Co(NH3)5NO2]Сl и [Co(NH3)5ONO]Cl
- 60. Трансформационная изомерия (NH4)2[Pd(SCN)4] [Pd(NH2C(S)NH2)2(SCN)2]
- 61. Получение КС Комплексы анионного типа: Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] BiI3
- 62. Получение КС Комплексы катионного типа: (CuOH)2SO4 + 10NH3·H2O = = 2[Cu(NH3)4](OH)2 + (NH4)2SO4 + 10H2O AgCl
- 63. Получение КС Соединения с комплексными анионом и катионом: Ni2[Fe(CN)6] + 12NH3·H2O = = [Ni(NH3)6]2[Fe(CN)6] + 12H2O
- 64. Получение КС Хелаты: Fe(OH)3 + 3C2H2O4 = H3[Fe(C2O4)3] + 3H2O
- 65. Получение КС Хелаты: NiSO4 + NH3·H2O + 2C4H8N2O2 = = [Ni(C4H7N2O2)2] + (NH4)2SO4 + 2H2O
- 66. Химические свойства КС Реакции обмена Окислительно-восстановительные реакции
- 67. Реакции обмена Обмен ионов внешней сферы K4[Fe(CN)6] + 2NiCl2 = Ni2[Fe(CN)6]↓ + 4KCl [Fe(CN)6]4- + 2Ni2+
- 68. Реакции обмена Образование более устойчивых комплексных ионов (связывание комплексообразователя с новым лигандом) [Ag(NH3)2]Cl + 2Na2S2O3 =
- 69. Реакции обмена При нагревании [Co(H2O)6]Cl2 = [CoCl2(H2O)4] + 2H2O розовый синий
- 70. Реакции обмена Связывание комплексообразователя в малорастворимое соединение [Fe(H2O)6](NH4)2(SO4)2 + 2NaOH = = Fe(OH)2↓ + (NH4)2SO4 +
- 71. Реакции обмена [Al(H2O)6][K(H2O)6](SO4)2 + 3KOH = = Al(OH)3↓ + 2K2SO4 + 12H2O [Cu(NH3)4](OH)2 + Na2S =
- 72. Реакции обмена Связывание лигандов в более устойчивые координационные соединения [Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
- 73. Окислительно-восстановительные реакции 5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O
- 74. Окислительно-восстановительные реакции 2[Co(H2O)6]Cl2 + 6Mg = = Co[CoCl4] + 6Mg(OH)2 + 6H2 При ультрафиолетовом облучении 6[Cu(NH3)4]Cl2
- 76. Скачать презентацию

![Терминология и обозначения координационная единица (внутренняя сфера) 3KCN + Fe(CN)3 = K3[Fe(CN)6] внешняя сфера комплексообразователь лиганды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-2.jpg)






![КС по заряду комплексного иона С комплексным катионом: [Cu(NH3)4]SO4, [Cr(H2O)6]Cl3,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-9.jpg)
2 Аквакомплексы: [Co(H2O)6]Cl2 Гидроксидокомплексы (для амфотерных):](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-10.jpg)
![По способности к ионизации Электролиты: Кислоты: H4[Fe(CN)6], H2[SiF6] Основания: [Ni(NH3)6](OH)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-11.jpg)





![Примеры названий КС Нейтральные [CoCl3(NH3)3] – три(аммин)три(хлоридо)кобальт(III) [Co(H2O)4(NO2)2] – тетра(аква)ди(нитрито)кобальт(II) [Ni(CO)4] - тетракарбонилникель](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-20.jpg)
![Примеры названий КС С катионной координационной единицей: [Ag(NH3)2]Cl – хлорид](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-21.jpg)
![Примеры названий КС С анионной координационной единицей: Na3[Ag(S2O3)2] – бис(тиосульфато)аргентат(I)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-22.jpg)
![Примеры названий КС С анионной и катионной координационными единицами: [Pd(NH3)4][PdCl6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-23.jpg)

![Равновесия в водных растворах координационных соединений Ag+ + S2O32- [Ag(S2O3)]- [Ag(S2O3)]- + S2O32- [Ag(S2O3)2]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-25.jpg)
![Равновесия в водных растворах координационных соединений Ag+ + 2S2O32- [Ag(S2O3)2]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-26.jpg)





![Метод ВС Пример 1 Ион [BF4]- - тетраэдрический Степень окисления](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-32.jpg)
![Метод ВС Пример 2 Ион [Ag(CN)2]- - линейный Степень окисления](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-33.jpg)
![Метод ВС Пример 3 Ион [Zn(OH)4]2- - тетраэдрический Степень окисления](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-34.jpg)
![Метод ВС Пример 4 Ион [Co(NH3)6]3+ - октаэдрический, диамагнитный, внутриорбитальный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-36.jpg)
![Метод ВС Пример 5 Ион [CoF6]3- - октаэдрический, парамагнитный, внешнеорбитальный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-37.jpg)
![Метод ВС Пример 6 Ион [SnCl6]2- - октаэдрический, диамагнитный, внешнеорбитальный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-38.jpg)




![Теория поля лигандов (метод МО) Диаграмма уровней энергии нона [СоF6]3−](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-46.jpg)






![Гидратная изомерия [Cr(H2O)6]Cl3 - фиолетовый [Cr(H2O)5Cl]Cl2·Н2O - светло-зелёный [Cr(H2O)4Cl2]Сl·2H2O - тёмно-зелёный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-55.jpg)
![Координационная изомерия [Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-56.jpg)
![Ионизационная изомерия [Pd(NH3)4Cl2]Br2 → [Pd(NH3)4Cl2]2+ + 2Br- [Pd(NH3)4Br2]Cl2 → [Pd(NH3)4Br2]2+ + 2Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-57.jpg)
![Связевая изомерия или изомерия связи В случае амбидентатных лигандов (NO2-, NCS- и др.) [Co(NH3)5NO2]Сl и [Co(NH3)5ONO]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-58.jpg)
![Трансформационная изомерия (NH4)2[Pd(SCN)4] [Pd(NH2C(S)NH2)2(SCN)2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-59.jpg)
![Получение КС Комплексы анионного типа: Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-60.jpg)

![Получение КС Соединения с комплексными анионом и катионом: Ni2[Fe(CN)6] + 12NH3·H2O = = [Ni(NH3)6]2[Fe(CN)6] + 12H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-62.jpg)
![Получение КС Хелаты: Fe(OH)3 + 3C2H2O4 = H3[Fe(C2O4)3] + 3H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-63.jpg)
![Получение КС Хелаты: NiSO4 + NH3·H2O + 2C4H8N2O2 = = [Ni(C4H7N2O2)2] + (NH4)2SO4 + 2H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-64.jpg)

![Реакции обмена Обмен ионов внешней сферы K4[Fe(CN)6] + 2NiCl2 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-66.jpg)

![Реакции обмена При нагревании [Co(H2O)6]Cl2 = [CoCl2(H2O)4] + 2H2O розовый синий](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-68.jpg)
2(SO4)2 + 2NaOH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-69.jpg)
![Реакции обмена [Al(H2O)6][K(H2O)6](SO4)2 + 3KOH = = Al(OH)3↓ + 2K2SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-70.jpg)
![Реакции обмена Связывание лигандов в более устойчивые координационные соединения [Ag(NH3)2]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-71.jpg)
![Окислительно-восстановительные реакции 5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = = 5K3[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-72.jpg)
![Окислительно-восстановительные реакции 2[Co(H2O)6]Cl2 + 6Mg = = Co[CoCl4] + 6Mg(OH)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265845/slide-73.jpg)
 Синтетический каучук и его применение
Синтетический каучук и его применение Трансмиссионные масла
Трансмиссионные масла 20230816_belki_2
20230816_belki_2 Геохимия урана и тория в магматическом процессе
Геохимия урана и тория в магматическом процессе Вуглеводи
Вуглеводи Ртуть
Ртуть Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Химия нефти и газа
Химия нефти и газа Indicatori di pH
Indicatori di pH Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Серная кислота
Серная кислота Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Метал конструкциялық материалдар
Метал конструкциялық материалдар Місце хімії серед наук про природу
Місце хімії серед наук про природу Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Химия элементов VIIA группы
Химия элементов VIIA группы Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Классы органических соединений
Классы органических соединений Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Состав и классификация магматических горных пород
Состав и классификация магматических горных пород Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения?