Содержание
- 2. Что такое фазовые диаграммы? Фазовые диаграммы – это способ графического представления состояния равновесия систем, с указанием
- 3. Основные замечания Для конденсированных систем свойства фаз слабо зависят от давления. Поэтому С=К-Ф+1 Если в системе
- 4. Какие фазы находятся в равновесии в сплаве Какой состав имеют фазы в равновесии Какое количество (масса)
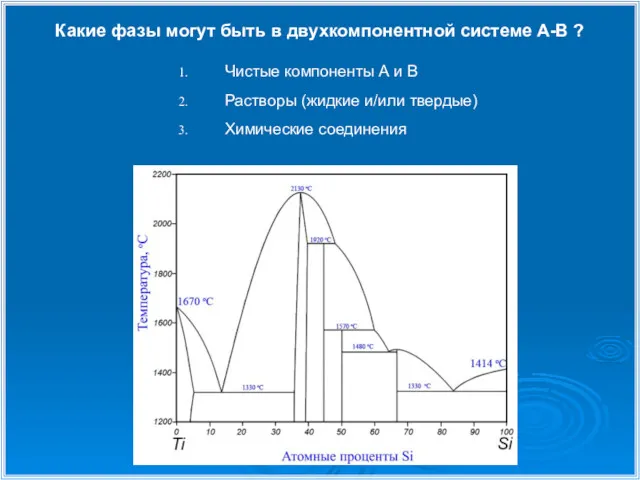
- 5. Какие фазы могут быть в двухкомпонентной системе А-В ? Чистые компоненты А и В Растворы (жидкие
- 6. Типы равновесий: 1) Возможно образование жидких растворов любой концентрации. В твердом состоянии вещества не растворяются друг
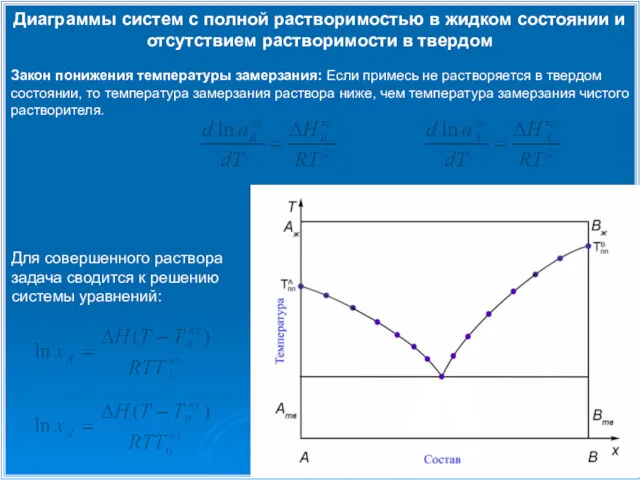
- 7. Диаграммы систем с полной растворимостью в жидком состоянии и отсутствием растворимости в твердом Для совершенного раствора
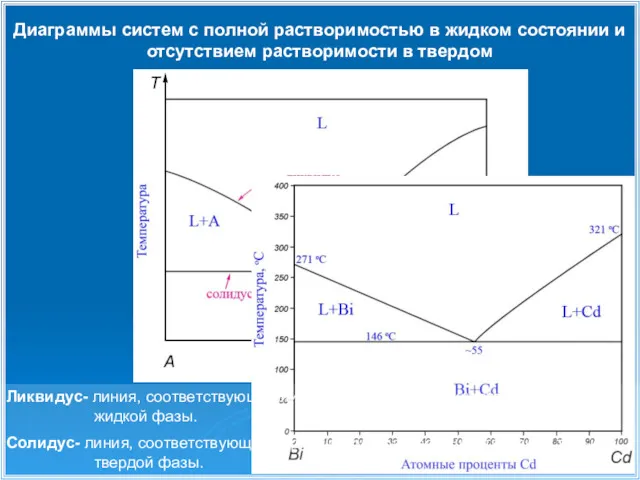
- 8. Диаграммы систем с полной растворимостью в жидком состоянии и отсутствием растворимости в твердом Ликвидус- линия, соответствующая
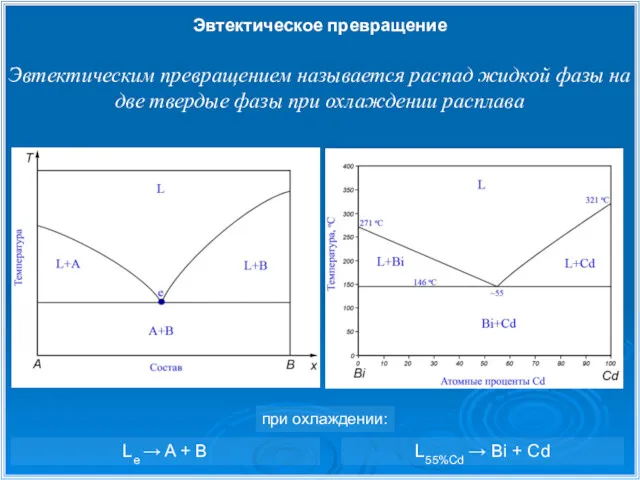
- 9. Эвтектическое превращение Эвтектическим превращением называется распад жидкой фазы на две твердые фазы при охлаждении расплава L55%Cd
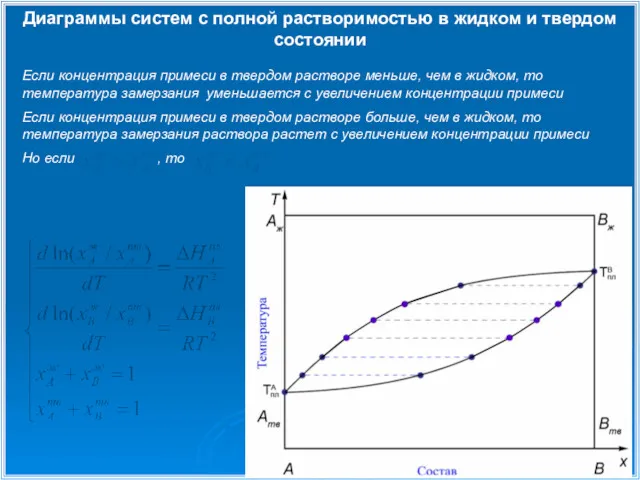
- 10. Диаграммы систем с полной растворимостью в жидком и твердом состоянии Если концентрация примеси в твердом растворе
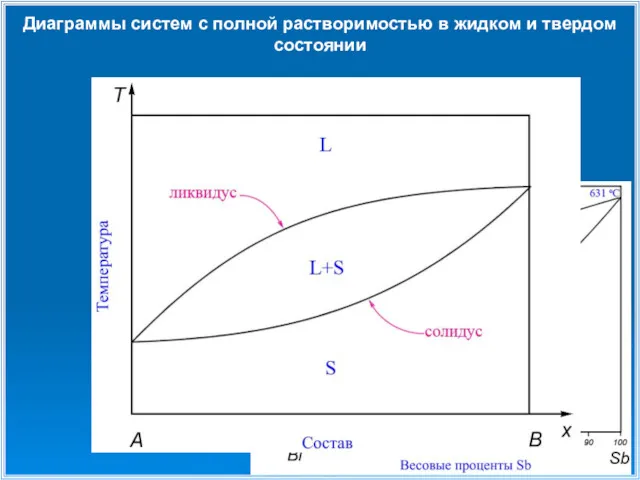
- 11. Диаграммы систем с полной растворимостью в жидком и твердом состоянии
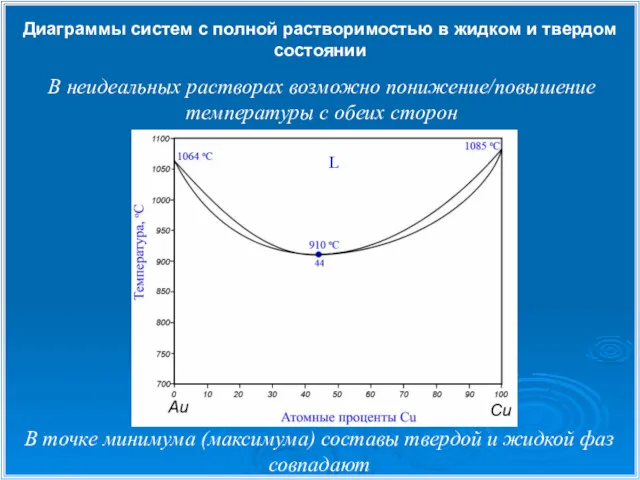
- 12. Диаграммы систем с полной растворимостью в жидком и твердом состоянии В точке минимума (максимума) составы твердой
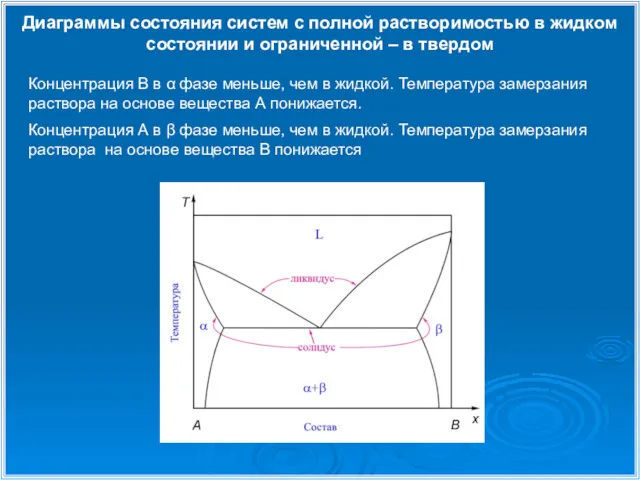
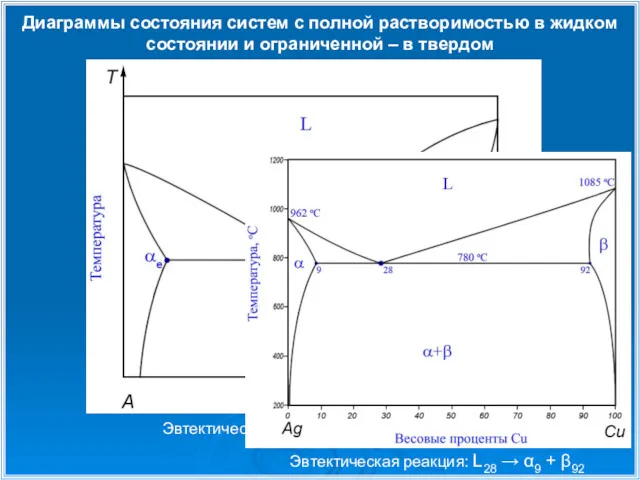
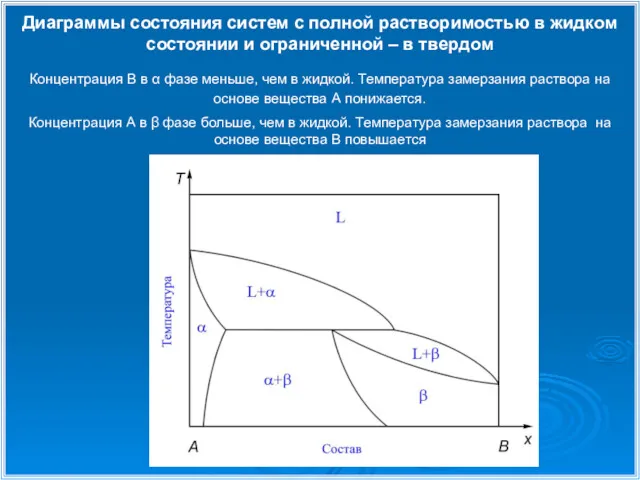
- 13. Диаграммы состояния систем с полной растворимостью в жидком состоянии и ограниченной – в твердом Концентрация В
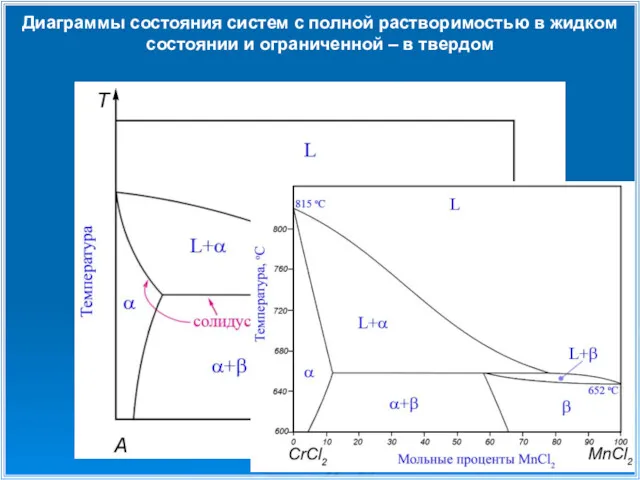
- 14. Диаграммы состояния систем с полной растворимостью в жидком состоянии и ограниченной – в твердом
- 15. Диаграммы состояния систем с полной растворимостью в жидком состоянии и ограниченной – в твердом Концентрация В
- 16. Диаграммы состояния систем с полной растворимостью в жидком состоянии и ограниченной – в твердом
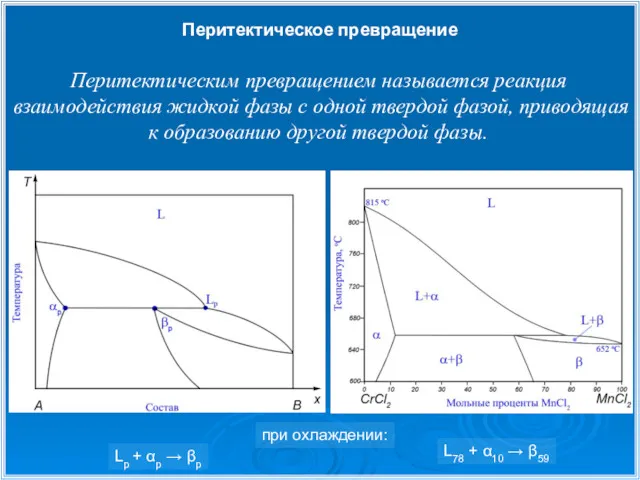
- 17. Перитектическое превращение Перитектическим превращением называется реакция взаимодействия жидкой фазы c одной твердой фазой, приводящая к образованию
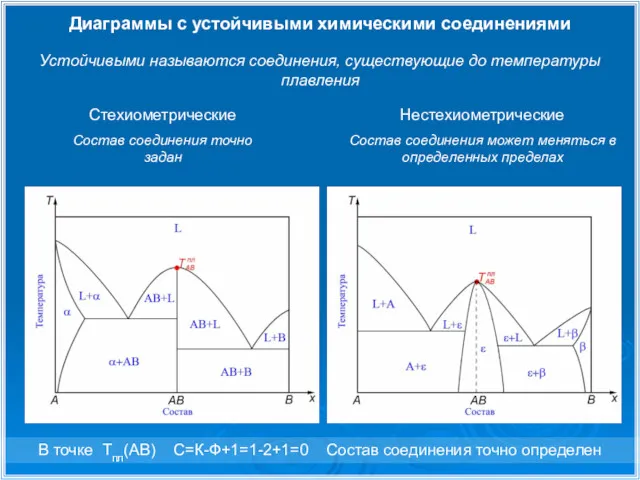
- 18. Диаграммы с устойчивыми химическими соединениями Стехиометрические Состав соединения точно задан Нестехиометрические Состав соединения может меняться в
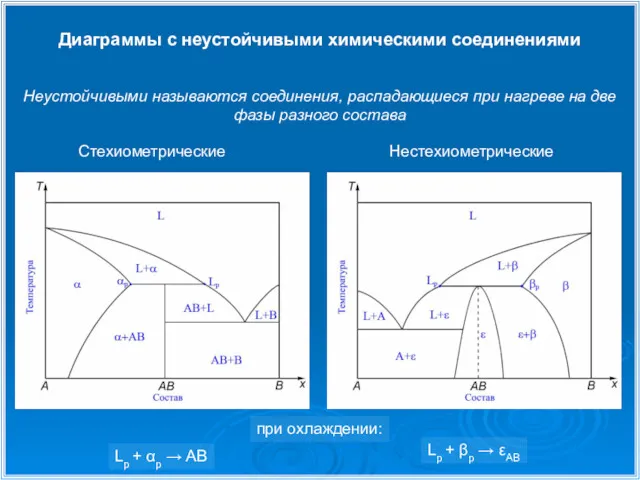
- 19. Диаграммы с неустойчивыми химическими соединениями Стехиометрические Нестехиометрические Неустойчивыми называются соединения, распадающиеся при нагреве на две фазы
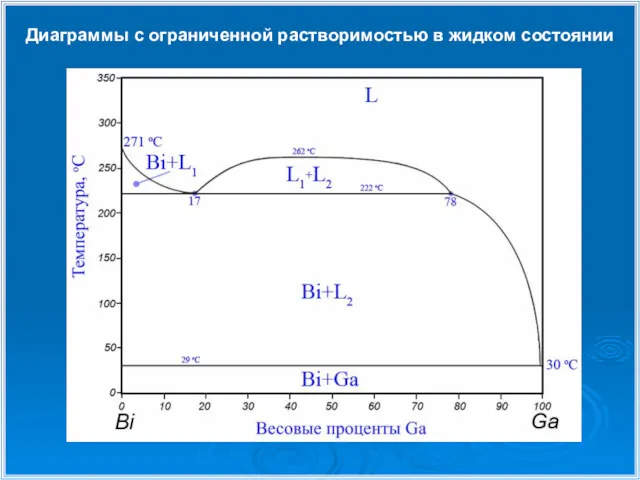
- 20. Диаграммы с ограниченной растворимостью в жидком состоянии
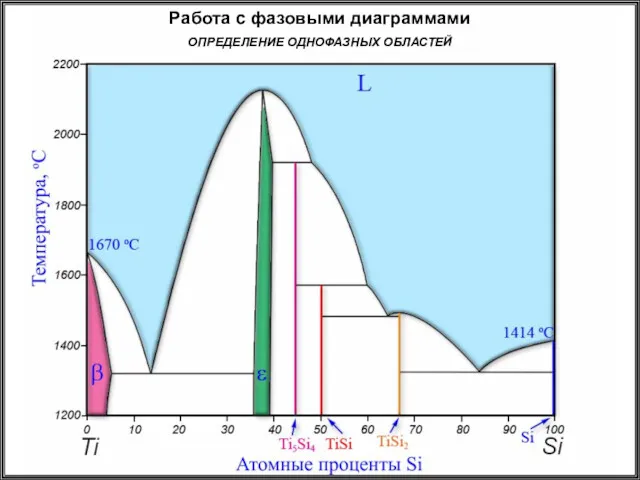
- 21. Работа с фазовыми диаграммами ОПРЕДЕЛЕНИЕ ОДНОФАЗНЫХ ОБЛАСТЕЙ
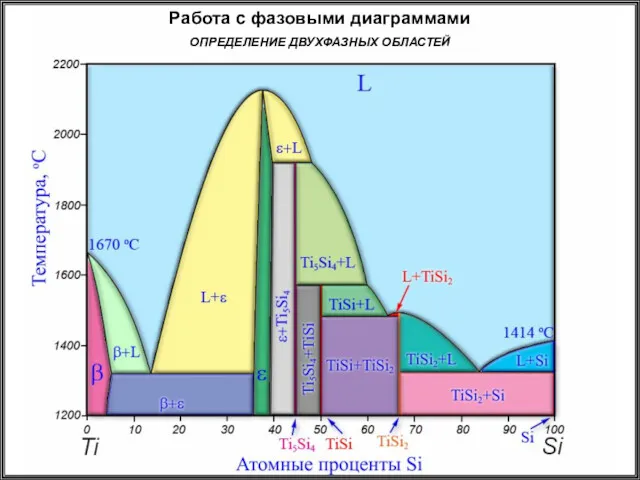
- 22. Работа с фазовыми диаграммами ОПРЕДЕЛЕНИЕ ДВУХФАЗНЫХ ОБЛАСТЕЙ
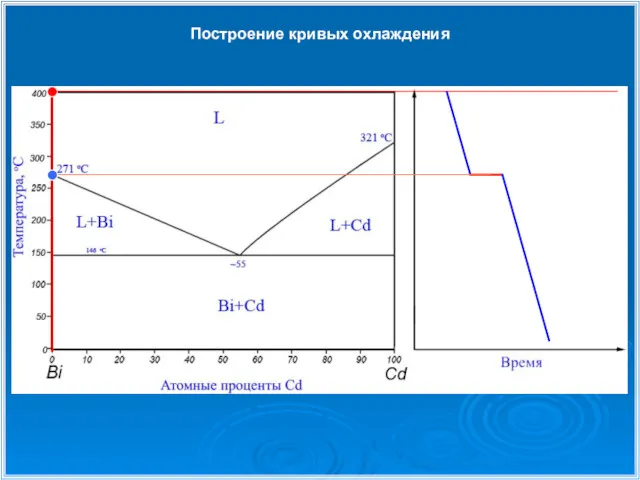
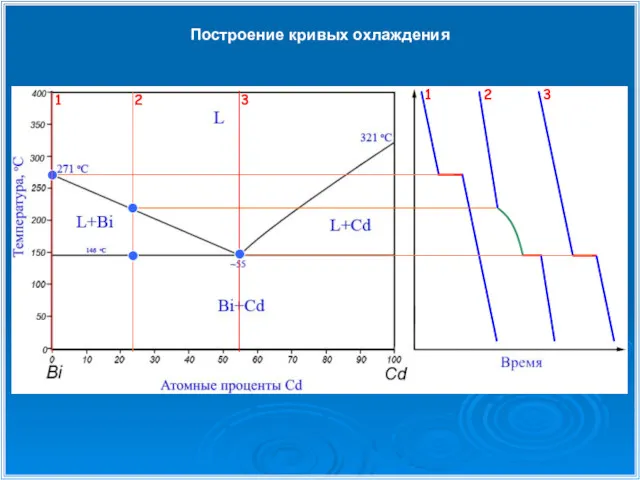
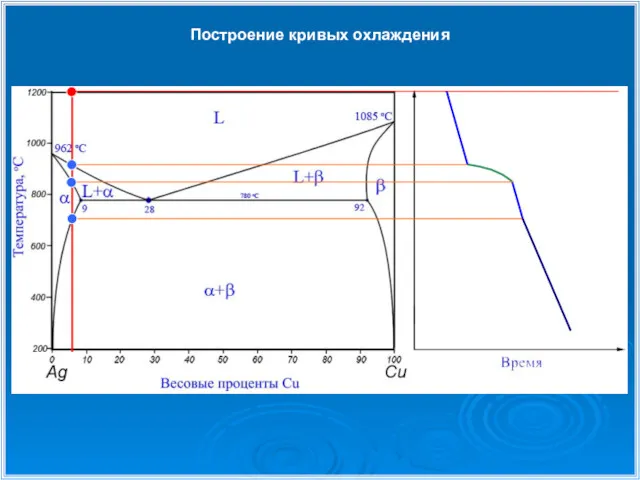
- 23. Построение кривых охлаждения
- 24. Построение кривых охлаждения
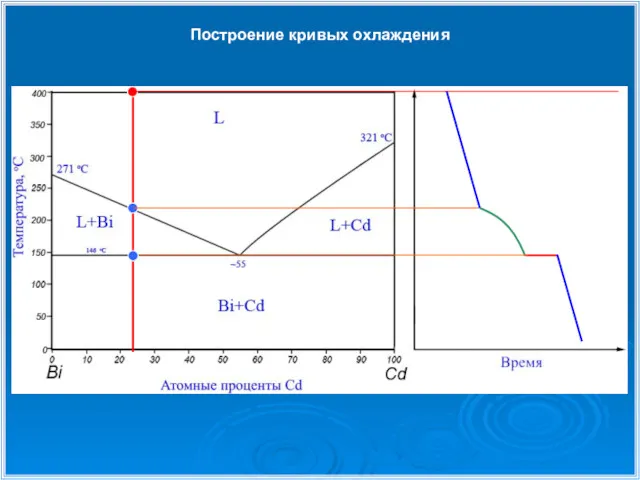
- 25. Построение кривых охлаждения
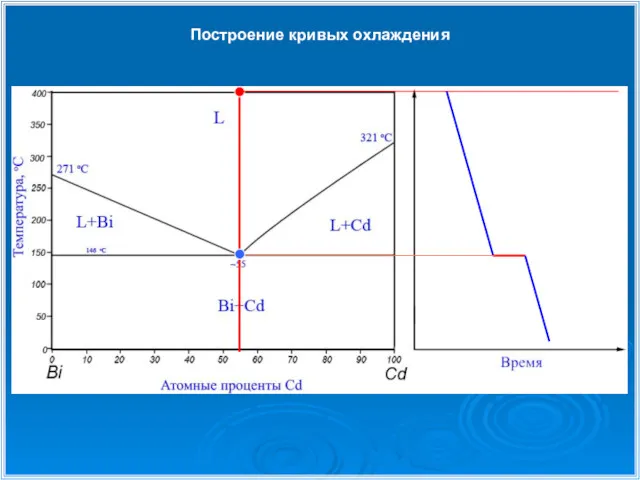
- 26. Построение кривых охлаждения 1 1 2 2 3 3
- 27. Построение кривых охлаждения
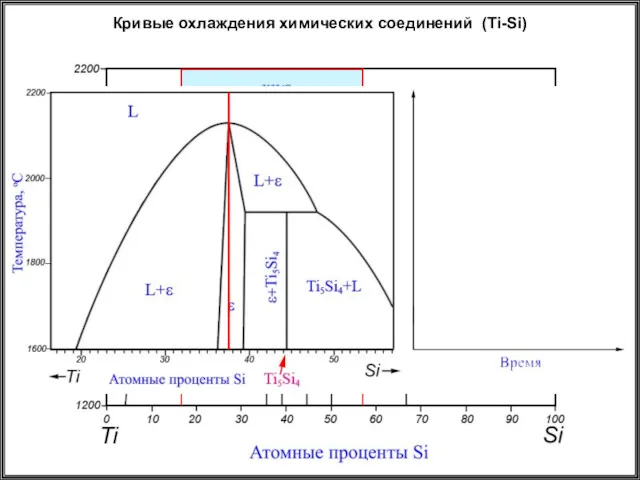
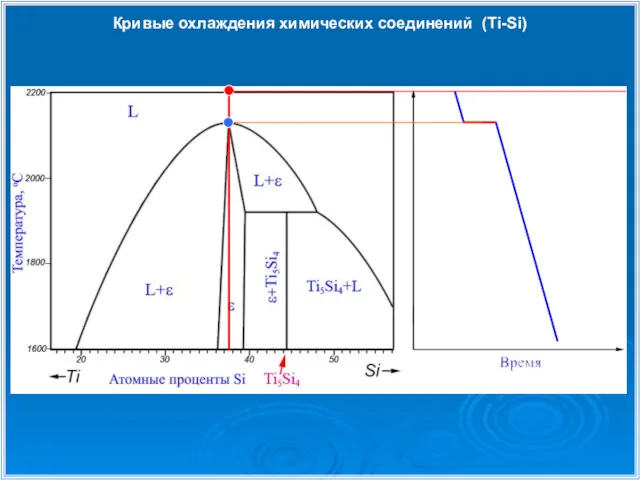
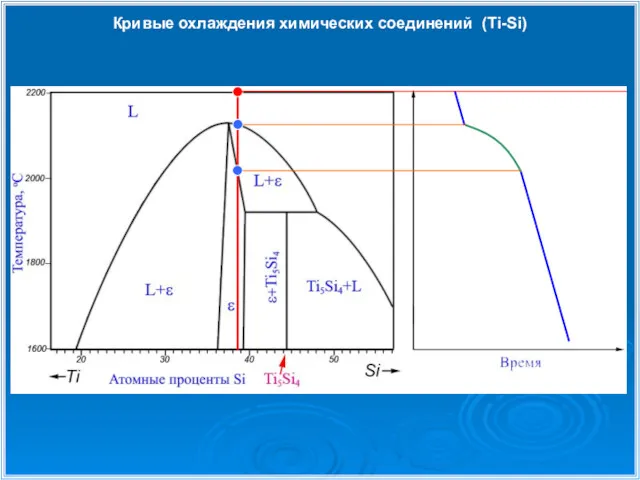
- 28. Кривые охлаждения химических соединений (Ti-Si)
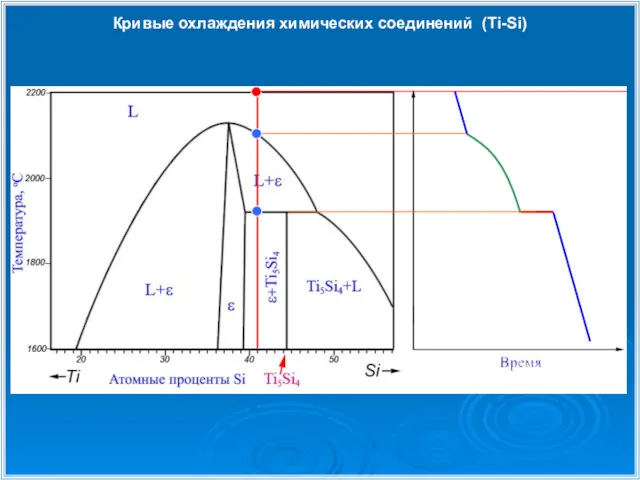
- 29. Кривые охлаждения химических соединений (Ti-Si)
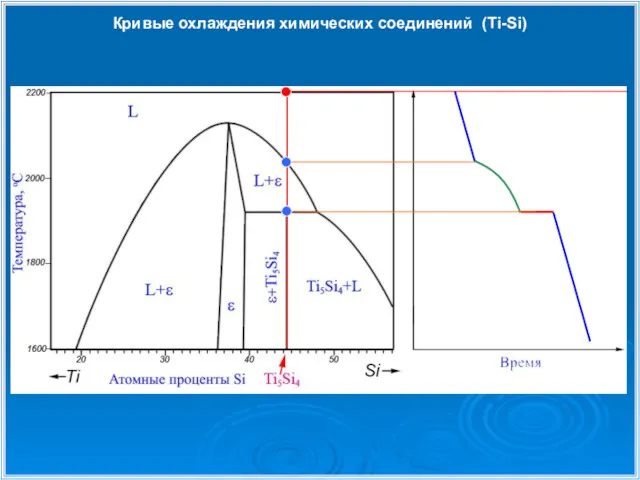
- 30. Кривые охлаждения химических соединений (Ti-Si)
- 31. Кривые охлаждения химических соединений (Ti-Si)
- 32. Кривые охлаждения химических соединений (Ti-Si)
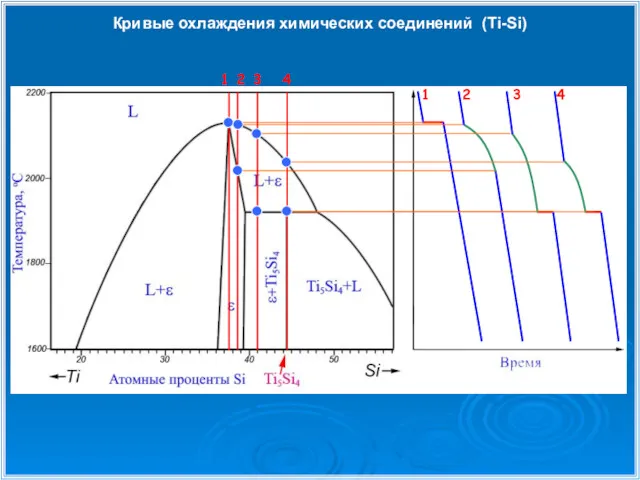
- 33. Кривые охлаждения химических соединений (Ti-Si) 1 1 2 2 3 4 4 3
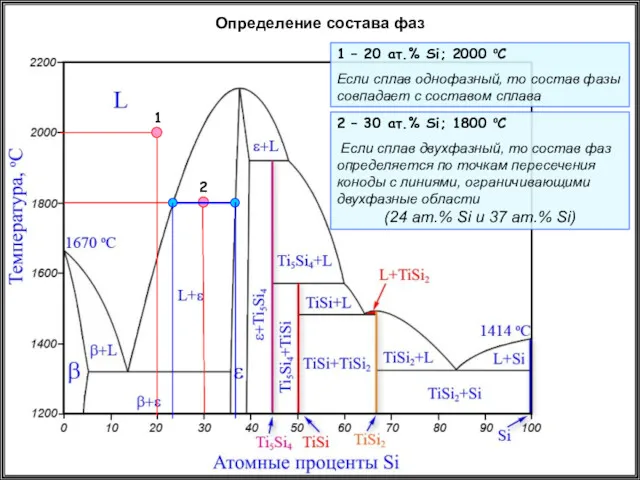
- 34. Определение состава фаз 1 – 20 ат.% Si; 2000 oC Если сплав однофазный, то состав фазы
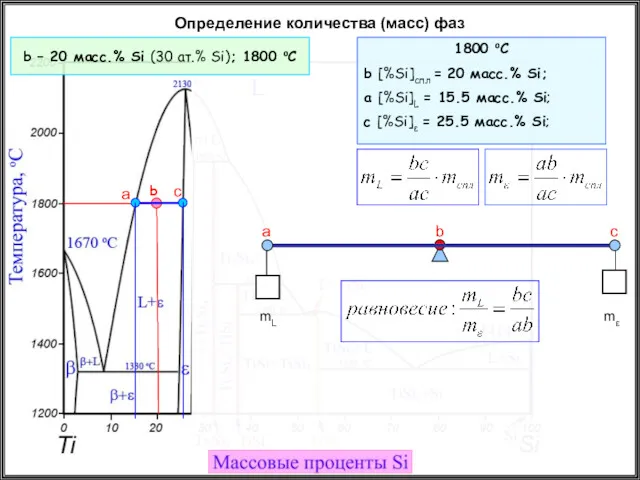
- 35. Определение количества (масс) фаз b – 20 масс.% Si (30 ат.% Si); 1800 oC a b
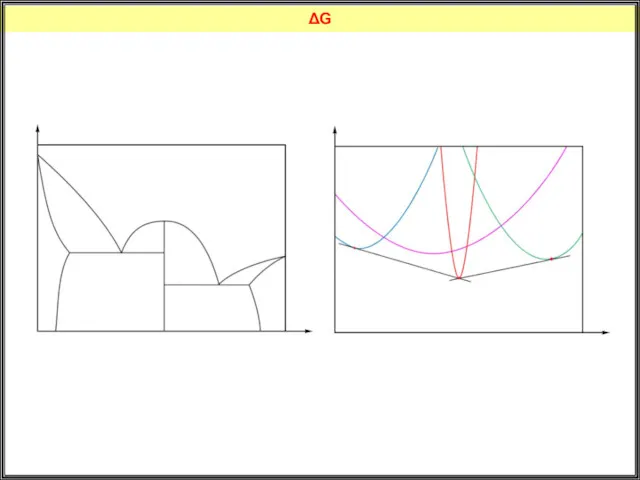
- 36. ΔG
- 38. Скачать презентацию




 Atomic mass
Atomic mass Бытовая химия
Бытовая химия Каучук. Открытие каучука
Каучук. Открытие каучука Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Кремний и его соединения
Кремний и его соединения Типы химических реакций в органической химии
Типы химических реакций в органической химии Химическая связь. 8 класс
Химическая связь. 8 класс Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция Ациклические углеводороды
Ациклические углеводороды Углеводы (сахариды)
Углеводы (сахариды) Стекло. Виды стекол
Стекло. Виды стекол Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Цікаві історичні факти з походження назв хімічних елементів
Цікаві історичні факти з походження назв хімічних елементів Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Кислород и оксиген
Кислород и оксиген История открытия кислорода
История открытия кислорода Неорганические соединения галогенов
Неорганические соединения галогенов Выращивание кристаллов
Выращивание кристаллов Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Задачи по химии
Задачи по химии Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств