Содержание
- 2. Термодинамические системы
- 5. Термодинамический метод Химическая термодинамика изучает: - энергетические эффекты химических процессов; - возможности самопроизвольного протекания процессов.
- 6. Первый закон термодинамики. Термодинамические параметры и функции состояния
- 7. Функции состояния
- 11. возможно протекание процесса при постоянном давлении (р=const) -поршень при этом свободно передвигается (рис. а) - и
- 13. Стандартными считаются следующие условия: температура - 298 К; давление - 101325 Па.
- 16. индекс f от английского formation - образование
- 17. 3К2О(тв) +2АІ(тв) =АІ2О3 (тв) +6К(тв), ΔН= ? Согласно первому следствию из закона Гесса:
- 18. Произведем расчет энергии связи в молекуле хлороводорода (Есв. (НСІ)): Н (г)+СІ(г)=НСІ(г), Тепловой эффект такой реакции: Теплота
- 19. Второе следствие. (Используется только при тепловых расчетах реакций между органическими веществами.) Тепловой эффект реакции между органическими
- 21. Самопроизвольные процессы. Энтропия, второе начало термодинамики Постулат Клаузиуса. Невозможен самопроизвольный переход теплоты от холодного тела к
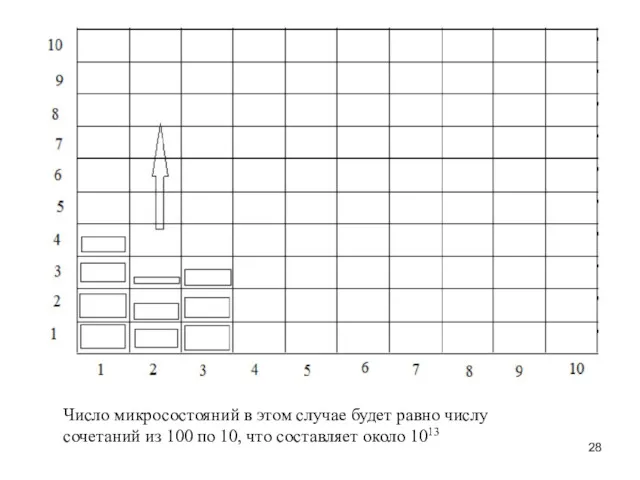
- 28. Число микросостояний в этом случае будет равно числу сочетаний из 100 по 10, что составляет около
- 29. Физический смысл энтропии заключается в том, что она выражает ту часть энергии системы, которая не может
- 30. Пример: S 1 моля льда - 11,46 кал/моль градус или 46 Дж/моль∙К жидкой воды-16,72 кал/моль градус
- 31. Энергия Гиббса. Критерии направления самопроизвольных химических процессов в обычных условиях горение водорода происходит самопроизвольно: Н2(г)+ 1/2
- 32. Уравнение Гиббса: ∆G = ∆Н -Т∆S Уравнение можно записать в виде: ∆Н =∆G + Т∆S В
- 36. Скачать презентацию
































 Основные понятия. Химический язык
Основные понятия. Химический язык Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Оксиди нітрогену
Оксиди нітрогену Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Алкадиены
Алкадиены Энергетическое топливо и его классификация
Энергетическое топливо и его классификация Білки (протеїни)
Білки (протеїни) Строение и свойства материалов
Строение и свойства материалов Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов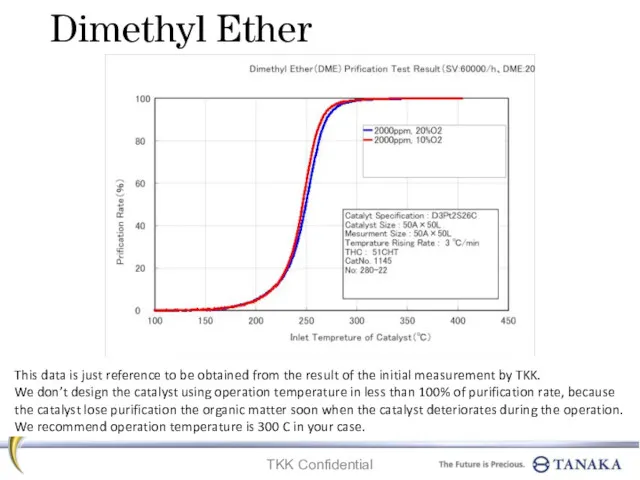 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Озон. Строние молекулы озона
Озон. Строние молекулы озона Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля