Содержание
- 2. Fe Это элемент № 26 Это элемент 4- ого периода Четвертый по распространенности элемент в земной
- 3. Электронное строение железа
- 4. Нахождение в природе В земной коре железо распространено достаточно широко — на его долю приходится около
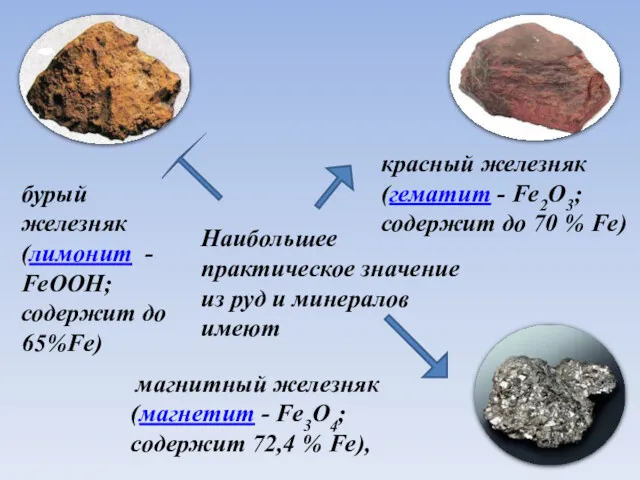
- 5. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 6. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 7. Физические свойства железа Железо- сравнительно мягкий , ковкий серебристо-серый металл Температура плавления 15350C Температура кипения 28000C
- 8. Возможные пути получения железа В промышленности: 2 Fe2O3 + 3 C = 2 Fe2 + 3
- 9. Химические свойства 1. Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4Fe +3O2=2Fe2O3 Реагирует
- 10. Химические свойства 2. Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe
- 11. Оксид железа (II) (закись железа) Черное кристалличсекое вещество. Не растворяется в воде. Порошок оксида легко окисляется.
- 12. Оксид железа (II) (закись железа) Проявляет преимущественно основные свойства. В воде не растворяется, легко растворяется в
- 13. Гидроксид железа (II) Cвежеосажденном виде имеет серовато-зеленую окраску, в воде не растворяется, при температуре выше 150
- 14. Гидроксид железа (II) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. Проявляет слабовыраженные амфотерные свойства с преобладанием
- 15. Оксид железа (III) Вещество бурого цвета, существует в трех полиморфных модификациях. Получается при термическом разложении гидроксида
- 16. Оксид железа (III) Проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами: Fe2O3 +
- 17. В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
- 18. Гидроксид железа (III) Кристаллическое или аморфное вещество бурого цвета. Как и оксид, проявляет слабовыраженные амфотерные свойства
- 19. Гидроксид железа (III) Легко реагирует с кислотами: Fe(OH)3 + 3HCl = FeCl3 + 3H2O. Реагирует с
- 20. Соли железа (III) Кроме того, ионы Fe3+ определяют по характерному кроваво-красному окрашиванию роданида железа (III), который
- 21. Железо в организме Железо присутствует в организмах всех растений и животных, но в малых количествах (в
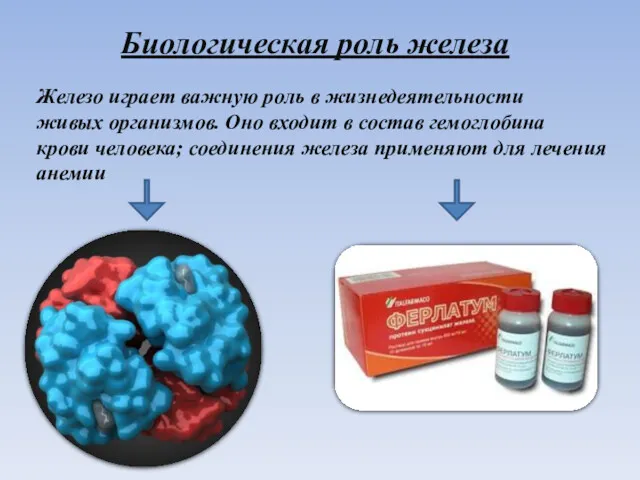
- 22. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 23. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и
- 24. Люди впервые овладели железом в четвертом-третьем тысячелетиях до н. э., подбирая упавшие с неба камни —
- 25. Применение железа, его сплавов и соединений Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении
- 27. Скачать презентацию





















 Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Общая химия.(Лекция№1). Основные законы и понятия химии
Общая химия.(Лекция№1). Основные законы и понятия химии Воздух, которым мы дышим
Воздух, которым мы дышим Щелочноземельные металлы
Щелочноземельные металлы Пиролиз углеводородов
Пиролиз углеводородов Соединения галогенов
Соединения галогенов Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Происхождение химичесих элементов
Происхождение химичесих элементов Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Теория электролитической диссоциации
Теория электролитической диссоциации Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах Природные источники углеводородов
Природные источники углеводородов Кислород и его применение
Кислород и его применение Chemical kinetics
Chemical kinetics Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Классификация химических элементов
Классификация химических элементов Protecting-Group-Free Enantioselective Synthesis of (-)-Pallavicinin and (+)-Neopallavicinin
Protecting-Group-Free Enantioselective Synthesis of (-)-Pallavicinin and (+)-Neopallavicinin Углеводы. Олигосахариды. Полисахариды. Биоорганическая химия
Углеводы. Олигосахариды. Полисахариды. Биоорганическая химия Химическая связь
Химическая связь Классификация химических реакций
Классификация химических реакций Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Валентность химических элементов
Валентность химических элементов Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory