Содержание
- 2. Цели урока: Ознакомление с понятием классификация и её первыми попытками по отношению к химическим элементам; Развитие
- 3. Что такое классификация? Классификация – это распределение объектов по определенным группам (классам) на основе отличительных признаков.
- 4. XIX век Известно 63 элемента. Это много , но не все, что не дает полноты картины.
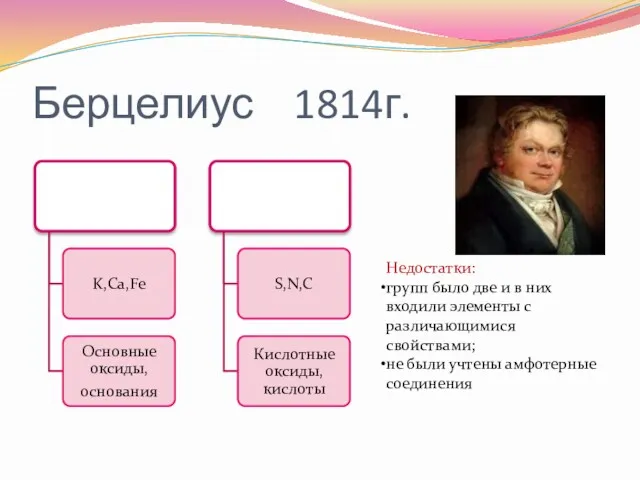
- 5. Берцелиус 1814г. Недостатки: групп было две и в них входили элементы с различающимися свойствами; не были
- 8. Дёберейнер 1816г - триады Немецкий химик разделил элементы по три на основе их общих свойств, но
- 9. Джон Ньюлендс 1863г. закон октав Классифицировал 56 элементов по 8 группам на основе их физических свойств.
- 10. Александр Шанкуртуа 1862г. - спираль Расположил известные на то время элементы в порядке увеличения их атомных
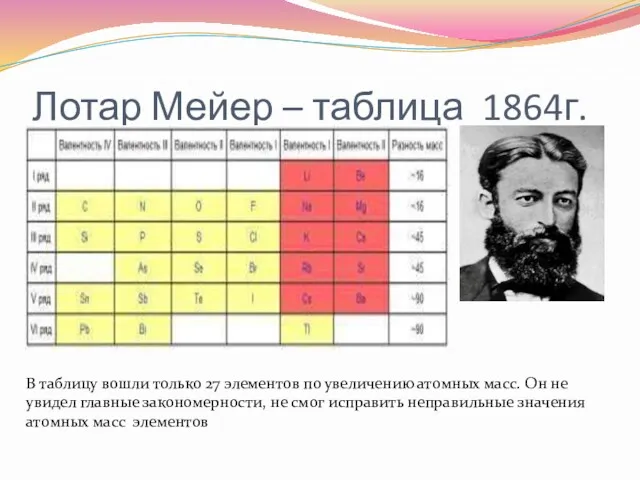
- 11. Лотар Мейер – таблица 1864г. В таблицу вошли только 27 элементов по увеличению атомных масс. Он
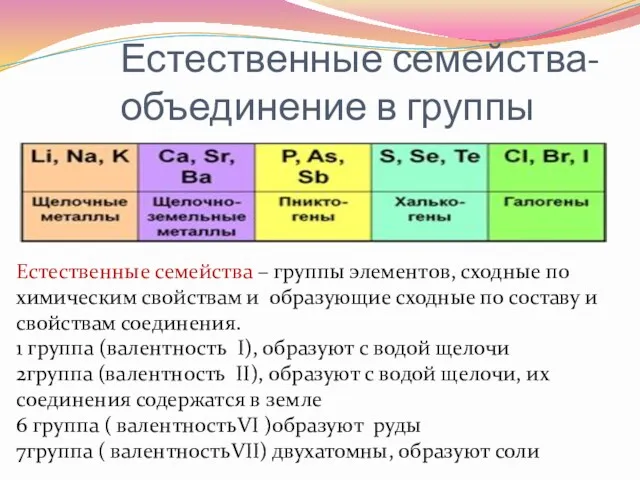
- 12. Естественные семейства- объединение в группы Естественные семейства – группы элементов, сходные по химическим свойствам и образующие
- 13. Выводы: Сходные свойства не помогли найти единую систему классификации химических элементов, т.к. предшественники брали только в
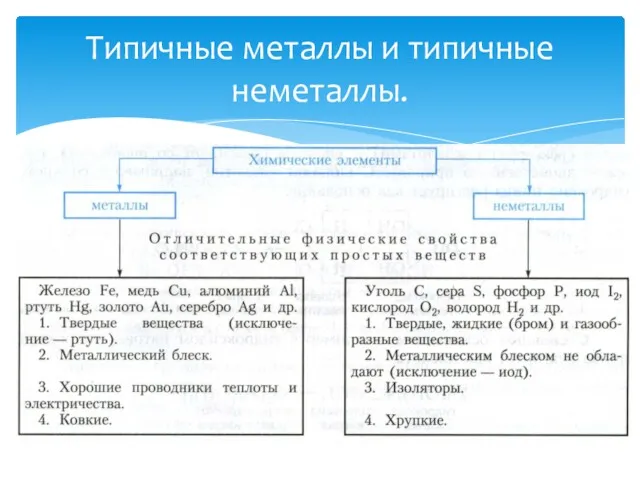
- 14. Типичные металлы и типичные неметаллы.
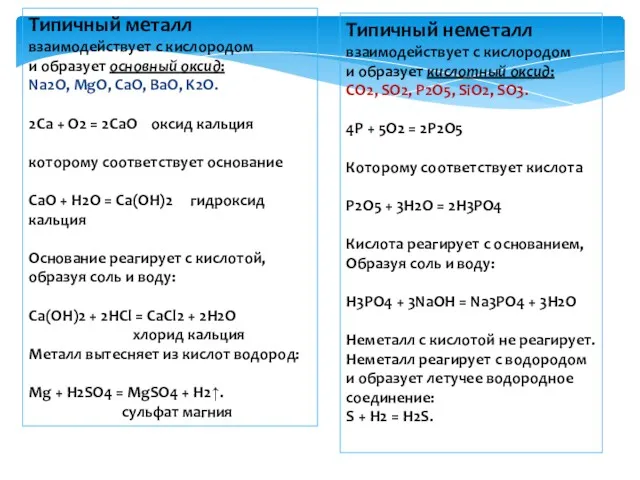
- 15. Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca +
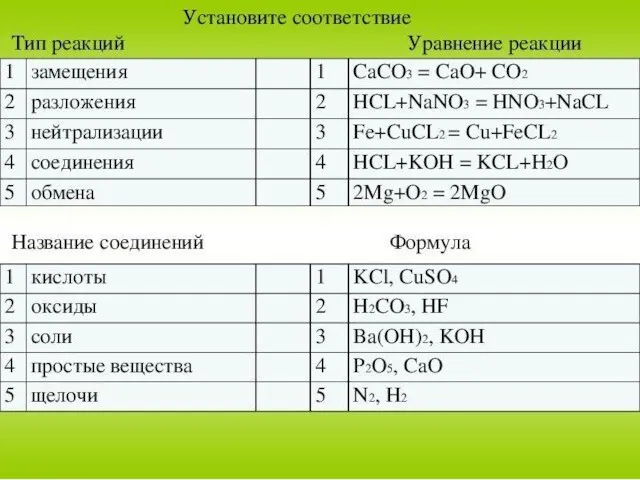
- 16. Найди соответствие, для этого выбери каждому номеру букву верного утверждения: 1.Ртуть А. Твердое вещество 2.сера Б.
- 17. Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые
- 18. Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид
- 19. Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH
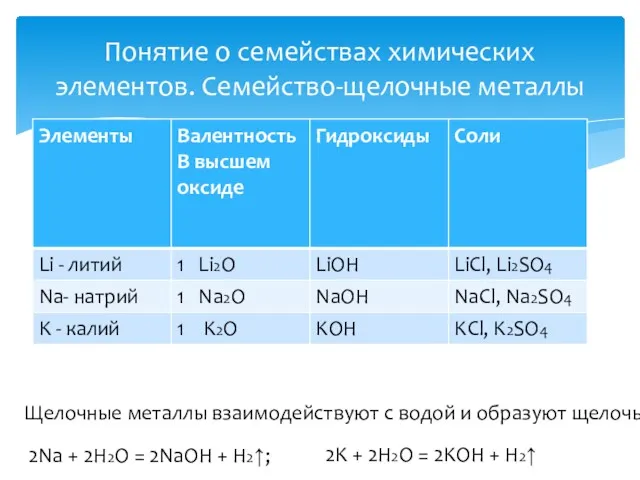
- 20. Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na
- 21. Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и
- 22. С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si,
- 23. Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых
- 24. ДОМАШНЕЕ ЗАДАНИЕ
- 29. Скачать презентацию



















 Химическая организация клетки
Химическая организация клетки Гідроліз солей
Гідроліз солей Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Классификация химических элементов в географической оболочке
Классификация химических элементов в географической оболочке Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний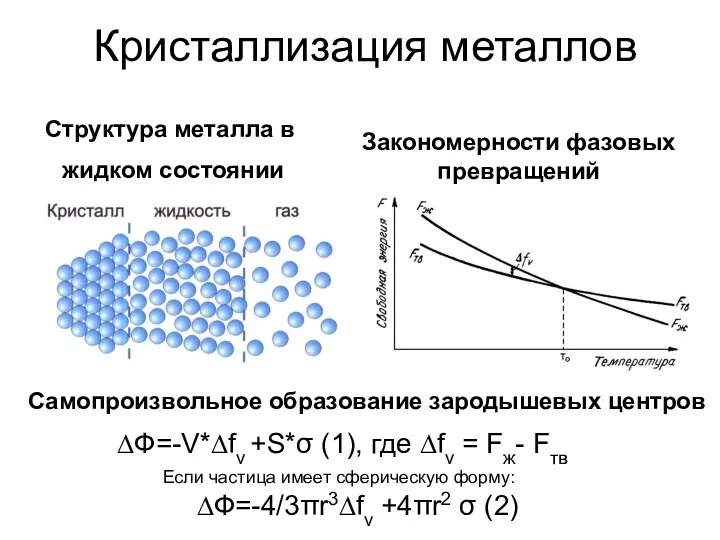 Закономерности фазовых превращений
Закономерности фазовых превращений Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Циклоалканы
Циклоалканы Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Коллоидная химия. Введение
Коллоидная химия. Введение Фосфор и его соединения
Фосфор и его соединения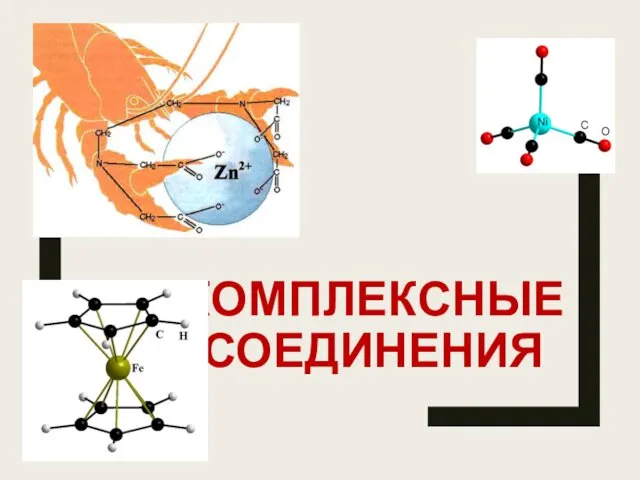 Комплексные соединения
Комплексные соединения Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Неметаллы. Элементы V группы
Неметаллы. Элементы V группы Білки (протеїни)
Білки (протеїни) Минералы и формы существования марганца
Минералы и формы существования марганца Композиционные материалы: углепластик, стеклопластик
Композиционные материалы: углепластик, стеклопластик Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическая промышленность России
Химическая промышленность России Азот и фосфор
Азот и фосфор Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Поверхностные явления
Поверхностные явления Химиялық ыдыстарды тазалау
Химиялық ыдыстарды тазалау Эмпирические законы кристаллографии
Эмпирические законы кристаллографии Парфюмерно-косметическая продукция
Парфюмерно-косметическая продукция