Содержание
- 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ представляет собой классификацию химических элементов в соответствии с периодическим законом, устанавливающим периодическое изменение
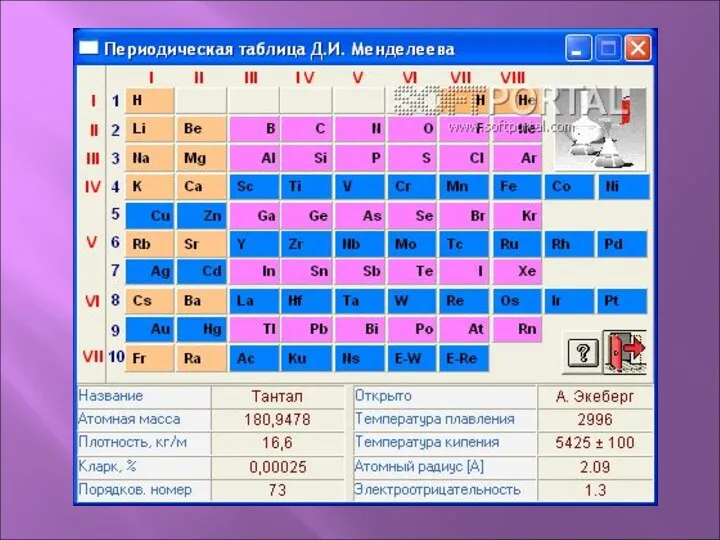
- 4. Na 11 22,9898 3s 1 Натрий Порядковый номер Название элемента Относительная атомная масса Электронная конфигурация внешнего
- 5. Периодическая система элементов оформляется в виде таблицы (периодическая таблица элементов), в горизонтальных рядах которой – периодах
- 6. КЛАССИФИКАЦИИ ПО «АТОМНОМУ ВЕСУ» ( ПО ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССЕ)
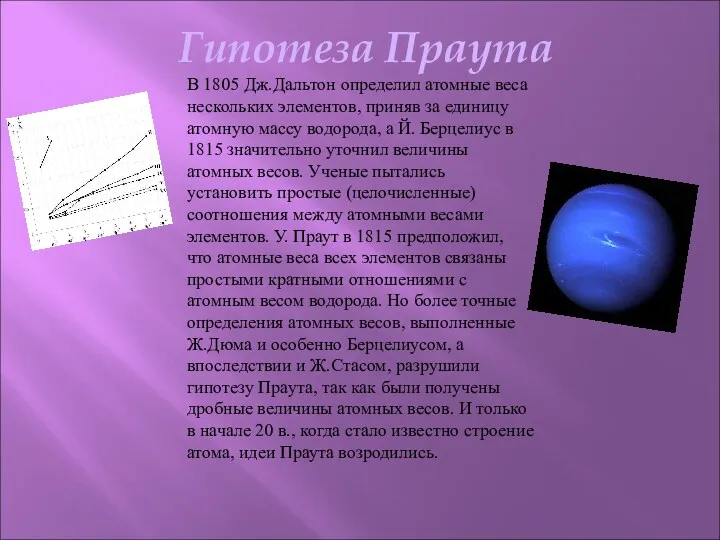
- 7. Гипотеза Праута В 1805 Дж.Дальтон определил атомные веса нескольких элементов, приняв за единицу атомную массу водорода,
- 8. Гипотеза Триады Доберейнера И.Доберейнер в 1816–1829 установил, что для триад сходных элементов, таких, как Cl, Br,
- 9. Гипотеза октавы Ньюлендса Дж.Ньюлендс в 1864, анализируя все известные триады и расширяя по возможности их в
- 10. Периодический закон Два других химика, русский ученый Д.И.Менделеев и немецкий ученый Л.Мейер независимо друг от друга
- 11. Менделеев расположил элементы в порядке увеличения их атомного веса и в 1869 предложил таблицу размещения свойств
- 12. Д.И. Менделеев отметил в таблице периоды, в которых свойства элементов и образованных ими веществ изменялись сходным
- 13. 4)Валентность элементов в гидридах (твердых солеподобных соединениях металлов с водородом) увеличивалась с I до III, а
- 14. В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются, так как:
- 15. А) увеличиваются заряды атомных ядер элементов; Б) увеличивается число электронов на внешнем энергетическом уровне атомов; В)
- 16. В пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают,
- 17. А) увеличиваются заряды атомных ядер элементов; Б) число электронов на внешнем энергетическом уровне не изменяется; В)увеличивается
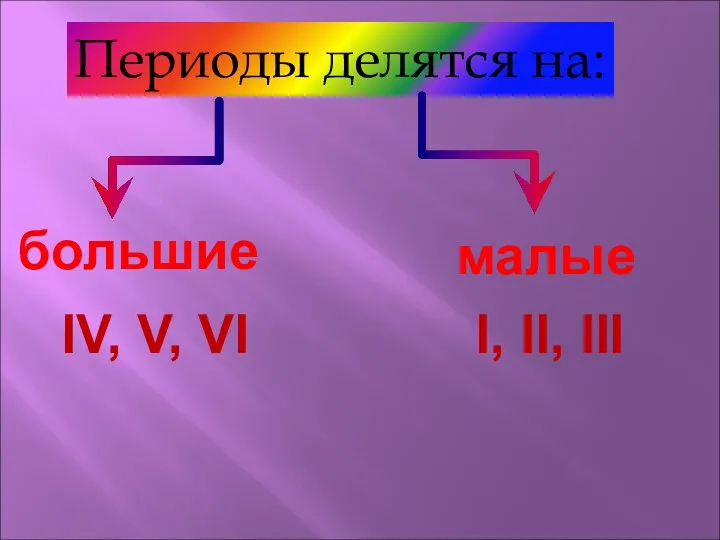
- 18. Периоды делятся на: большие малые IV, V, VI I, II, III
- 19. Д. И. Менделеев (1834-1907гг.)
- 20. Великий русский ученый, один из основоположников современной химии. Создатель естественной классификации химических элементов — Периодической системы
- 22. Скачать презентацию
















 Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика
Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика Prezentatsia
Prezentatsia Кристаллические решетки
Кристаллические решетки Вуглеводи
Вуглеводи Сущность хроматографии. Лекция 2-3
Сущность хроматографии. Лекция 2-3 Алкины
Алкины Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Строение атома и периодический закон
Строение атома и периодический закон Качественные реакции на анионы
Качественные реакции на анионы Введение в геохимию
Введение в геохимию Углерод и его свойства
Углерод и его свойства Актуальные направления развития каталитической химии
Актуальные направления развития каталитической химии Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Азотная кислота и её свойства
Азотная кислота и её свойства Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Центрифугирование
Центрифугирование Химия и здоровье человека
Химия и здоровье человека Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Композиты и композиционные материалы
Композиты и композиционные материалы Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Химия p-элементов
Химия p-элементов Основные классы неорганических соединений
Основные классы неорганических соединений Двойной электрический слой, его строение. Электродный потенциал
Двойной электрический слой, его строение. Электродный потенциал Подготовка к ОГЭ по химии
Подготовка к ОГЭ по химии Непредельные углеводороды
Непредельные углеводороды Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар
Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар