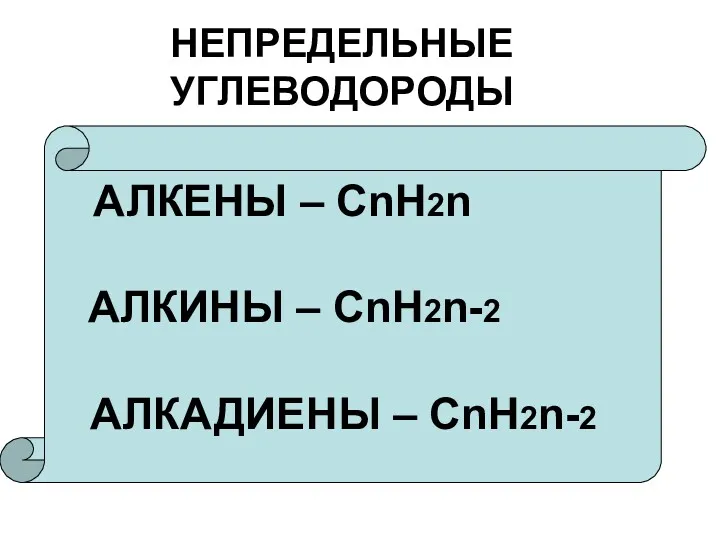
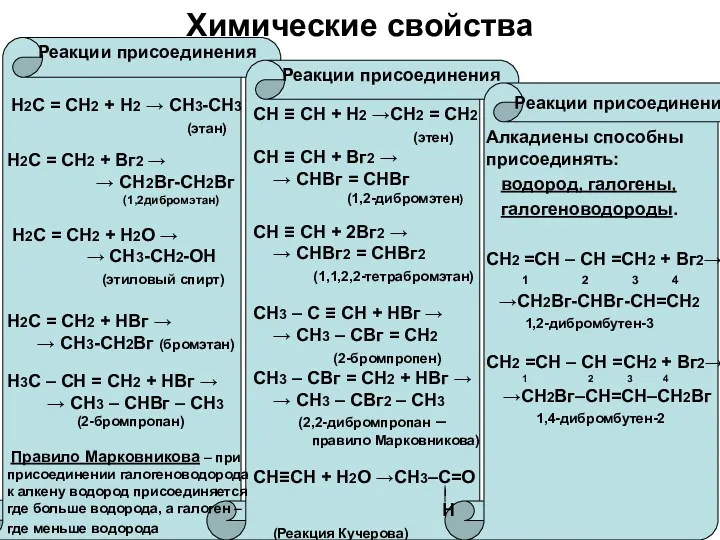
Химические свойства
Реакции присоединения
Реакции присоединения
Реакции присоединения
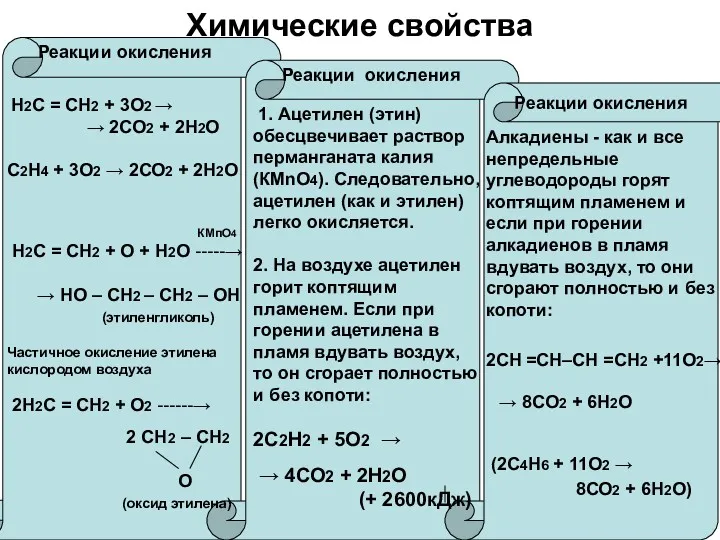
Н2С = СН2 + Н2 →
СН3-СН3
(этан)
Н2С = СН2 + Вг2 →
→ СН2Вг-СН2Вг
(1,2дибромэтан)
Н2С = СН2 + Н2О →
→ СН3-СН2-ОН
(этиловый спирт)
Н2С = СН2 + НВг →
→ СН3-СН2Вг (бромэтан)
Н3С – СН = СН2 + НВг →
→ СН3 – СНВг – СН3
(2-бромпропан)
Правило Марковникова – при присоединении галогеноводорода к алкену водород присоединяется где больше водорода, а галоген – где меньше водорода
СН ≡ СН + Н2 →СН2 = СН2
(этен)
СН ≡ СН + Вг2 →
→ СНВг = СНВг
(1,2-дибромэтен)
СН ≡ СН + 2Вг2 →
→ СНВг2 = СНВг2
(1,1,2,2-тетрабромэтан)
СН3 – С ≡ СН + НВг →
→ СН3 – СВг = СН2
(2-бромпропен)
СН3 – СВг = СН2 + НВг →
→ СН3 – СВг2 – СН3
(2,2-дибромпропан –
правило Марковникова)
СН≡СН + Н2О →СН3–С=О
Ι
Н
(Реакция Кучерова)
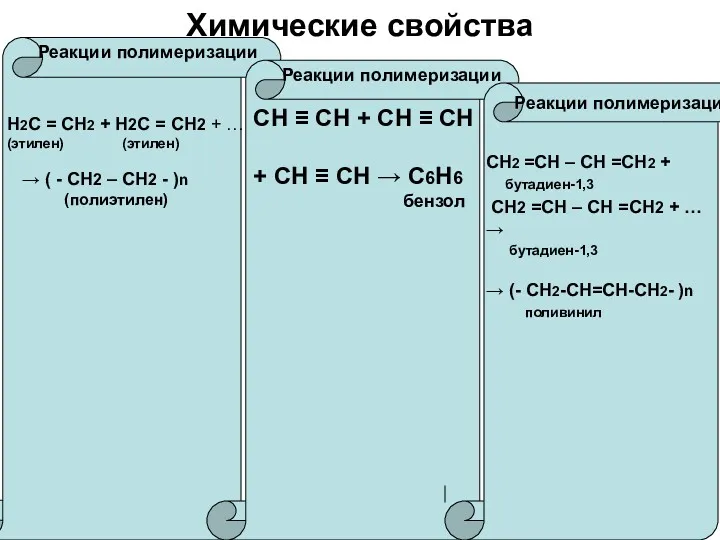
Алкадиены способны присоединять:
водород, галогены,
галогеноводороды.
СН2 =СН – СН =СН2 + Вг2→
1 2 3 4
→СН2Вг-СНВг-СН=СН2
1,2-дибромбутен-3
СН2 =СН – СН =СН2 + Вг2→
1 2 3 4
→СН2Вг–СН=СН–СН2Вг
1,4-дибромбутен-2

 Цинк и его соединения
Цинк и его соединения Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Молекулы и атомы
Молекулы и атомы Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Чистые вещества и смеси
Чистые вещества и смеси Розчини
Розчини Изомеры и гомологи
Изомеры и гомологи Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Шкала не Мооса
Шкала не Мооса Сложные эфиры
Сложные эфиры Количество вещества. Молярная масса и молярный объем
Количество вещества. Молярная масса и молярный объем Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Классификация химических элементов
Классификация химических элементов Неоднородные смеси
Неоднородные смеси Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Ізомери в природі
Ізомери в природі Алкины
Алкины Молибден. Нахождение в природе
Молибден. Нахождение в природе Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Физические и химические явления. Признаки химических реакций
Физические и химические явления. Признаки химических реакций Водород. Положение в периодической системе
Водород. Положение в периодической системе Коррозия металлов
Коррозия металлов Простые и сложные полиэфиры. Пентапласт
Простые и сложные полиэфиры. Пентапласт Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие