Содержание
- 2. Понятие об алкинах Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
- 3. Характеристика тройной связи Вид гибридизации – sp Валентный угол – 180 Длина связи С = С
- 4. Схема образования sp -гибридных орбиталей
- 5. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
- 6. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
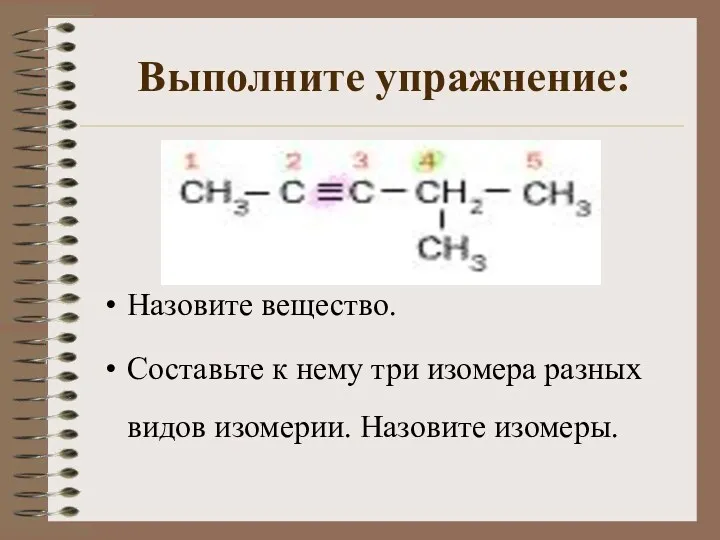
- 7. Выполните упражнение: Назовите вещество. Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 8. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
- 9. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
- 10. Химические свойства алкинов Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 11. Реакции присоединения 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды CH ≡
- 12. 2. Гидрогалогенирование. (По правилу Марковникова) 3. Гидрирование. 4. Гидратация.( реакция Кучерова) HgSO4 Н−C≡C−H + H2O ⎯→
- 13. Окисление Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 14. Горение ацетилена При сгорании (полном окислении) ацетилена выделяется большое количества тепла: 2HC≡CH + 5О2 ⎯→ 4СО2
- 15. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 16. Реакция полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
- 18. Скачать презентацию














 Графен. Свойства и получение. Функционализация и применение композитов на его основе
Графен. Свойства и получение. Функционализация и применение композитов на его основе Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Types of chemical reactions
Types of chemical reactions Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций
Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт) Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Проведення електрофоретичного розділення ДНК в агарозному гелі
Проведення електрофоретичного розділення ДНК в агарозному гелі Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Газовые смеси
Газовые смеси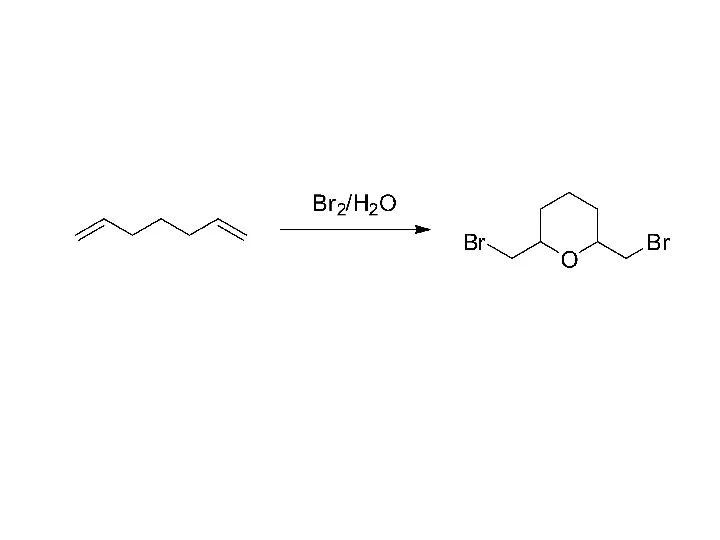 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Способы разделения смесей, применяемые в быту
Способы разделения смесей, применяемые в быту Щавелевая кислота
Щавелевая кислота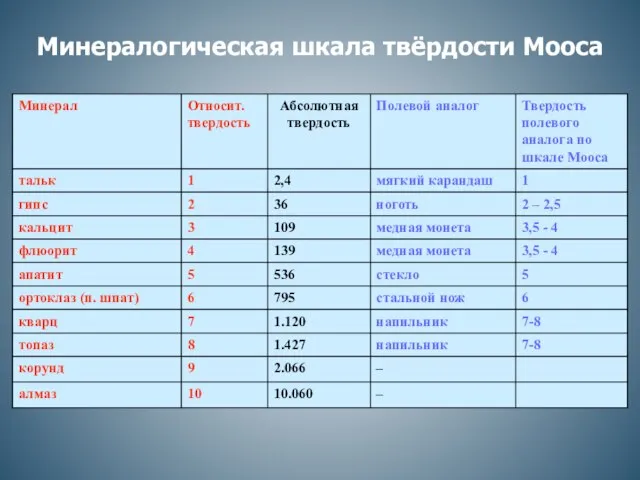 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Распределение элементов на Земле и в космосе
Распределение элементов на Земле и в космосе Волшебница - вода
Волшебница - вода Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Химические реакции. Реакции обмена
Химические реакции. Реакции обмена Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов
Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов Жидкокристаллические индикаторы
Жидкокристаллические индикаторы Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов