Содержание
- 2. Аминокислоты Производные карбоновых кислот, содержащие в своем составе одну или несколько аминогрупп. N H2 – C
- 3. Аминокислоты Природные Их около 150, они были обнаружены в живых организмах, около 20 из них входят
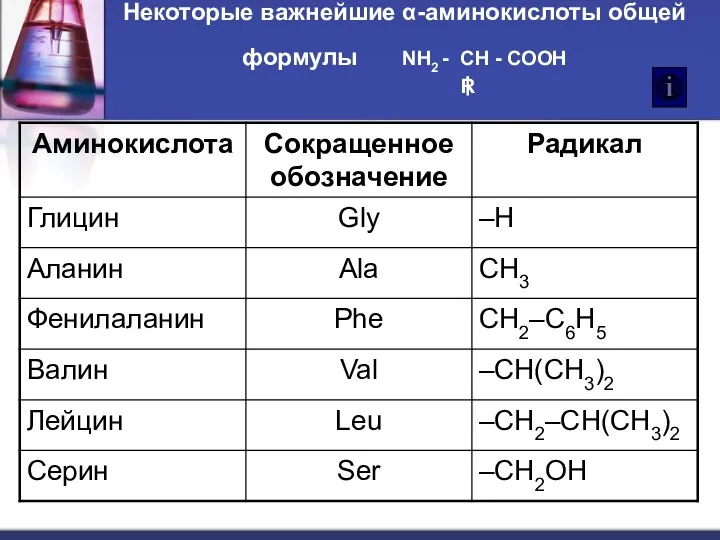
- 4. Некоторые важнейшие α-аминокислоты общей формулы NH2 - CH - COOH R
- 5. Номенклатура По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием
- 6. Номенклатура Часто используется другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется
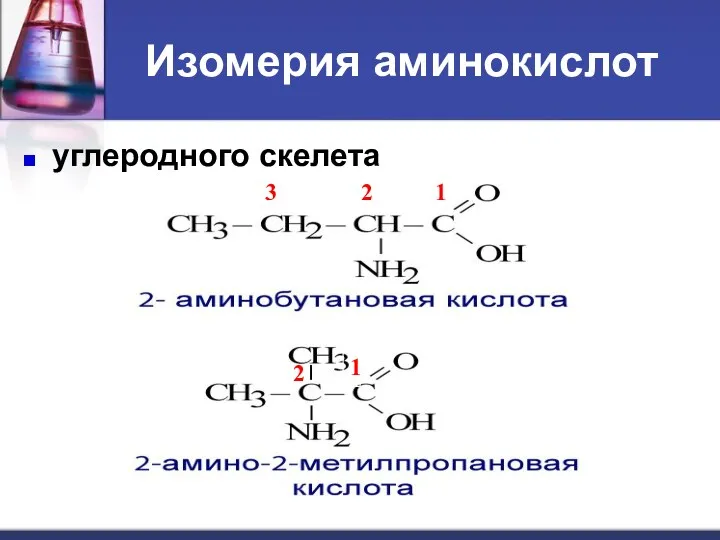
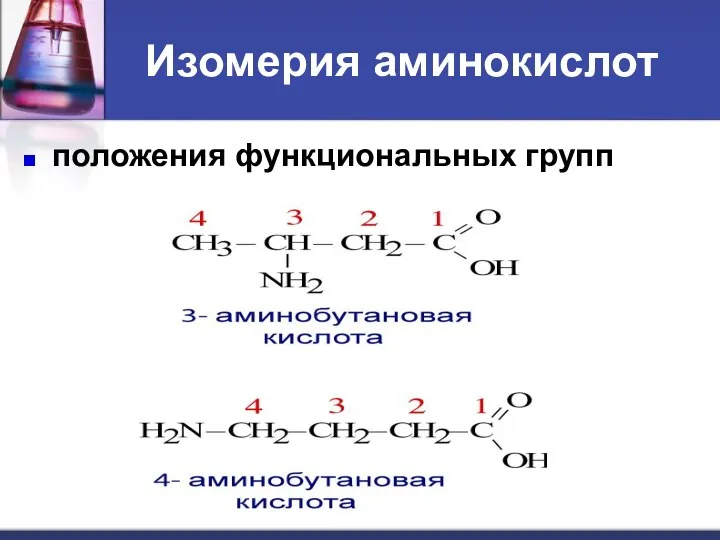
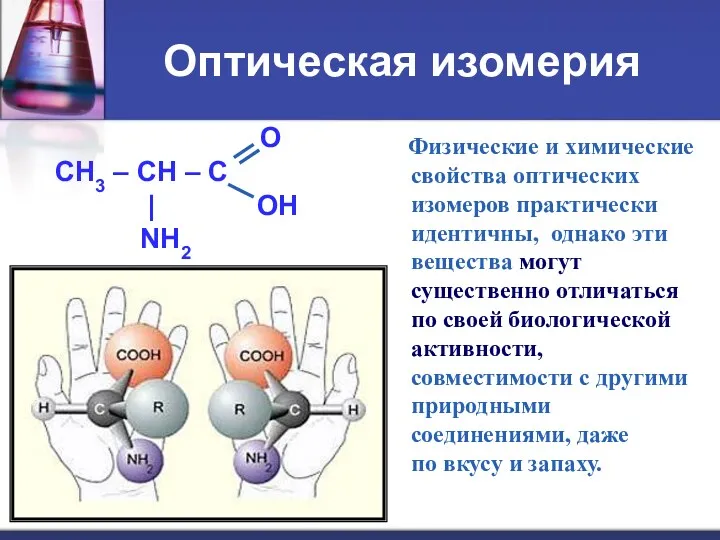
- 7. Изомерия аминокислот углеродного скелета ; положения функциональных групп ; межклассовая (нитросоединения); оптическая.
- 8. Изомерия аминокислот углеродного скелета 1 2 3 1 2
- 9. Изомерия аминокислот положения функциональных групп
- 10. Оптическая изомерия O CH3 – CH – C | OH NH2 Физические и химические свойства оптических
- 11. Физические свойства Аминокислоты бесцветные; кристаллические; хорошо растворимы в воде, но нерастворимы в эфире; в зависимости от
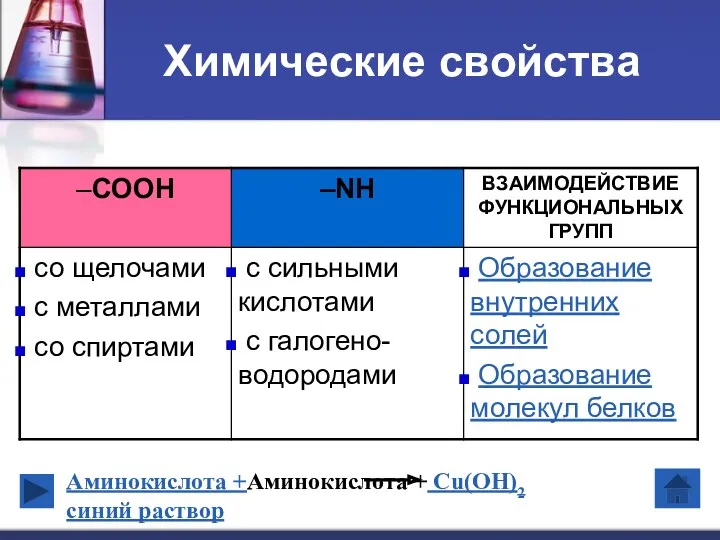
- 12. Химические свойства Наличие амино- и карбоксильной групп определяет двойственность химических свойств аминокислот. Амфотерность (от греч. amphуteros
- 13. Химические свойства Аминокислота +Аминокислота + Cu(OH)2 синий раствор
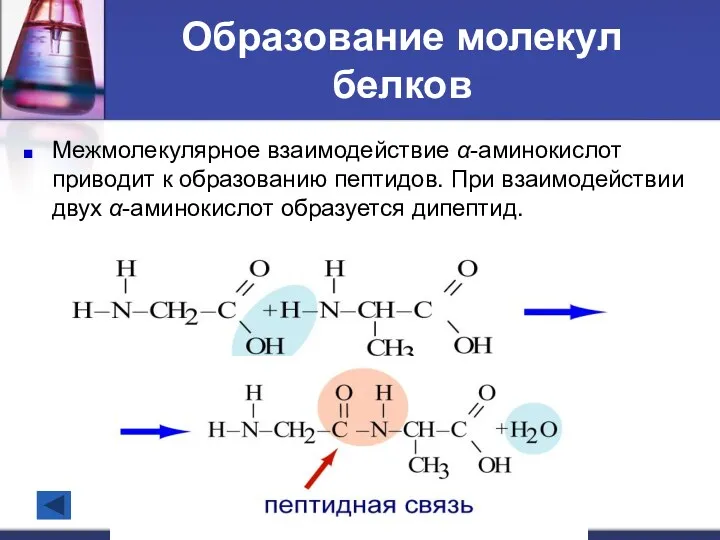
- 14. Образование молекул белков Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид.
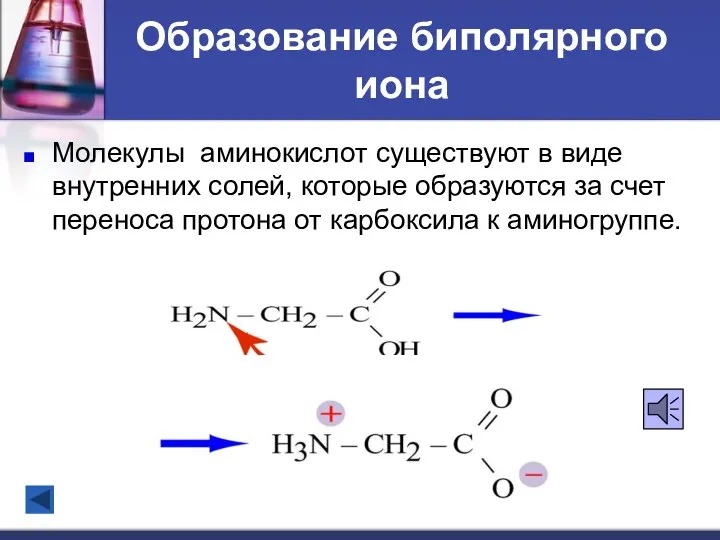
- 15. Образование биполярного иона Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона
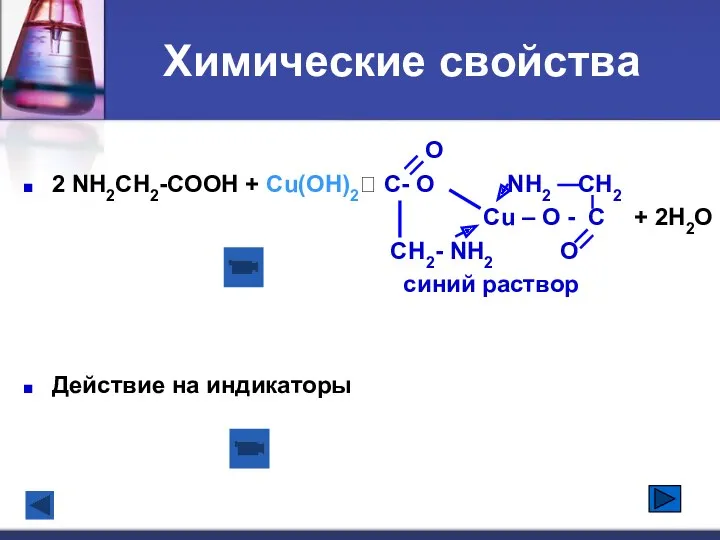
- 16. Химические свойства O 2 NH2CH2-COOH + Cu(OH)2? C- O NH2 CH2 Cu – O - C
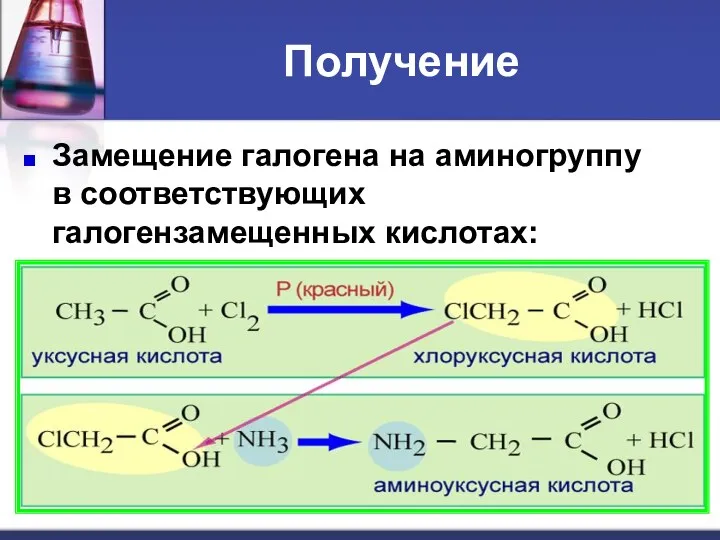
- 17. Получение Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- 18. Получение аминокислот Присоединение аммиака к α, β-непредельным кислотам с образованием β-аминокислот: CH2=CH–COOH + NH3 H2N–CH2–CH2–COOH Гидролиз
- 20. Скачать презентацию








 Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений
Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895 S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Хімічний лабіринт
Хімічний лабіринт Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Поделочные камни
Поделочные камни Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Кислород. 8 класс
Кислород. 8 класс Чисті речовини і суміші
Чисті речовини і суміші Электролиз
Электролиз Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24) Химические свойства металлов
Химические свойства металлов Гидролиз солей
Гидролиз солей Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Каменный уголь
Каменный уголь Электродные системы
Электродные системы Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования