Содержание
- 2. План лекции Основные принципы электрофореза Электрофорез в ПААГ в присутствии додецилсульфата натрия разделение по величине молекулярных
- 3. Что разделяется? клетки коллоидные частицы нуклеиновые кислоты белки пептиды аминокислоты органические кислоты и основания лекарственные препараты
- 4. Зачем разделяется? качественный анализ контроль чистоты количественный анализ препаративное разделение и очистка
- 5. Электрофорез Электрофорез (от электро- и греч. φορέω — переносить) — электрокинетическое явление перемещения частиц дисперсной фазы
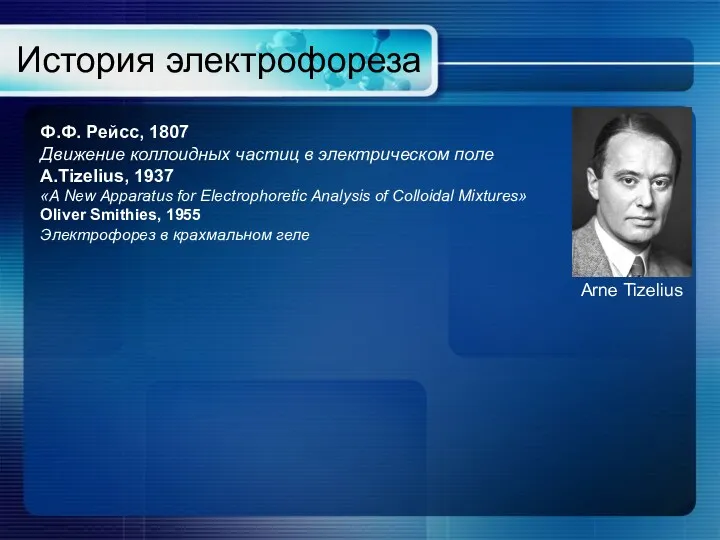
- 6. История электрофореза Arne Tizelius Ф.Ф. Рейсс, 1807 Движение коллоидных частиц в электрическом поле A.Tizelius, 1937 «A
- 7. Теория электрофореза Двойной электрический слой (ДЭС) Строение ДЭС: Слой Гельмгольца (адсорбционный) Слой Гуи (диффузный) Характеристические потенциалы
- 8. Виды электрофореза Зональный электрофорез гомогенная буферная система Изотахофорез Негомогенная буферная система Изоэлектрическое фокусирование Градиентная буферная система
- 9. SDS-PAGE Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии
- 10. Гели для электрофореза (ПААГ) Исходные материалы Акриламид N,N’-метиленбисакриламид Персульфат аммония Тетраметилэтилендиамин Инициатор процесса полимеризации Катализатор процесса
- 11. Изотахофорез Основные термины Ведущий электролит Замыкающий электролит Анализируемая смесь Электрофоретическая подвижность и разделение ионов
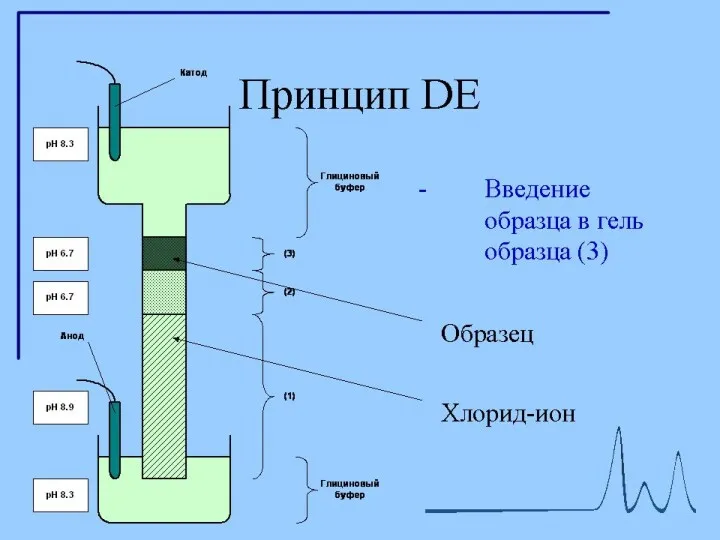
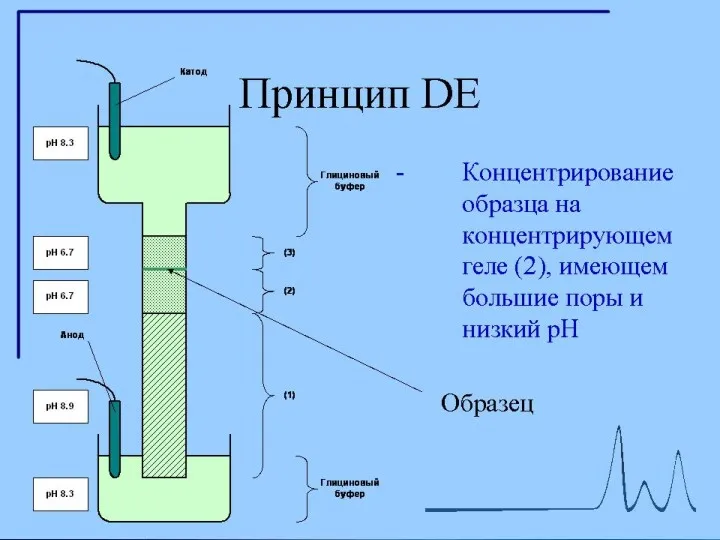
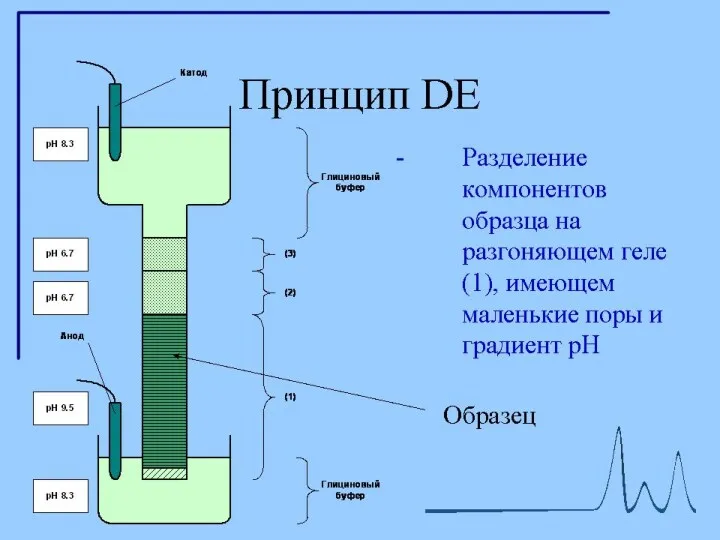
- 12. Диск-электрофорез Гель, состоит из двух частей. Все буферы не содержат неорганических солей, основным переносчиком тока в
- 16. Схема аппарата для диск-электрофореза
- 17. Аппараты для электрофореза
- 18. Аппараты для электрофореза
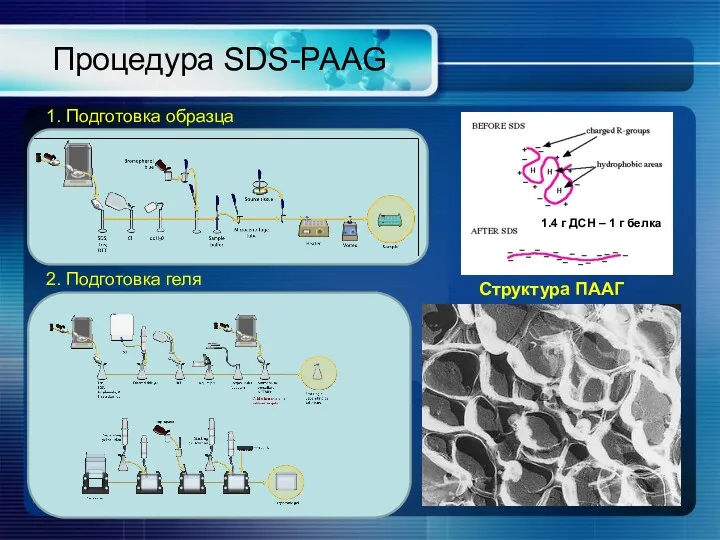
- 19. Процедура SDS-PAAG 1. Подготовка образца 2. Подготовка геля Структура ПААГ 1.4 г ДСН – 1 г
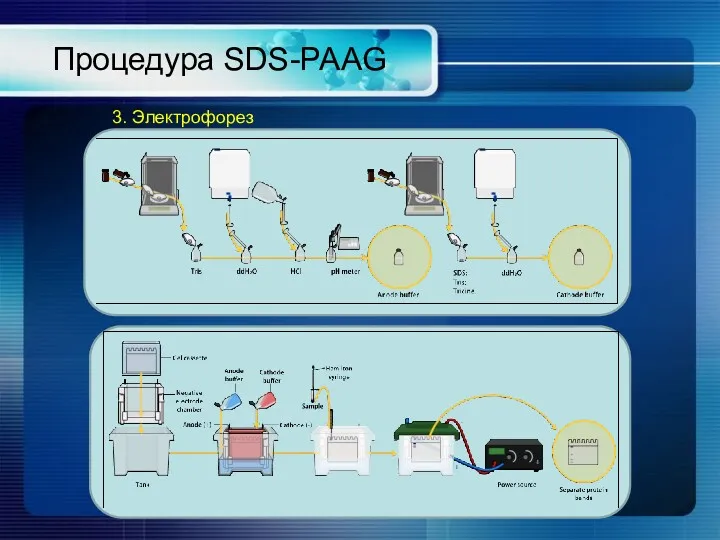
- 20. Процедура SDS-PAAG 3. Электрофорез
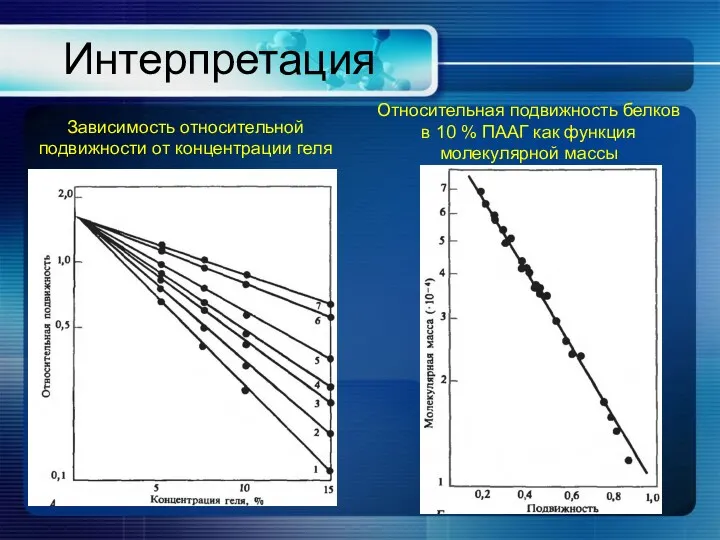
- 21. Интерпретация Зависимость относительной подвижности от концентрации геля Относительная подвижность белков в 10 % ПААГ как функция
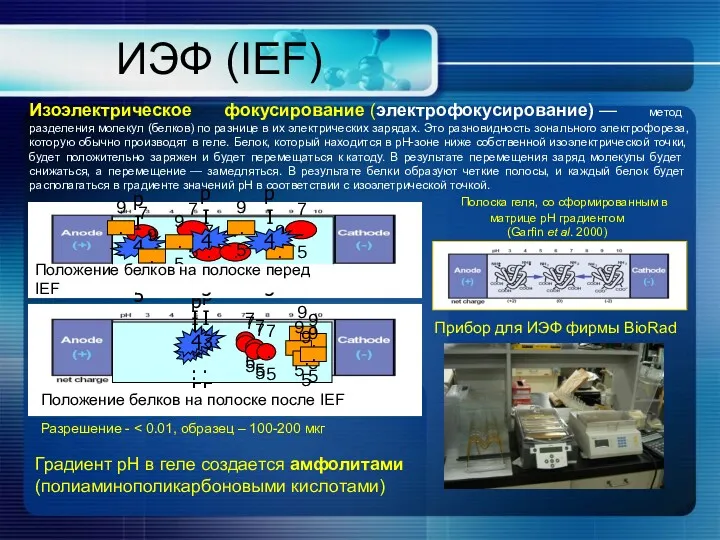
- 22. ИЭФ (IEF) Изоэлектрическое фокусирование (электрофокусирование) — метод разделения молекул (белков) по разнице в их электрических зарядах.
- 23. Двумерный электрофорез 1 измерение – ИЭФ, нативный электрофорез 2 измерение – ДСН электрофорез Автоматическое выделение пятен
- 24. Капиллярный электрофорез (CE или HPCE) >>> минимизация диффузионных эффектов, размывов и турбулизаций потока >>> сверхвысокие разрешения
- 25. Оборудование для КЭ
- 26. Оборудование для КЭ
- 27. Оборудование для КЭ
- 28. Капиллярный электрофорез (CE или HPCE) Назначение: аналитическое разделение микропрепаративное разделение среда разделения кварцевый капилляр длиной 20-30
- 29. Визуализация Окрашивание кумасси (50 нг белка) Окрашивание серебром (1 нг белка) Окрашивание флуоресцентными красителями Иммуноблоттинг
- 30. Окрашивание серебром и красителями 2D-электрофореграмма (окрашивание серебром) 1D-электрофореграмма (SDS-PAGE) (окрашивание серебром) 1D-электрофореграмма (SDS-PAGE) (окрашивание кумасси) 2D-электрофореграмма
- 31. Окраска DIGE Cy3/Cy5 Электрофорез 2-х предварительно окрашенных белков Mycoplasma gallisepticum проводится на одном геле. Зеленым (Cy3)
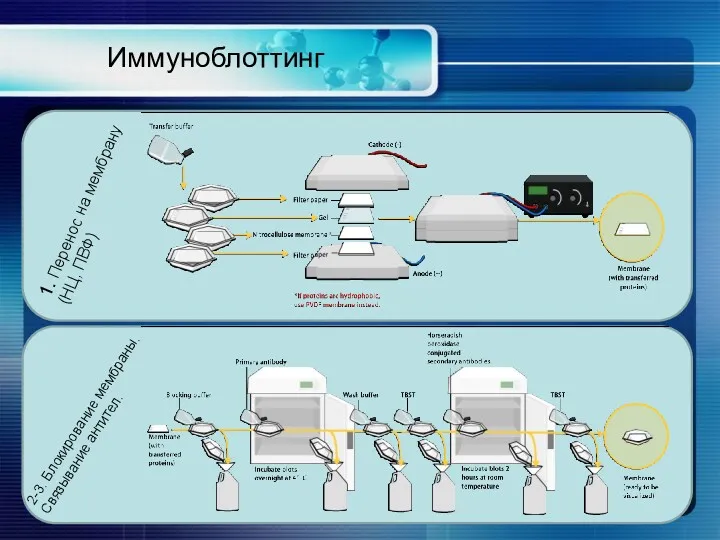
- 32. Иммуноблоттинг Иммуноблоттинг (вестерн-блоттинг) - метод идентификации белковых антигенов. Белки разделяют с помощью электрофореза и переносят на
- 33. Иммуноблоттинг 1. Перенос на мембрану (НЦ, ПВФ) 2-3. Блокирование мембраны. Связывание антител.
- 34. Лаборатория на чипе Современное направление в анализе, позволяющее автоматизировать и реализовать несколько последовательных лабораторных операций на
- 35. Лаборатория на чипе Преимущества LOC: простота использования высокая скорость анализа малое количество образов и реагентов хорошая
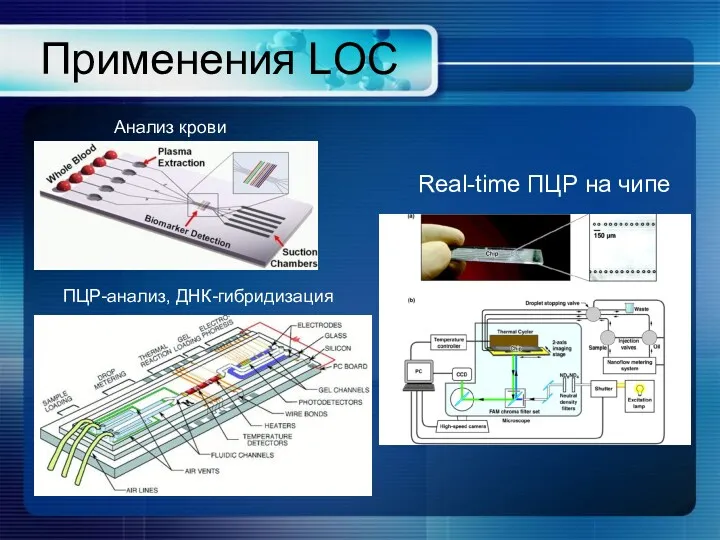
- 36. Применения LOC Анализ крови ПЦР-анализ, ДНК-гибридизация Real-time ПЦР на чипе
- 37. Применение биочипов LOC ДНК-чипы: экспрессия генов, SNP генотипирование, диагностика онкозаболеваний, геномика, сельскохозяйственная биотехнология, разработка лекарств. Lab-on-chip
- 39. Скачать презентацию


























 Общая характеристика неметаллов
Общая характеристика неметаллов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Аморфные сплавы
Аморфные сплавы Электролиз. Классификация
Электролиз. Классификация Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы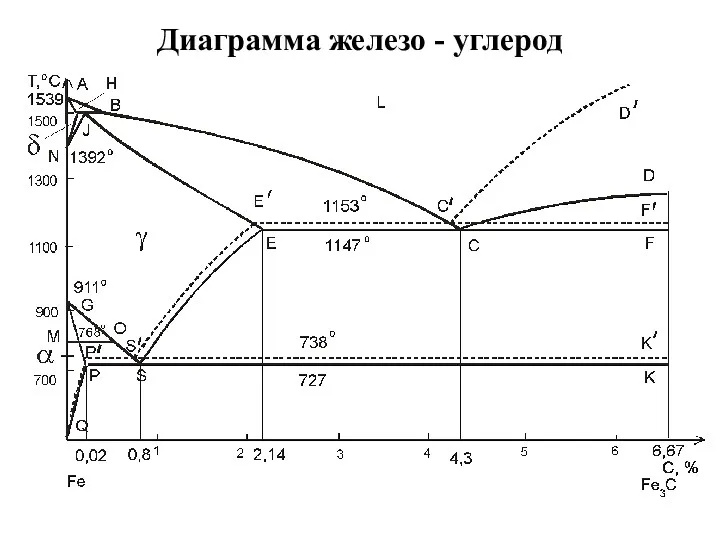 Диаграмма железо - углерод
Диаграмма железо - углерод Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Alkynes
Alkynes Металлическая связь
Металлическая связь Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Комплексные соединения
Комплексные соединения Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів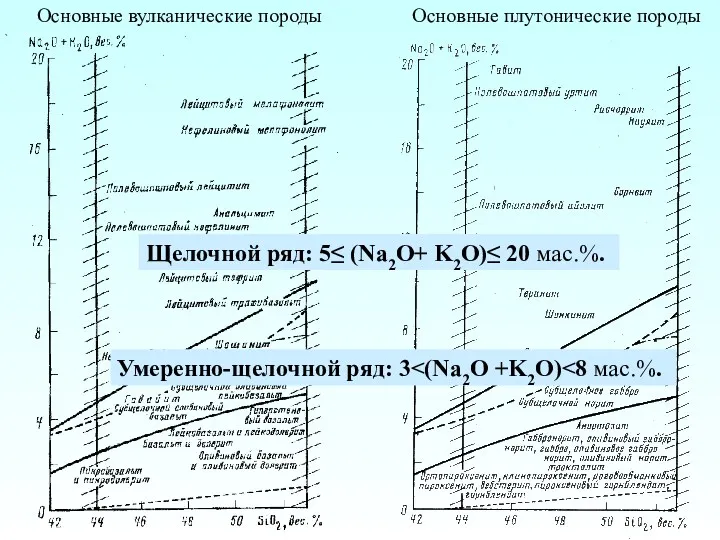 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Технология промышленных газов
Технология промышленных газов Кислотно-основное титрование
Кислотно-основное титрование Химические свойства алкенов
Химические свойства алкенов Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Анілін. Фізичні властивості
Анілін. Фізичні властивості Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества 20230419_oksidy
20230419_oksidy