Содержание
- 2. ЭЛЕКТРОЛИЗ
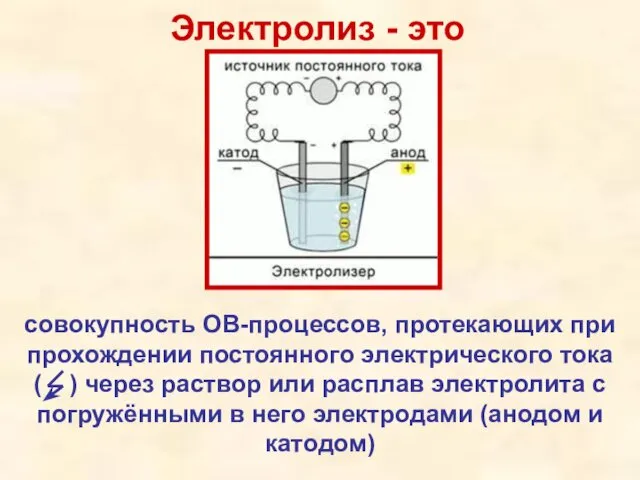
- 3. Электролиз - это совокупность ОВ-процессов, протекающих при прохождении постоянного электрического тока ( ) через раствор или
- 4. к катоду (-) движутся катионы (Kt+) к аноду (+) движутся анионы (An-) Способ обозначение процесса: «электролиз»
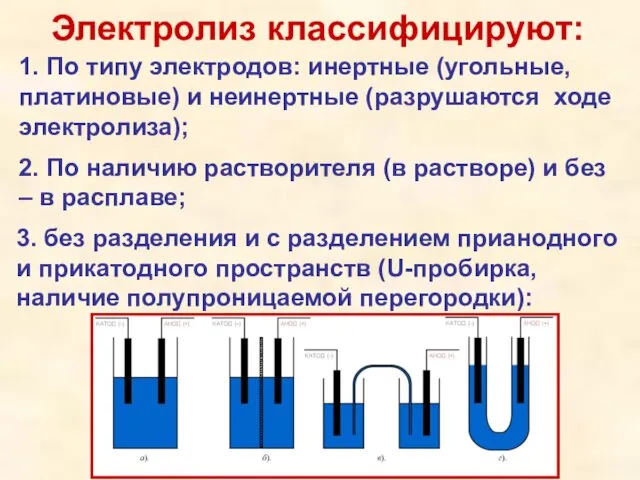
- 5. Электролиз классифицируют: 1. По типу электродов: инертные (угольные, платиновые) и неинертные (разрушаются ходе электролиза); 2. По
- 6. Можно ли оценить двумя противоложными характеристиками одно и тоже понятие?
- 7. Гемфри Дэви (1778-1829) Анри Муассан (1852-1907) Электрический ток – это самый сильный восстановитель! «Кто прав, а
- 8. ЭЛЕКТРОЛИЗ 1. Уравнения электролиза 2. Расчётные задачи по теме электролиз 3. Практическое применение
- 9. Уравнения электролиза уравниваются на основании МЕТОДА ПОЛУРЕАКЦИЙ - метод, в котором электронные ОВР процессы показаны на
- 10. 1. Электролиз расплавов: Рассматривают, как правило, для щелочей и галогенидов щелочных металлов. MeHal расплав MeHal диссоциация
- 11. ПРИМЕР 1. Напишите электролиз расплава едкого натра:
- 12. NaOH → … 1. Диссоциация электролита: NaOH → Na+ + OH– 2. В «Методе полуреакций» выписываем
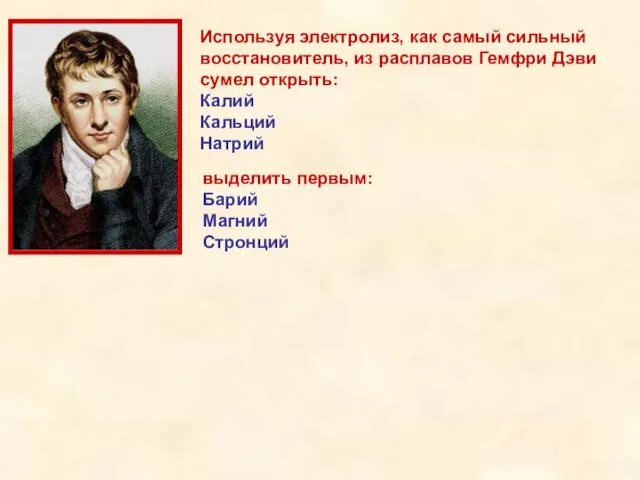
- 13. Используя электролиз, как самый сильный восстановитель, из расплавов Гемфри Дэви сумел открыть: Калий Кальций Натрий выделить
- 14. Используя электролиз, как самый сильный окислитель, из безводной плавиковой кислоты (в присутствии гидрофторида калия) Анри Муассан
- 15. 2. Электролиз водных растворов: Здесь следует учитывать влияние растворителя на «разрядку» катионов и анионов...
- 16. «Правило разрядки катионов» Катион водорода: 2H+ + 2ē = H2↑
- 17. 2. Катионы активных Ме от Li до Al не восстанавливаются в водных растворов, вместо них протекает
- 18. 3. С катионами малоактивных Ме от Mn до Pb протекает сразу два процесса, которые можно связать
- 19. 4. С катионами неактивных Ме от Cu … происходит восстановление до металла: Me+n + nē =
- 20. «Правило разрядки анионов» Гидроксид-ион OH– : 4OH– = O2↑ + H2O – 4ē
- 21. 2. Бескислородные анионы (кроме F-) I-, Br-, Cl-, S2- окисляются до простых веществ: Ann- - nē
- 22. 3. Кислородсодержащие анионы и как искл. F- не окисляются в водных растворах, вместо этого протекает процесс:
- 23. ПРИМЕР 2. Напишите уравнение электролиза для водного раствора хлорида натрия. Какие продукты образуются в прикатодном пространстве?
- 24. NaCl + H2O → … 1. Диссоциация электролита: NaCl → Na+ + Cl– 2. В «Методе
- 25. ПРИМЕР 3. Напишите уравнение электролиза для водного раствора сульфата цинка. Какие продукты образуются в прианодном пространстве?
- 26. ZnSO4 + H2O → … 1. Диссоциация электролита: 2. В «Методе полуреакций» выписываем катодный и анодный
- 27. Задание. Используя метод полуреакций напишите электролиз водных растворов NaF, AgNO3, K3PO4
- 28. ЭЛЕКТРОЛИЗ II часть
- 29. Решение задач по теме «ЭЛЕКТРОЛИЗ»
- 30. Качественные реакции и реакции продуктов электролиза Электролиз иодида калия 2KI + 2H2O = 2KOH + H2↑
- 31. Применение закона электролиза Фарадея I ·Δτ 96500 · nē νв-ва = I – (А) сила тока;
- 32. Пример: Сколько времени потребуется пропускать ток силой 5 А, чтобы получить 1,5 л гремучего газа (20оС,
- 33. Решение: Дано: T=20 +273 = 293k P=98,64 кПа V(2H2+O2)=1,5 л I = 5А Найти: Δτ -
- 34. 3. Подставим известные данные в ф-лу электролиза: nē = 4 2O2- - 4ē = O2 (в
- 35. Задачи: 1. Рассчитайте силу тока, которая используется для выделения 22,4 г металлической меди из раствора медного
- 36. Задачи без применения закона: 3. Определите концентрацию щёлочи после полного электролиза 1170 г 20%-ного раствора хлорида
- 37. ПРИМЕНЕНИЕ
- 38. 1. Электролизом расплавов - получение активных металлов, н-р, алюминия из Al2O3 с добавкой криолита Na3[AlF6]), щ,
- 39. 2. Перевод в раствор неинертных электродов (активных электродов) из загрязнённых металлов или смеси с последующим восстановлением
- 40. [Опыт демонстрирующий разрушение активных электродов] При электролизе NaCl на инертных (угольных т.е. С) электродах образовывались бы:
- 41. [Опыт демонстрирующий разрушение активных электродов] А если электроды «активные» (например, из металлов), то продукты электролиза взаимодействуют
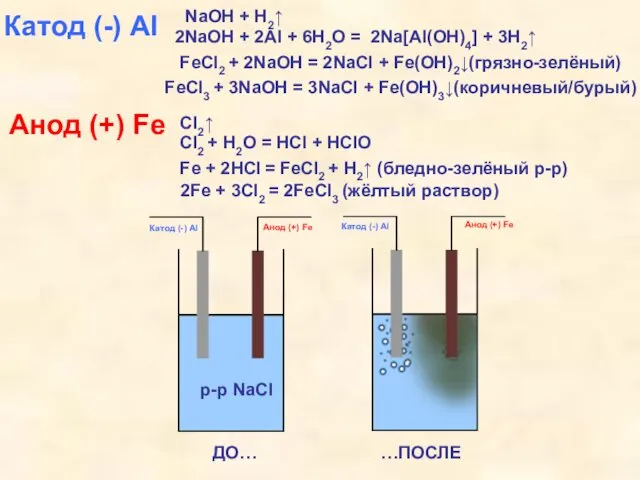
- 42. Катод (-) Al NaOH + H2↑ Анод (+) Fe Cl2↑ 2NaOH + 2Al + 6H2O =
- 43. 3. Гальваностегия тонкое покрытие токопроводящей поверхности изделия (например, из другого металла) с целью защиты (от коррозии)
- 44. 4. Гальванопластика Толстые покрытия, сохраняющие точные формы и детали мелких предметов, создание копий.
- 57. 4. Электрополировка и другие.
- 58. [ВИДЕО] Электролиз СССР (11:15 – до конца)
- 59. ОБМАН
- 60. «Кто не знает про электролиз – тот платит»
- 61. 3. «Detox» («детоксы») 2. «Живая и мёртвая вода» 1. «Ионизаторы воды» Популярные формы развода Все эти
- 62. …«Электролиз с участием неинертных электродов» - железных (или стальных) (анод железный, катод - инертный или оба
- 63. Коррозия стальных анодов под действием Cl– (они всегда есть в воде, хотя бы потому, что воду
- 64. Продукты гидролиза алюминия – белые, меди – от грязно-голубого до чёрного и т.д. – всё зависит
- 65. Полученные в лаборатории гидроксиды железа (II) и (III). Чистый Fe(OH)2↓ в инертной атмосфере - белый, но
- 66. Эта коррозия металлов тем сильнее заметна, чем больше солей в воде, поэтому шарлатаны в демонстрациях использую
- 67. УЖАСЫ «ОБРАТНОГО ОСМОСА» «фильтрация кошелька» [ВИДЕО – №1]
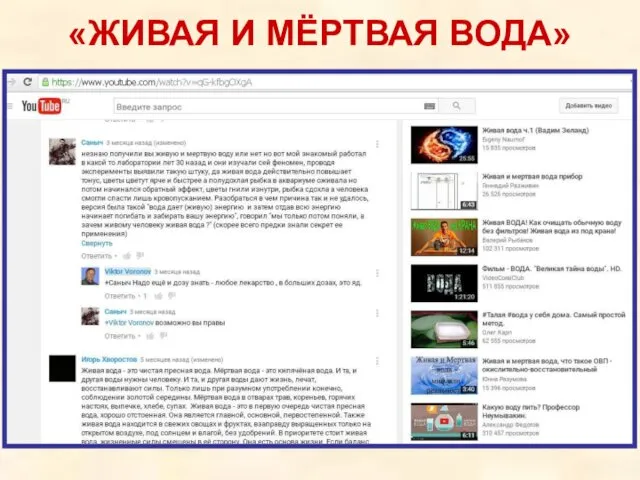
- 68. «ЖИВАЯ И МЁРТВАЯ ВОДА»
- 70. «Живая и мёртвая вода» «Вода не способна накапливать и нести информацию, не бывает ни мёртвой, ни
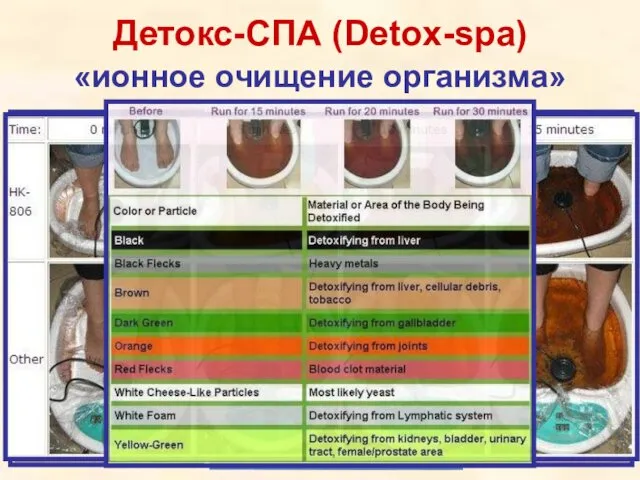
- 71. Детокс-СПА (Detox-spa) «ионное очищение организма»
- 72. Детокс-СПА (Detox-spa) «ионное очищение организма» http://www.altera-med.ru/main/lech/detox_spa
- 73. Детокс-СПА (Detox-spa) «ионное очищение организма»
- 74. Детокс-СПА (Detox-spa) «ионное очищение организма» Как ОНО работает… [ВИДЕО – Реклама – 1:40 – 3:30] [ВИДЕО
- 76. Скачать презентацию



































![[Опыт демонстрирующий разрушение активных электродов] При электролизе NaCl на инертных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108149/slide-39.jpg)
![[Опыт демонстрирующий разрушение активных электродов] А если электроды «активные» (например,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108149/slide-40.jpg)















![[ВИДЕО] Электролиз СССР (11:15 – до конца)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108149/slide-57.jpg)








![УЖАСЫ «ОБРАТНОГО ОСМОСА» «фильтрация кошелька» [ВИДЕО – №1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108149/slide-66.jpg)





 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Органические кислоты и основания. Лекция 6
Органические кислоты и основания. Лекция 6 Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Магнезит
Магнезит Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода Алкины. Ацетилены
Алкины. Ацетилены Дипломная работа. Тема: Получение гальванических покрытий на основе цинка
Дипломная работа. Тема: Получение гальванических покрытий на основе цинка Ионные уравнения реакций
Ионные уравнения реакций Розчини
Розчини Основы теории пространственного строения органических соединений. Конфигурации и конформации. Лекция 1
Основы теории пространственного строения органических соединений. Конфигурации и конформации. Лекция 1 Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Нефть и способы ее переработки (10 класс)
Нефть и способы ее переработки (10 класс) Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Химическая промышленность России
Химическая промышленность России Технология промышленных газов
Технология промышленных газов Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Топливный элемент: проблемы и перспективы
Топливный элемент: проблемы и перспективы Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Hydrophilization and hydrophobization of the surface of solids with the help of SAA
Hydrophilization and hydrophobization of the surface of solids with the help of SAA Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов