Содержание
- 2. Цель урока: сформировать у учащихся знания о реакциях ионного обмена.
- 3. Задачи: - исследовать условия протекания реакций ионного обмена до конца; - продолжить развитие умений проводить эксперимент,
- 4. Методы и методологические приёмы: диалогический метод изложения знаний с элементами исследования, выполнение демонстрационного и лабораторного эксперимента,
- 5. Средства обучения: -инструкция по технике безопасности; - рабочая карта урока; - алгоритм составления уравнений реакций; -
- 6. Подготовка учащихся к уроку. 1. Деление класса на группы по 4 человека. 2. Группа получает оборудование
- 7. Тема. Ф. И. учащегося. Примечание: с/о- самооценка; в/о - взаимооценка; о/г – оценка группы. Рабочая карта
- 8. Структура урока. I. Организационный этап. Постановка цели и мотивация учебно-познавательной деятельности учащихся. II. Актуализация знаний (фронтальная
- 9. ХОД УРОКА. I. Организационный этап. II. Актуализация знаний. На предыдущем уроке мы изучили понятие «электролиты» Вопросы
- 10. Таблица №2. Рабочая карта урока. «5» - все примеры составлены верно, «4» - 1 ошибка, «3»
- 11. III. Изучение нового материала. Тема урока: «Ионные уравнения реакций» Реакции между ионами в растворах электролитов называют
- 12. Алгоритм составления уравнений В молекулярном виде: 1. Записать исходные вещества. 2. Записать продукты, поменяв местами первые
- 13. Правила техники безопасности 1. Проводите опыты лишь с теми веществами, которые указаны учителем. 2. Вещества нельзя
- 14. Образец выполненного задания: вариант1 CuSO4+ 2NaOH=Cu(OH)2+Na2SO4 Cu2++SO42- +2Na++2OH-=Cu(OH)2+2Na++SO42- Cu2++2OH-=Cu(OH)2 Na2CO3+2HNO3=2NaNO3+H2O+CO2 2Na++CO32-+2H++2NO3-=2Na++2NO3-+H2O+CO2 2H++CO32-=H2O+CO2 NaOH + HCI =
- 15. Образец выполненного задания: вариант2 AI2(SO4)3+3BaCI2=3BaSO4+2AICI3 2AI3++3SO42-+3Ba2++6CI-=3BaSO4+2AI3++6CI- 3Ba2++3SO42-=3BaSO4 Na2CO3+2HCI=2NaCI+H2O+CO2 2Na++CO32-+2H++2CI-=2Na++2CI-+H2O+CO2 2H++CO32-=H2O+CO2 2KOH+H2SO4=K2SO4+2H2O 2K++2OH-+2H++SO42-=2K++SO42-+2H2O 2H++2OH-=2H2O ,
- 16. IV. Закрепление знаний (взаимный диктант, тестирование). Карточки взаимного диктанта для работы в парах. Тест в 2
- 17. Задания теста Вариант 1. Выпишите номер правильного ответа. 1. Условия протекания реакции ионного обмена до конца
- 18. Задания теста Вариант 2. Установите правильную последовательность: 1. Ионное уравнение реакции- [1] - формул [4] -
- 19. Выполнение теста и самопроверка по образцу.
- 20. V. Рефлексия (самооценка). Каждый учащийся выставляет себе итоговую оценку за урок в рабочей карте и отвечает
- 22. Скачать презентацию
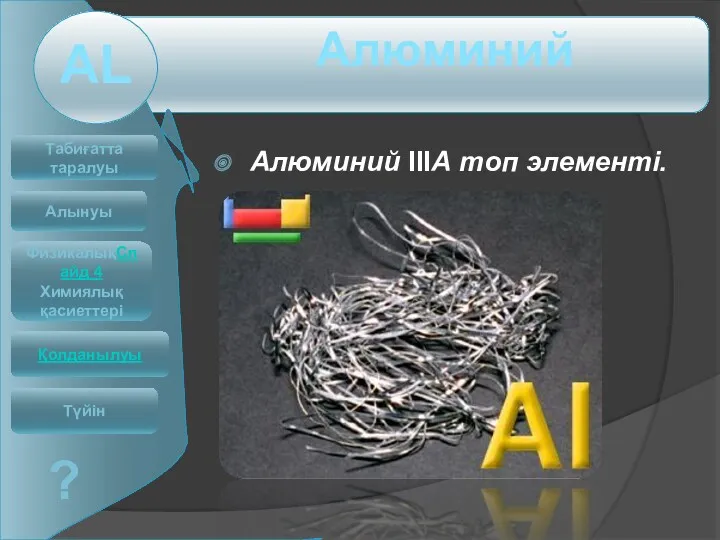 Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Коррозия металлов
Коррозия металлов Відносна молекулярна маса
Відносна молекулярна маса Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер
Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер Поляризация электродов
Поляризация электродов Закономерность изменений в строении электронных оболочек атома
Закономерность изменений в строении электронных оболочек атома Химические элементы. Типы связей
Химические элементы. Типы связей Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI) яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Железо и его сплавы
Железо и его сплавы Научно – исследовательская работа Газированная вода - вред или польза?
Научно – исследовательская работа Газированная вода - вред или польза? Нефть - “Кормилица”. 10 класс
Нефть - “Кормилица”. 10 класс Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Лекция № 7. Конкурентные реакции у насыщенного атома
Лекция № 7. Конкурентные реакции у насыщенного атома Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Механическая смесь и растворы
Механическая смесь и растворы Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения Сравнение нормативов некоторых веществ
Сравнение нормативов некоторых веществ Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани
Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани Органическая химия в ряду других наук
Органическая химия в ряду других наук Қанықпаған майлар және соның негізіндегі БАЗ
Қанықпаған майлар және соның негізіндегі БАЗ Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)