Содержание
- 2. Простейший алкен – ... этен (этилен). Молекулярная формула этилена ... С2H4 Структурная формула этилена ... СН2=
- 3. Особенности строения алканов Атомы углерода при двойной связи находятся в sp2-гибридном состоянии и между ними образуется
- 4. Особенности двойной связи Состоит из σ-связи и π-связи. Препятствует вращению атомов углерода вокруг своей оси.
- 8. 1. Ациклические углеводороды, в молекулах которых содержится одна двойная связь, называются А) алканы Б) алкены В)
- 9. 3. Формула 2,3-диметилпентена-1 А) СН2=С−СН2−СН2−СН3 Б) СН3−С=С−СН2−СН3 | | | СН3 Н3С СН3 В) СН3−СН−СН−СН2−СН3 Г)
- 10. Химические свойства алкенов
- 11. Химические свойства Алкены вступают в реакции присоединения, которые протекают по месту разрыва непрочной π-связи. Для алкенов
- 13. Реакции присоединения Гидрирование (+ Н2) Галогенирование (+ Г2) Гидрогалогенирование (+НГ) Гидратация (+ Н2О)
- 14. Качественная реакция на π-связь Качественная реакция на π-связь−это обесцвечивание бромной воды.
- 16. Гидрогалогенирование Гидратация Реакции гидрогалогенирования и гидратации несимметричных гомологов этилена идут легче по сравнению с этиленом и
- 17. Правило В.В. Марковникова При присоединении НГ или Н2О к несимметричному алкену водород присоединяется к более гидрированному
- 18. Гидрогалогенирование Гидратация
- 19. Реакции окисления Полное окисление−горение. Неполное окисление− взаимодействие с окислителями: KMnO4 − фиолетовый раствор
- 20. Горение Этилен горит красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое; это происходит
- 22. Мягкое окисление Качественная реакция на π-связь−обесцвечивание фиолетового раствора перманганата калия. этиленгликоль (этандиол-1, 2)
- 24. Полимеризация Полимеризация (особый тип реакций присоединения, в которых молекулы алкенов соединяются друг с другом с образованием
- 26. Полимер−это высокомолекулярное соединение (вмс) Мономер−это низкомолекулярное соединение n−степень полимеризации 1 группа − структурное звено
- 27. Сырье−полиэтилен
- 28. Изделия из полиэтилена
- 29. Сырье−полипропилен
- 30. Изделия из полипропилена
- 31. Свойства полиэтилена Полиэтилен полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, в размягченном состоянии легко
- 32. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени. Не изменяет окраску желтой бромной
- 34. 1. Реакция присоединения водорода называется А) гидрирование Б) гидрогалогенирование В) гидратация В) дегидрирование 2. В реакции
- 35. Реакция гидробромирования пропена протекает: 1) в соответствии с правилом В.В.Марковникова 2) в соответствии с правилом А.М.Зайцева
- 36. Предложите способ очистки пропана от примесей этилена. Напишите уравнения соответствующих реакций. Ответ: пропустить смесь газов через
- 37. Назовите химические реакции, которые являются общими для алканов и алкенов. Ответ: реакции горения.
- 38. 1. Дегидратация спиртов: H2SO4 H−CH2−CH2−OH → CH2=CH2 + H2O 2. Из галогеналканов: H−CH2−CH2−Br + KOHсп. р-р
- 39. 1. Бутен можно получить крекингом: А) бутана Б) пентана В) гексана Г) октана 2. Какие признаки
- 41. Скачать презентацию
 Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары
Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары Кислородные соединения азота
Кислородные соединения азота Галогены. Хлор
Галогены. Хлор Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений
Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений Суды тазарту әдістері
Суды тазарту әдістері Complex compounds
Complex compounds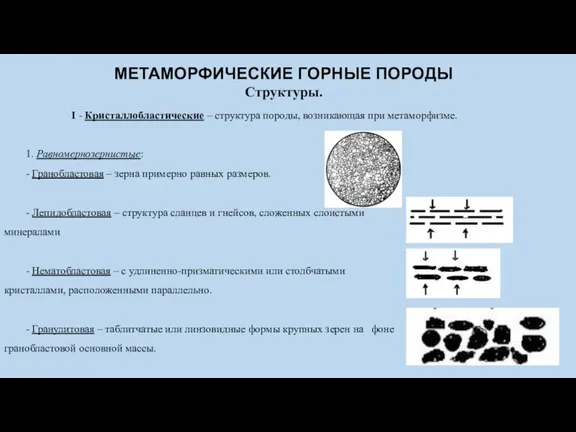 Метаморфические горные породы
Метаморфические горные породы Карбонильные соединения
Карбонильные соединения Химическая связь 11 класс ионная связь
Химическая связь 11 класс ионная связь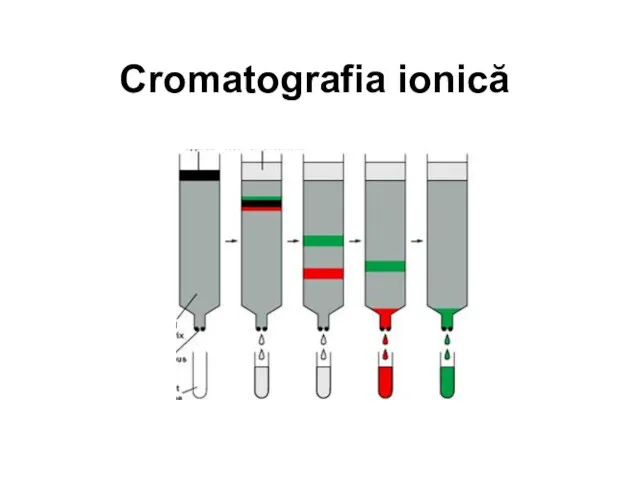 Cromatografia ionică
Cromatografia ionică Химические свойства металлов
Химические свойства металлов Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Омыватель лобового стекла автомобиля
Омыватель лобового стекла автомобиля Химические свойства металлов
Химические свойства металлов Железо. Соединения железа
Железо. Соединения железа Анионактивті беттік активті заттар
Анионактивті беттік активті заттар Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Азот
Азот Алифатические углеводороды: алканы, алкены, алкины
Алифатические углеводороды: алканы, алкены, алкины Химические свойства соляной кислоты
Химические свойства соляной кислоты Хром
Хром Обмен липидов
Обмен липидов Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Оптические свойства салических породообразующих минералов (лекция 8)
Оптические свойства салических породообразующих минералов (лекция 8) Предпосылки открытия периодического закона
Предпосылки открытия периодического закона Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость