Содержание
- 2. ХИМИЧЕСКАЯ СВЯЗЬ - сила, связывающая атомы в молекулы или другие частицы.
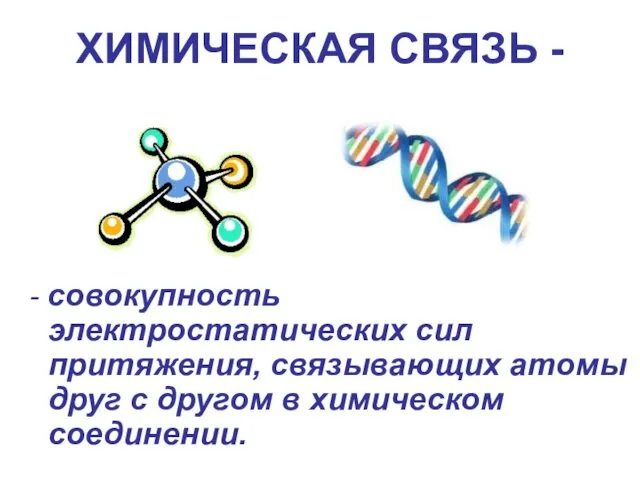
- 3. ХИМИЧЕСКАЯ СВЯЗЬ - - совокупность электростатических сил притяжения, связывающих атомы друг с другом в химическом соединении.
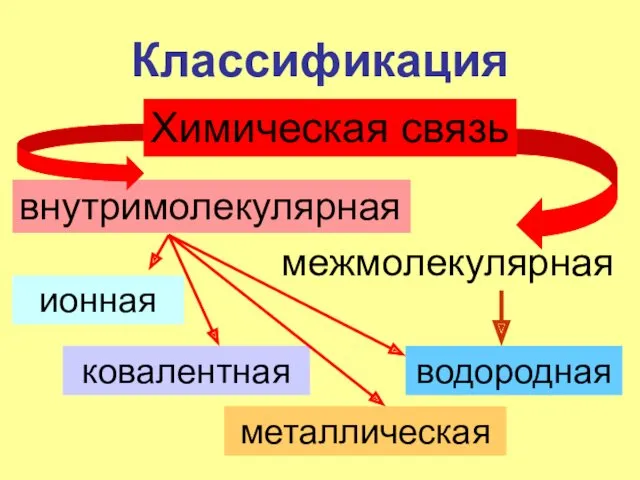
- 4. Классификация Химическая связь внутримолекулярная межмолекулярная ионная ковалентная металлическая водородная
- 5. Строение атомов.
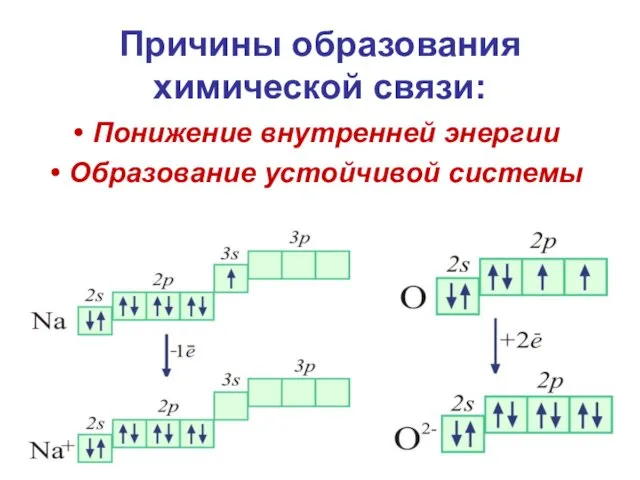
- 6. Причины образования химической связи: Понижение внутренней энергии Образование устойчивой системы
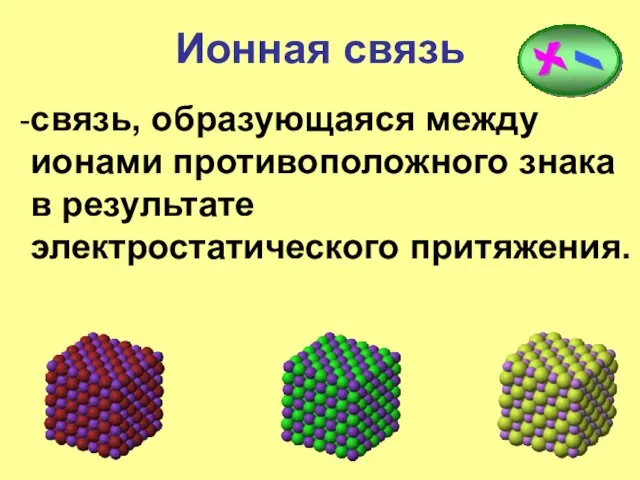
- 7. Ионная связь -связь, образующаяся между ионами противоположного знака в результате электростатического притяжения.
- 8. Ионы - это частицы, в которые превращаются атомы, отдавая или принимая электроны. Общая электронная пара полностью
- 9. Электроотрицательность (ЭО)- это способность атома смещать к себе общую электронную пару ОЭО Li = 1 Электроотрицательность
- 10. Ионная связь образуется между типичными Ме и НеМ Δ ОЭО элементов ≥ 1,7
- 11. Ионные соединения 1. Бинарные соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли
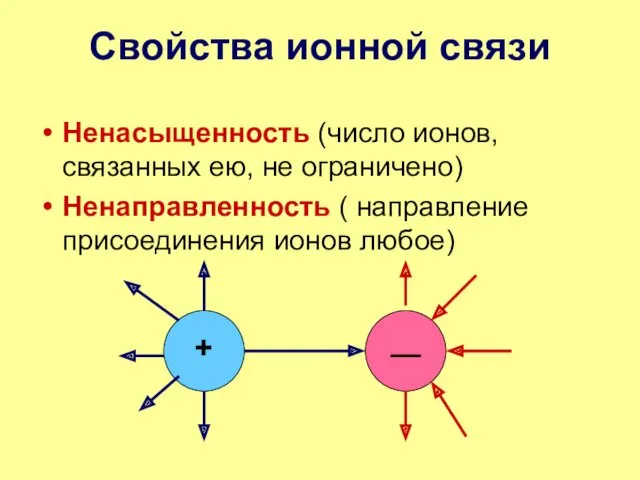
- 12. Свойства ионной связи Ненасыщенность (число ионов, связанных ею, не ограничено) Ненаправленность ( направление присоединения ионов любое)
- 13. Сульфат никеля Ионные соединения.
- 14. Медный купорос
- 15. Природный кристалл каменной соли
- 16. Кристаллические тела – характеризуются пространственной периодичностью в расположении равновесных положений атомов или молекул, при чем эта
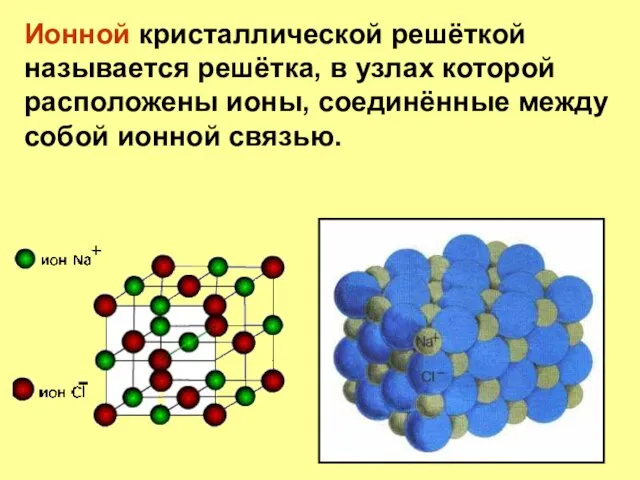
- 17. Ионной кристаллической решёткой называется решётка, в узлах которой расположены ионы, соединённые между собой ионной связью.
- 18. Свойства ионных соединений Твердые Нелетучие Высокие температуры плавления и кипения Хрупкие (легко разрушаются при деформации или
- 20. Скачать презентацию










 Материаловедение. Контрольная работа
Материаловедение. Контрольная работа Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Основания. 8 класс
Основания. 8 класс Фенолы
Фенолы Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс)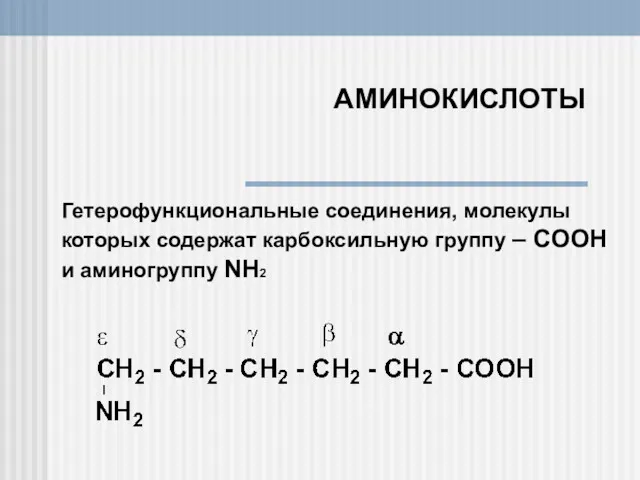 Аминокислоты. Гетерофункциональные соединения, молекулы
Аминокислоты. Гетерофункциональные соединения, молекулы Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Періодична система
Періодична система Применение уксусной кислоты
Применение уксусной кислоты Введение в кристаллографию
Введение в кристаллографию Обмоточные провода
Обмоточные провода Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Предмет органической химии
Предмет органической химии Химические элементы IV группы главной подгруппы
Химические элементы IV группы главной подгруппы Получение и свойства кислорода
Получение и свойства кислорода Химическая связь. Лекция 5
Химическая связь. Лекция 5 Азотные удобрения
Азотные удобрения Титриметрический метод анализа
Титриметрический метод анализа ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Простые вещества – неметаллы
Простые вещества – неметаллы Борорганические соединения и их применение
Борорганические соединения и их применение Chemical kinetics
Chemical kinetics Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Получение металлов. (9 класс)
Получение металлов. (9 класс) Жиры
Жиры Строение и свойства циклоалканов
Строение и свойства циклоалканов