Содержание
- 2. Ковалентная связь - это химическая связь, возникающая между атомами за счет образования общих электронных пар.
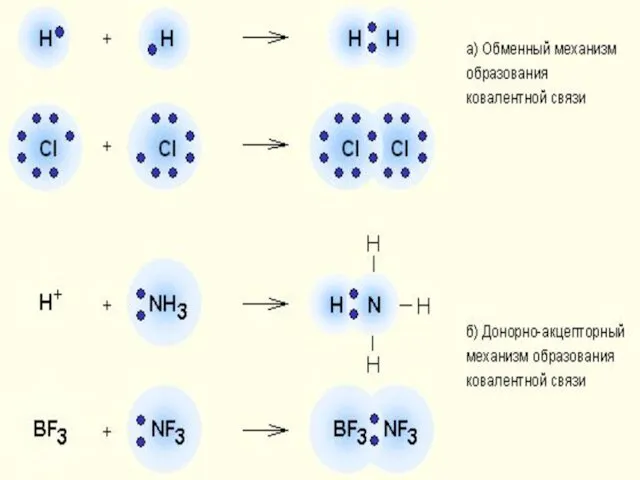
- 3. Классификация КС 1. По механизму образования Обменный механизм Каждый из атомов предоставляет неспаренный ( неспаренные) электроны
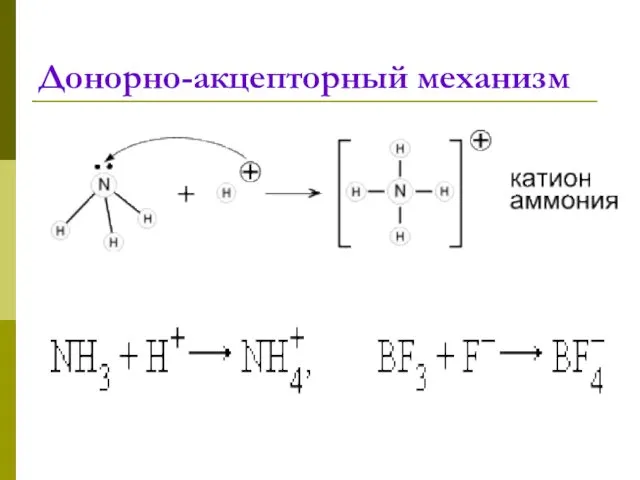
- 5. Донорно-акцепторный механизм
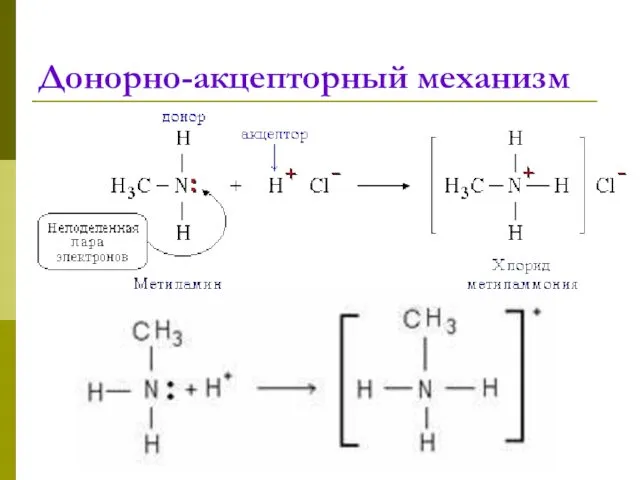
- 6. Донорно-акцепторный механизм
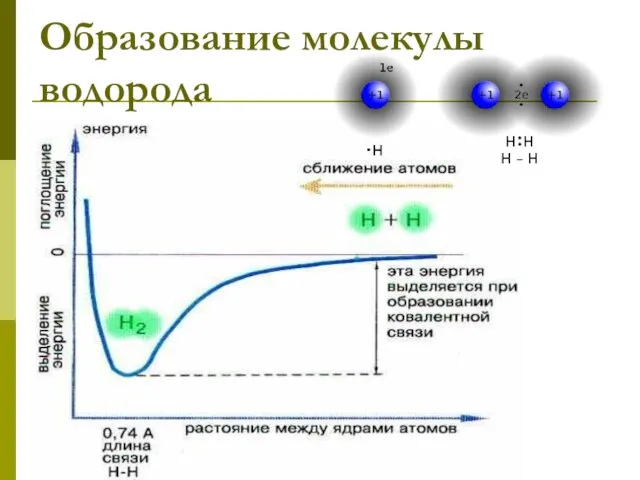
- 7. Образование молекулы водорода
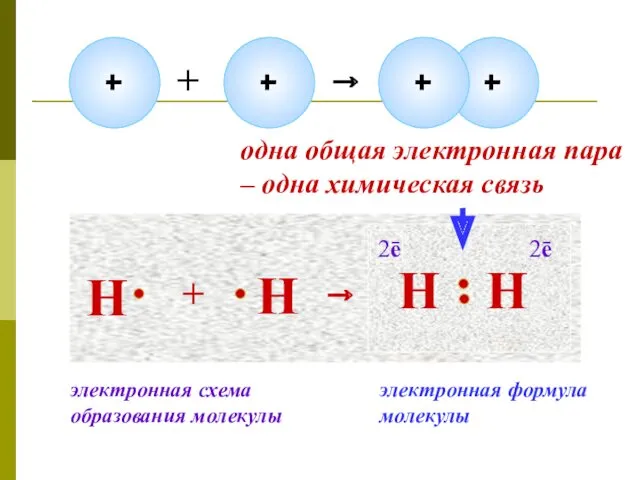
- 8. Н + Н → Н Н 2ē 2ē одна общая электронная пара – одна химическая связь
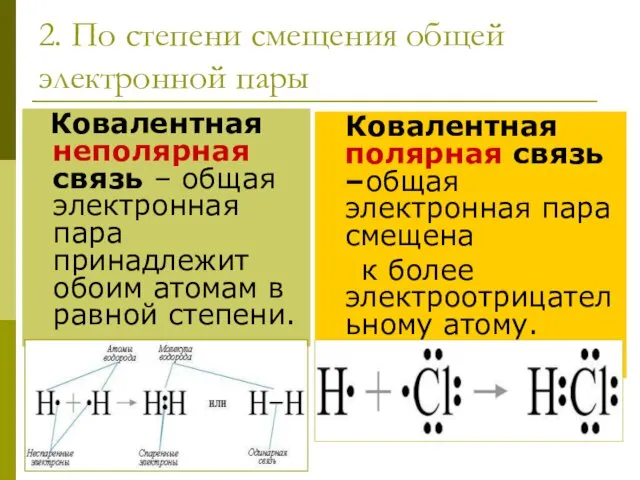
- 9. 2. По степени смещения общей электронной пары Ковалентная неполярная связь – общая электронная пара принадлежит обоим
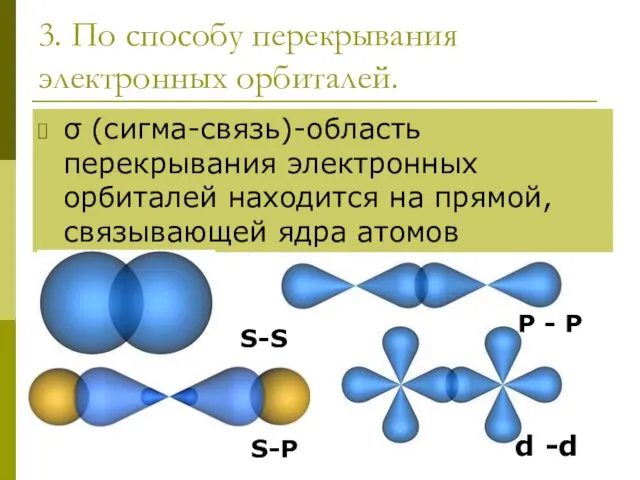
- 10. 3. По способу перекрывания электронных орбиталей. σ (сигма-связь)-область перекрывания электронных орбиталей находится на прямой, связывающей ядра
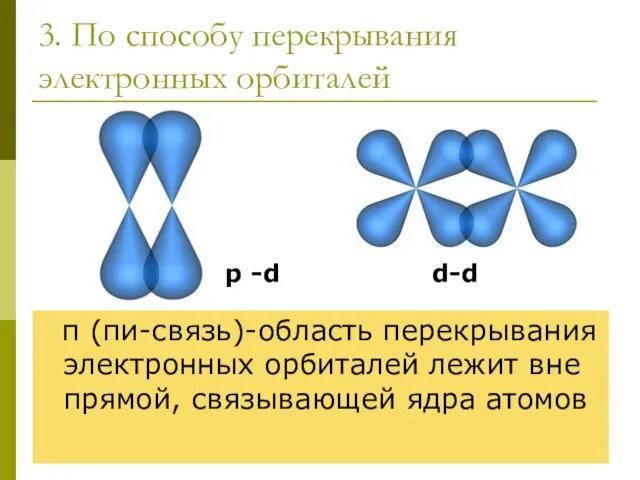
- 11. 3. По способу перекрывания электронных орбиталей π (пи-связь)-область перекрывания электронных орбиталей лежит вне прямой, связывающей ядра
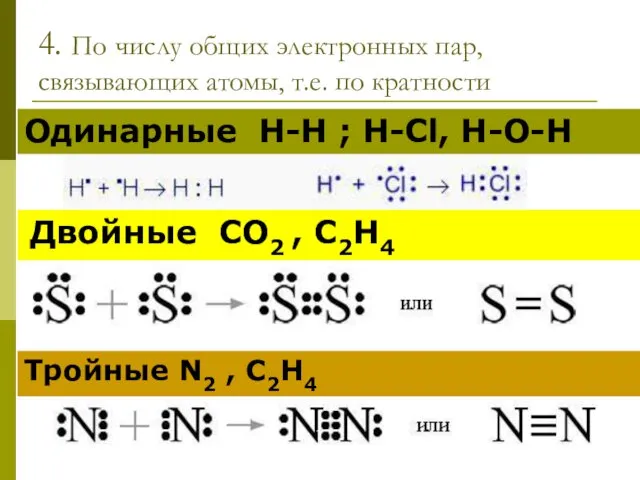
- 12. 4. По числу общих электронных пар, связывающих атомы, т.е. по кратности Одинарные Н-Н ; H-Cl, H-O-H
- 13. Типы кристаллических решеток Молекулярная В узлах находятся молекулы. Силы притяжения слабые. Вещества непрочные, легкоплавкие, летучие. Газы
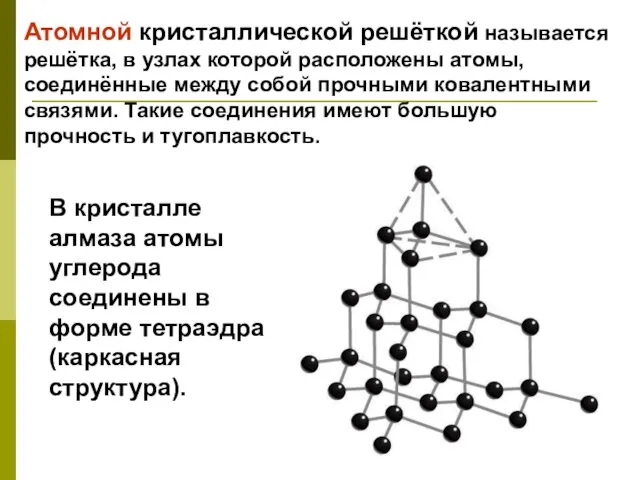
- 14. Атомной кристаллической решёткой называется решётка, в узлах которой расположены атомы, соединённые между собой прочными ковалентными связями.
- 15. Алмаз.
- 17. Молекулярной кристаллической решёткой называется решётка, в узлах которой расположены молекулы, удерживаемые силами межмолекулярного взаимодействия . Такие
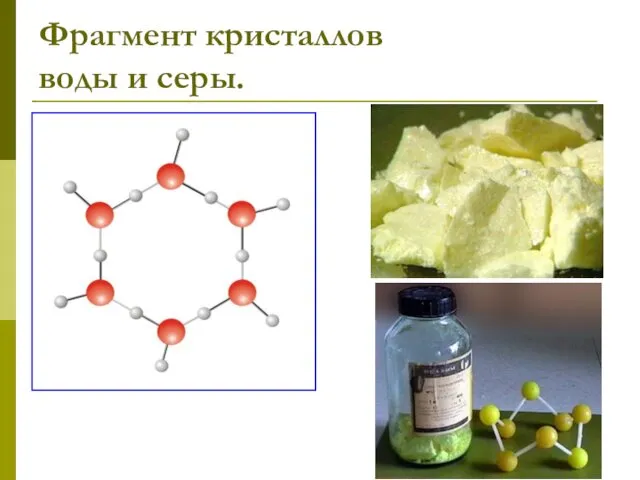
- 18. Фрагмент кристаллов воды и серы.
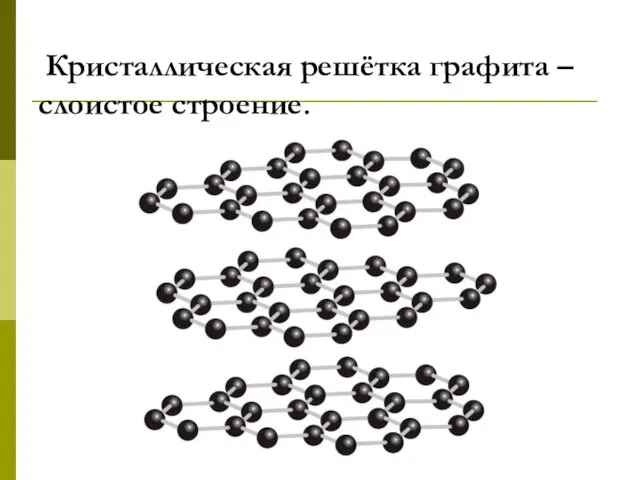
- 19. Кристаллическая решётка графита –слоистое строение.
- 20. Графит.
- 22. Скачать презентацию







 Метали VI групи побічної підгрупи (Cr, Mo, W)
Метали VI групи побічної підгрупи (Cr, Mo, W) Природный газ и нефть
Природный газ и нефть Бинарные соединения
Бинарные соединения Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи Галогены. Свойства
Галогены. Свойства Химия өнеркәсібі
Химия өнеркәсібі Классы неорганических веществ
Классы неорганических веществ Карбон қышқылдары
Карбон қышқылдары Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Алкадієни (дiєнові вуглеводні або дiєни)
Алкадієни (дiєнові вуглеводні або дiєни) Электрохимия. Понятие о двойном электрическом слое (ДЭС)
Электрохимия. Понятие о двойном электрическом слое (ДЭС) Электролитическая диссоциация
Электролитическая диссоциация Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Химические свойства металлов
Химические свойства металлов Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Тему Соли. Нитрат серебра(I) AgNO3
Тему Соли. Нитрат серебра(I) AgNO3 Термический анализ
Термический анализ Термодинамическое равновесие
Термодинамическое равновесие Аминокислоты
Аминокислоты Химический элемент. Неон
Химический элемент. Неон Технология промышленных газов
Технология промышленных газов 5-я группа элементов
5-я группа элементов Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6 Сложные эфиры
Сложные эфиры Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)
Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)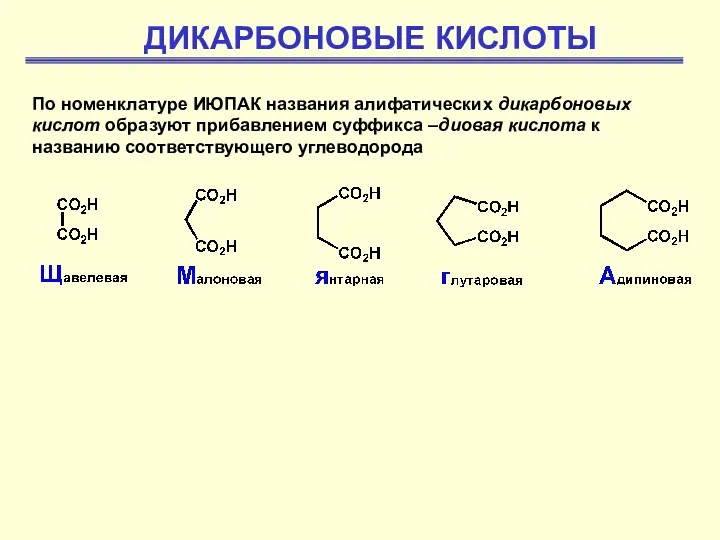 Дикарбоновые кислоты
Дикарбоновые кислоты Хімічні явища в побуті
Хімічні явища в побуті