Содержание
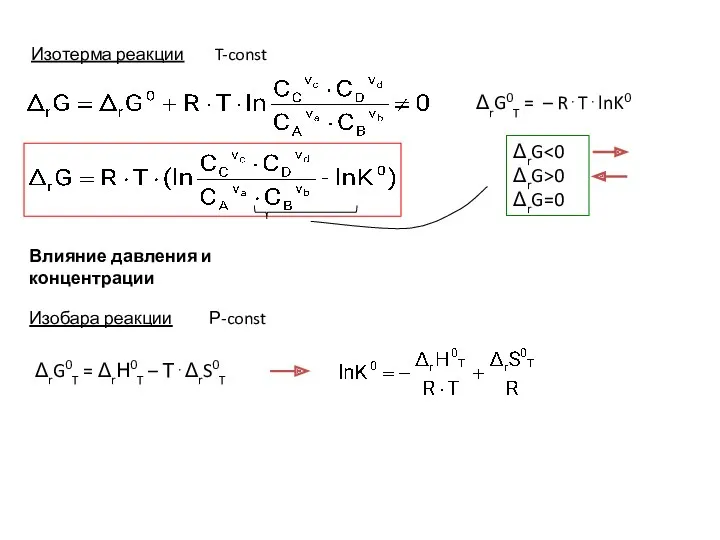
- 2. Изобара реакции Р-const ΔrG0T = ΔrН0T – Т⋅ΔrS0T Влияние давления и концентрации
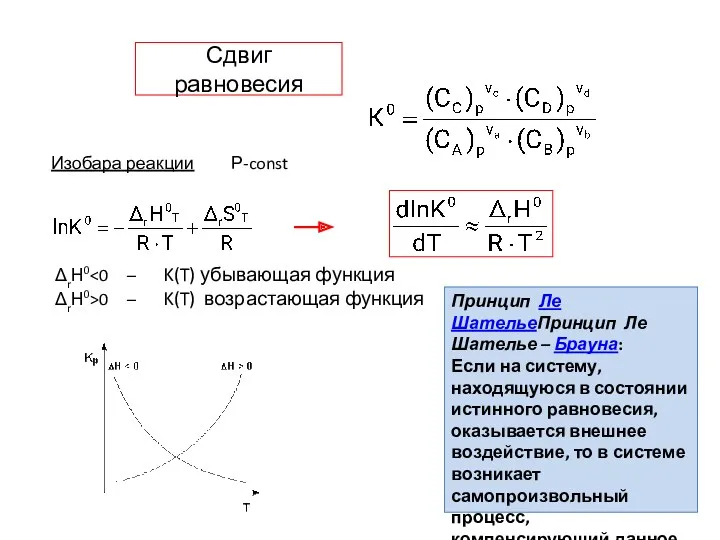
- 3. Сдвиг равновесия Изобара реакции Р-const ΔrН0 ΔrН0>0 – K(T) возрастающая функция Принцип Ле ШательеПринцип Ле Шателье
- 4. Химическое равновесие Термодинамические параметры: T; P; νi; Сi – const 1. Термодинамическое условие равновесия - ΔrG
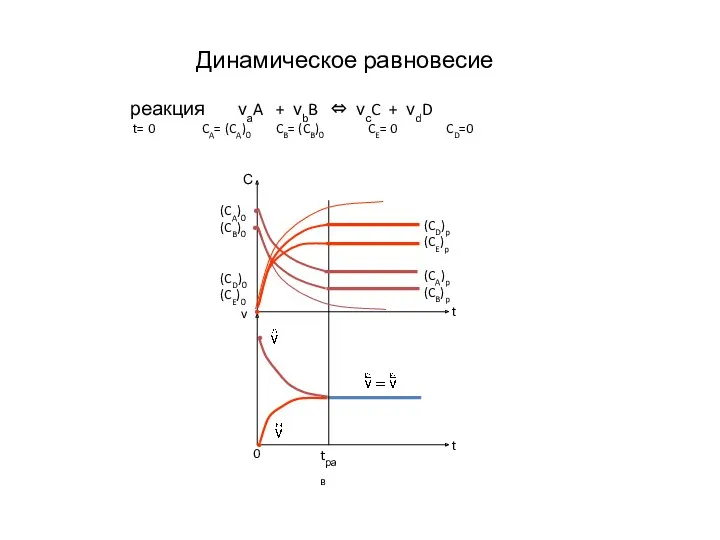
- 5. Динамическое равновесие реакция νаA + νbB ⇔ νсC + νdD t= 0 CA= (CA)0 CB= (CB)0
- 6. Константа равновесия KX - концентрации задаются мольными долями (безразмерная величина) Kp - концентрации задаются парциальными давлениями
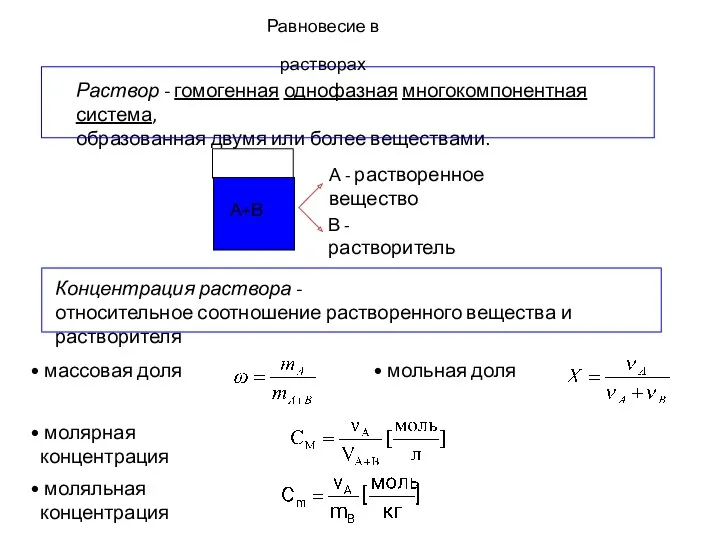
- 7. Равновесие в растворах
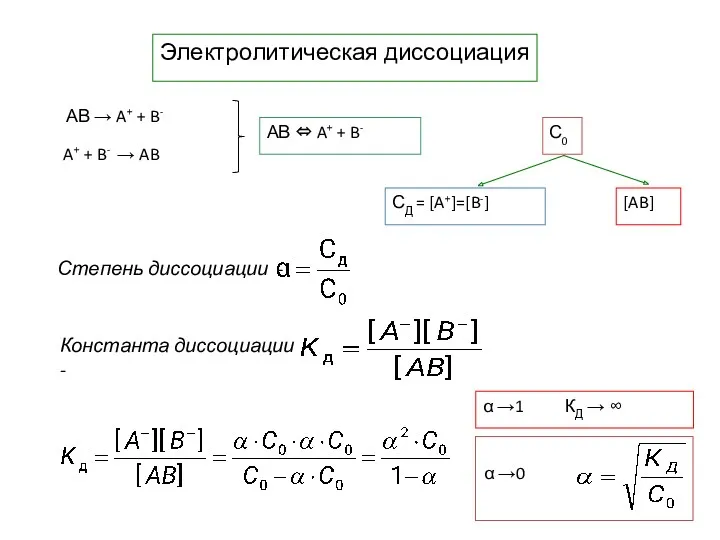
- 8. Электролитическая диссоциация С0 α →1 КД → ∞
- 10. Диссоциация воды H2O ⇔ H+ + OH- Нейтральная среда [H+] = [OH–] = 10-7 [моль/л] Кислая
- 11. Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая среда pH Щелочная среда pH
- 12. Произведение растворимости [Kat+]= x·C [моль/л] [An-]= y·C [моль/л]
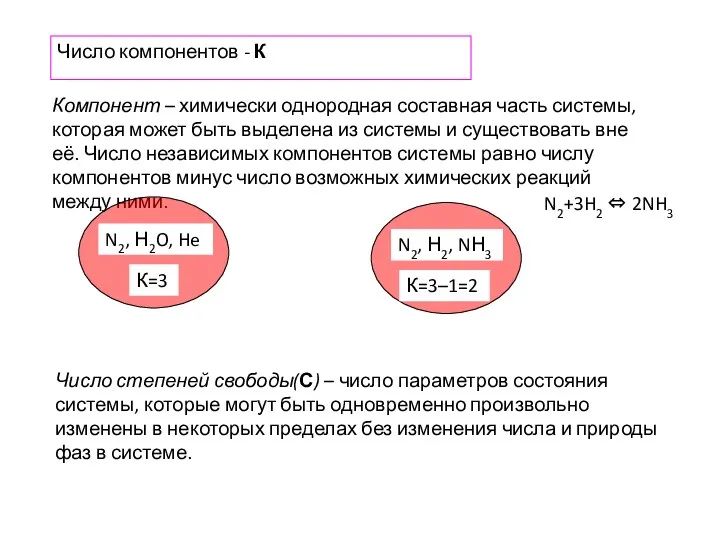
- 13. Число компонентов - К Компонент – химически однородная составная часть системы, которая может быть выделена из
- 14. Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз
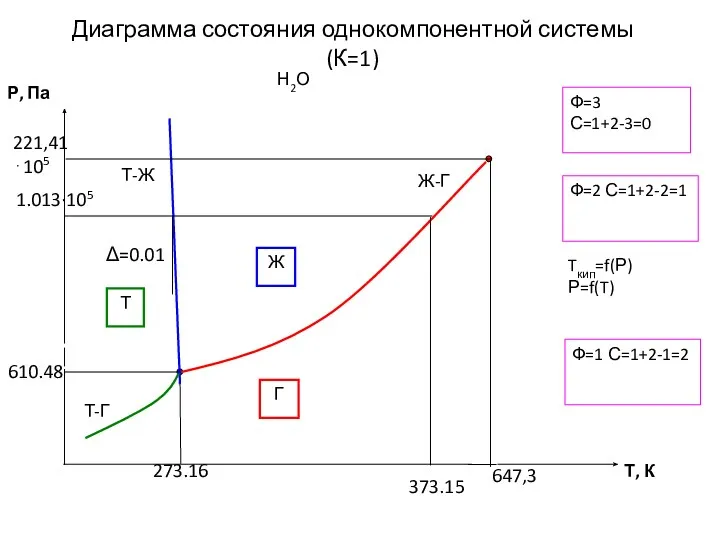
- 15. Диаграмма состояния однокомпонентной системы (К=1) Н2О Ф=2 С=1+2-2=1 Ф=3 С=1+2-3=0 Ф=1 С=1+2-1=2 Ж Г Т Tкип=f(Р)
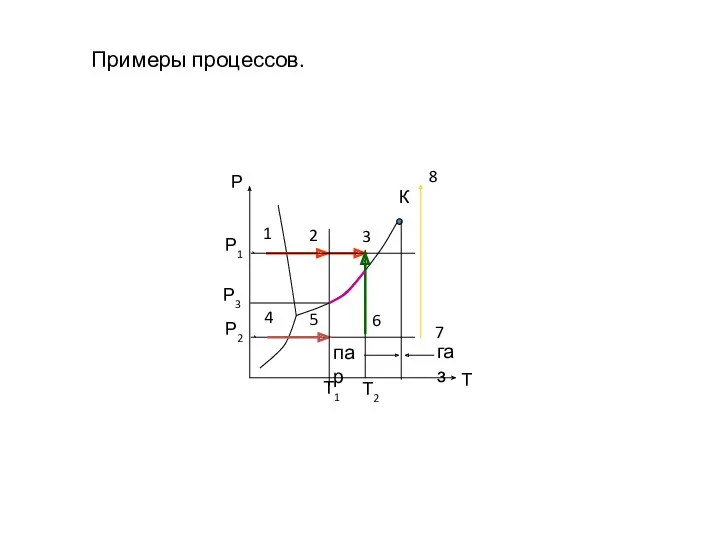
- 16. Примеры процессов.
- 17. Двухкомпонентная система (К=2) α→0 Двухфазное равновесие С = 2 + 2 – 2 = 2 1)
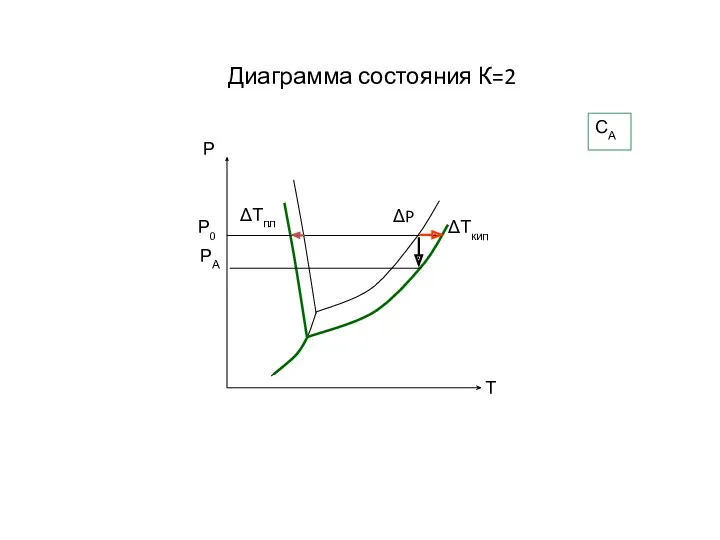
- 18. Диаграмма состояния К=2 СА
- 19. Кипение и кристаллизация растворов Повышение температуры кипения раствора по сравнению с чистым растворителем (ΔТкип) прямо пропорционально
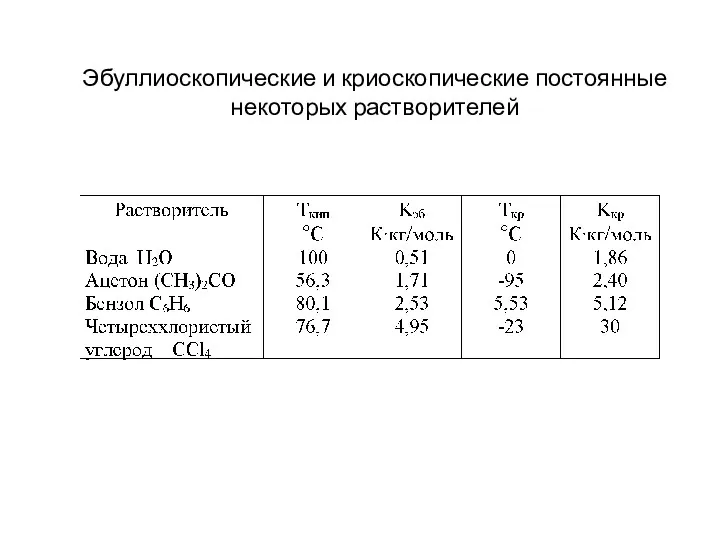
- 20. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 22. Скачать презентацию



![Диссоциация воды H2O ⇔ H+ + OH- Нейтральная среда [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/406711/slide-9.jpg)
![Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/406711/slide-10.jpg)
![Произведение растворимости [Kat+]= x·C [моль/л] [An-]= y·C [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/406711/slide-11.jpg)



 Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения Интоксикации сельскохозяйственными ядохимикатами (пестицидами)
Интоксикации сельскохозяйственными ядохимикатами (пестицидами) Интеллектуальная игра Знатоки по химии
Интеллектуальная игра Знатоки по химии Определение окисляемости воды
Определение окисляемости воды Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Figure
Figure Химический факультет
Химический факультет Классификация органических соединений
Классификация органических соединений Тепловой эффект химической реакции. 11 класс
Тепловой эффект химической реакции. 11 класс Жесткость воды. Способы ее устранения
Жесткость воды. Способы ее устранения Виды соли и ее значение в питании
Виды соли и ее значение в питании Строение и свойства металлов и сплавов. Тема 1
Строение и свойства металлов и сплавов. Тема 1 Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями
Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями Свойства моторных топлив
Свойства моторных топлив Лужноземельні метали
Лужноземельні метали Введение в количественный анализ
Введение в количественный анализ Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Амины и их свойства
Амины и их свойства Вплив хімічних сполук на довкілля
Вплив хімічних сполук на довкілля Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Металлы. Особенности строения. Классификация, физические и химические свойства
Металлы. Особенности строения. Классификация, физические и химические свойства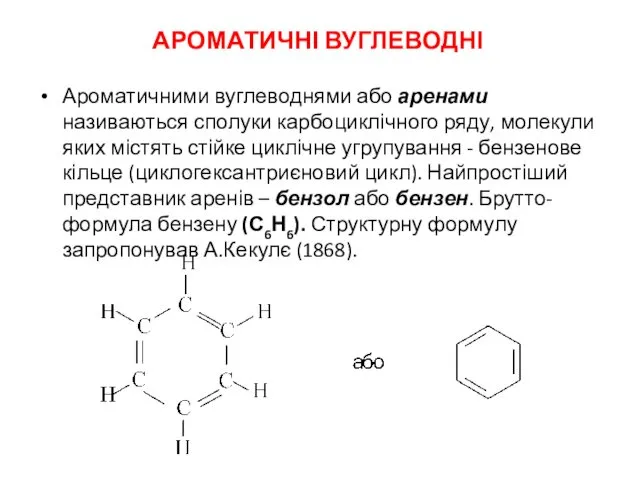 Ароматичні вуглеводні
Ароматичні вуглеводні Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Смещение химического равновесия
Смещение химического равновесия Металлы. Распространённость металлов в земной коре
Металлы. Распространённость металлов в земной коре Химическая промышленность
Химическая промышленность Вода – основа жизни на Земле
Вода – основа жизни на Земле Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений