Содержание
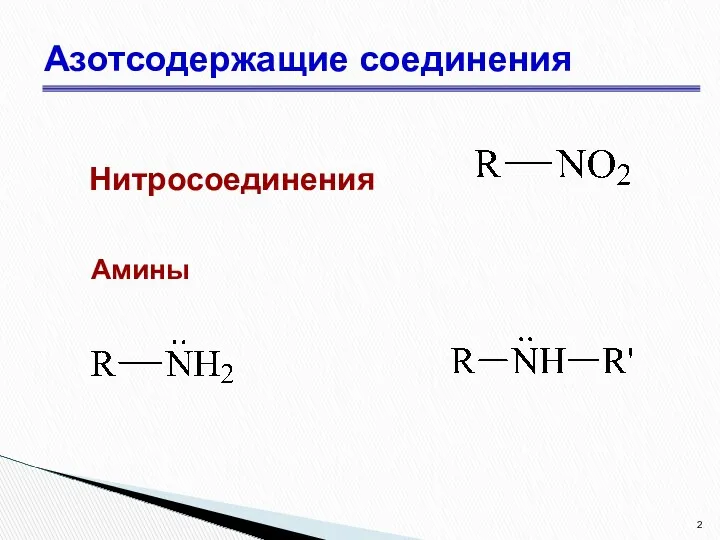
- 2. Азотсодержащие соединения Нитросоединения Амины
- 3. Амины – органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены
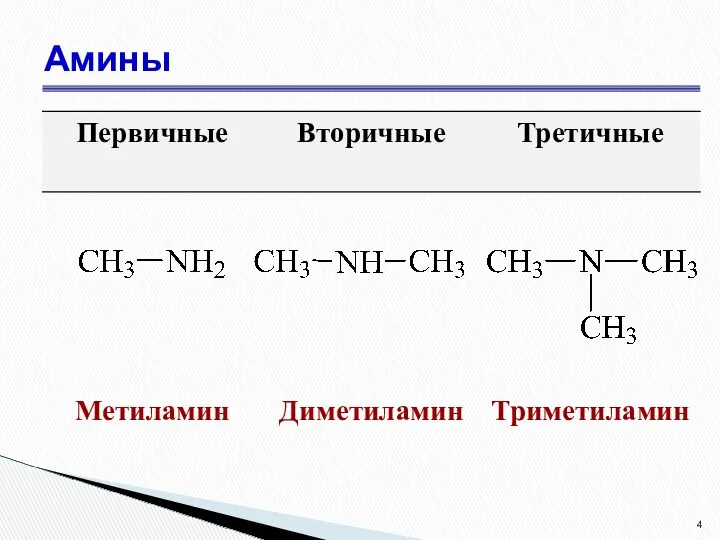
- 4. Амины
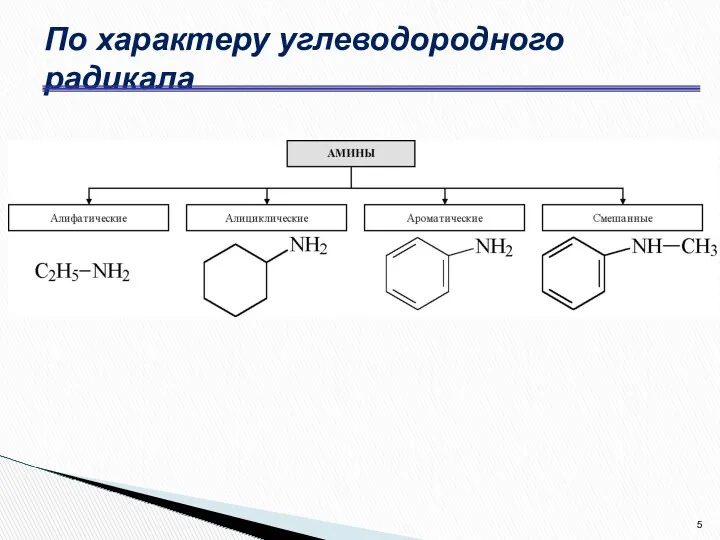
- 5. По характеру углеводородного радикала
- 6. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин: CH3-NH2 Метиламин CH3-CH2-NH2
- 7. Амины Номенклатура 2-метилпропанамин (изобутиламин) (CH3)2CHCH2NH2
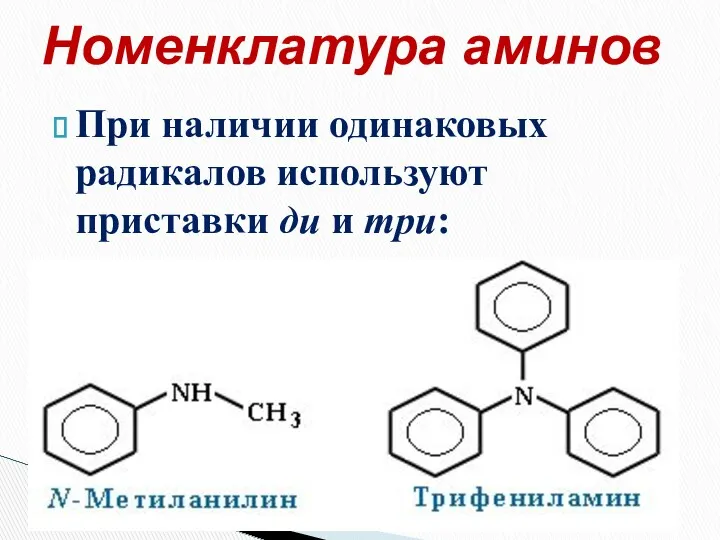
- 8. При наличии одинаковых радикалов используют приставки ди и три: (CH3)2NH диметиламин (CH3)3N триметиламин Номенклатура аминов
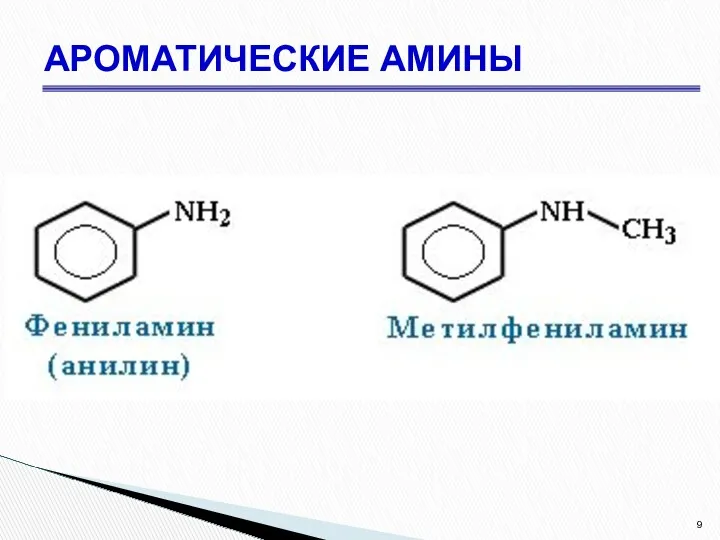
- 9. АРОМАТИЧЕСКИЕ АМИНЫ
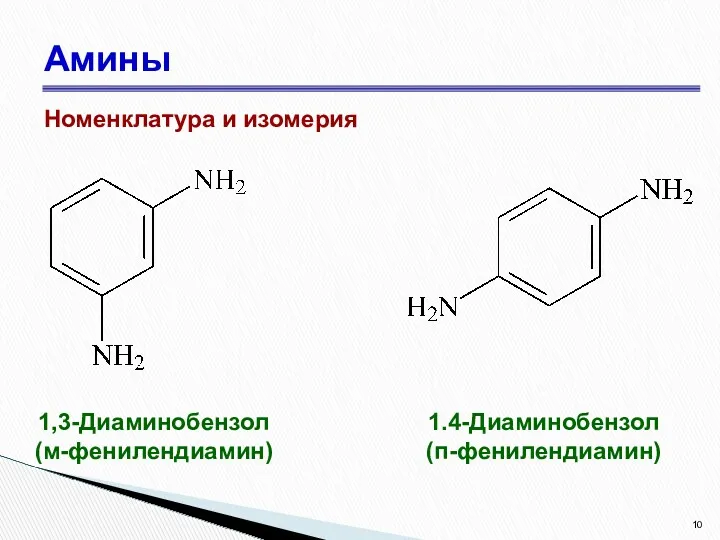
- 10. Амины Номенклатура и изомерия 1,3-Диаминобензол (м-фенилендиамин) 1.4-Диаминобензол (п-фенилендиамин)
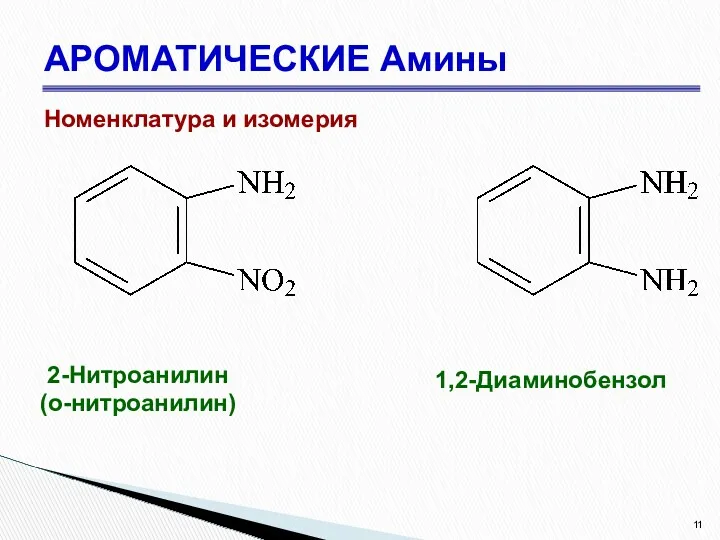
- 11. АРОМАТИЧЕСКИЕ Амины Номенклатура и изомерия 2-Нитроанилин (о-нитроанилин) 1,2-Диаминобензол
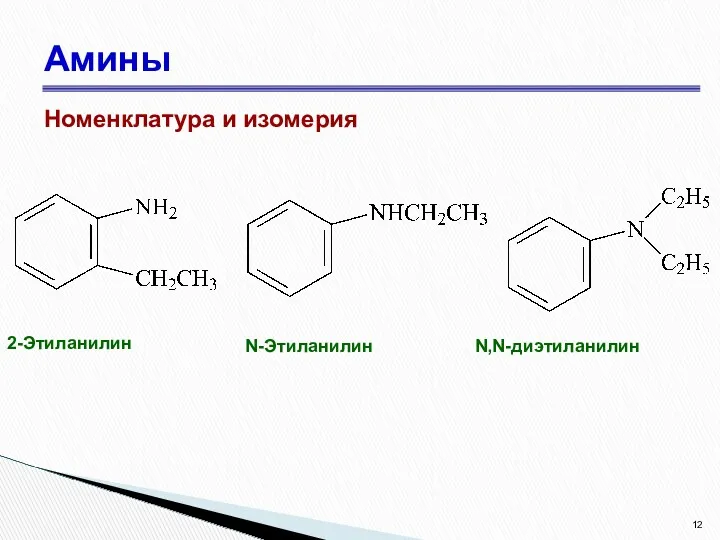
- 12. Амины Номенклатура и изомерия 2-Этиланилин N-Этиланилин N,N-диэтиланилин
- 13. При наличии одинаковых радикалов используют приставки ди и три: Номенклатура аминов
- 14. 1. Структурная изомерия - углеродного скелета, начиная с С4H9NH2: Изомерия аминов
- 15. Структурная изомерия - положения аминогруппы, начиная с С3H7NH2: Изомерия аминов
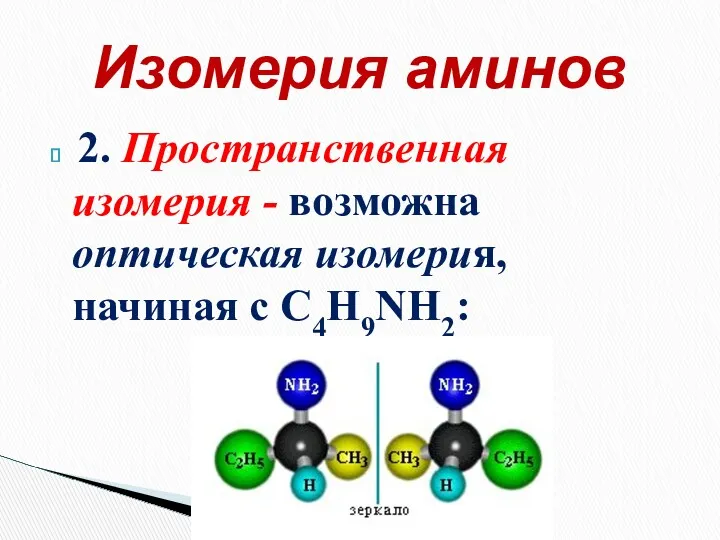
- 16. 2. Пространственная изомерия - возможна оптическая изомерия, начиная с С4H9NH2: Изомерия аминов
- 17. Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи: Физические свойства аминов
- 18. Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой.
- 19. Третичные амины не образуют водородных связей (отсутствует группа N–H). Их температуры кипения ниже, чем у изомерных
- 20. При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние
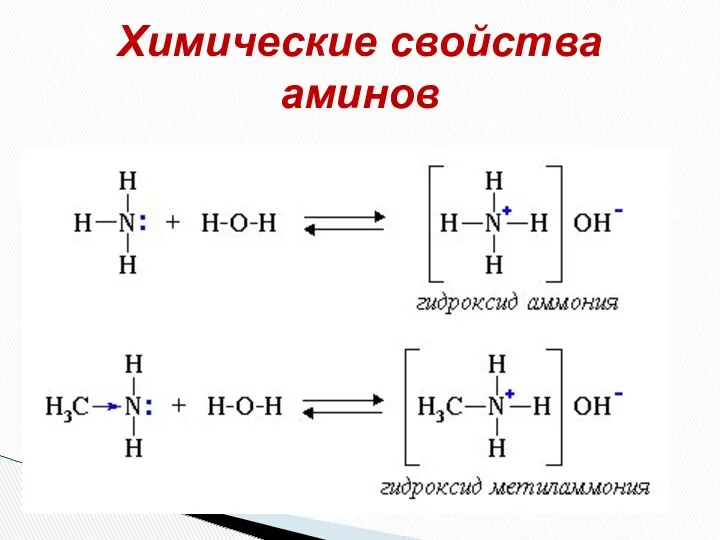
- 22. Химические свойства аминов
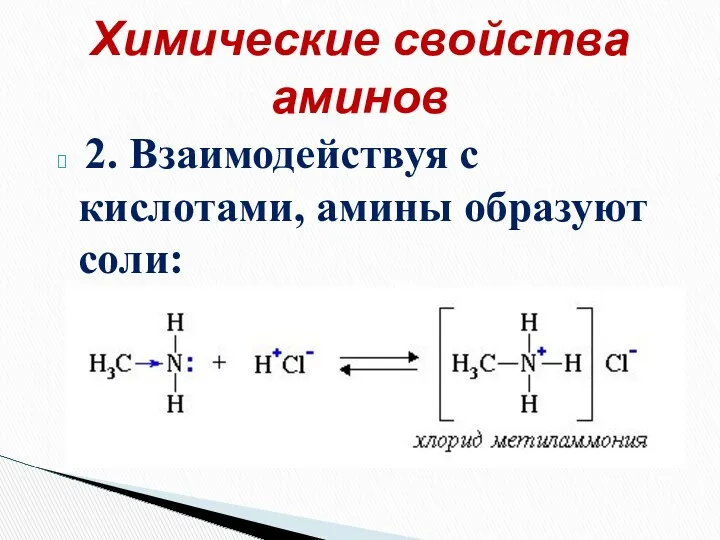
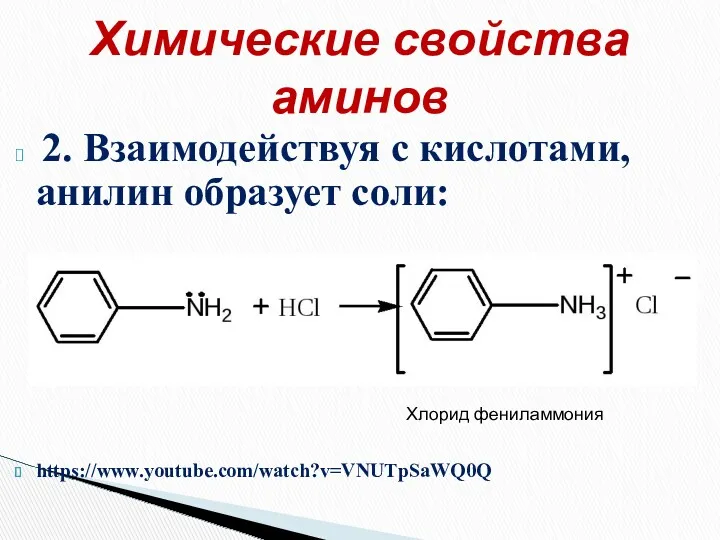
- 23. 2. Взаимодействуя с кислотами, амины образуют соли: Химические свойства аминов
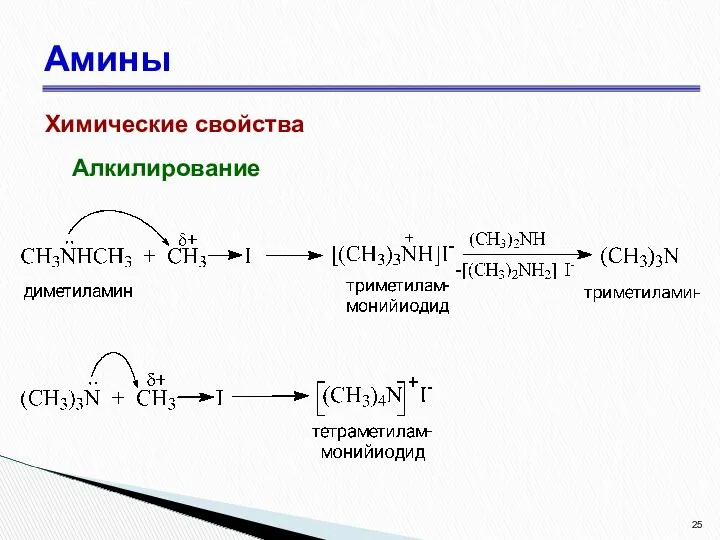
- 24. 3. Алкилирование (реакция Гофмана, 1850) 19.02.1660 - 12.11.1742 Гофман Фридрих
- 25. Амины Химические свойства Алкилирование
- 26. 3. В отличие от аммиака, низшие газообразные амины способны воспламеняться от открытого пламени. Реакция горения (полного
- 27. Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов: Анилин
- 28. Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. –
- 29. Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены
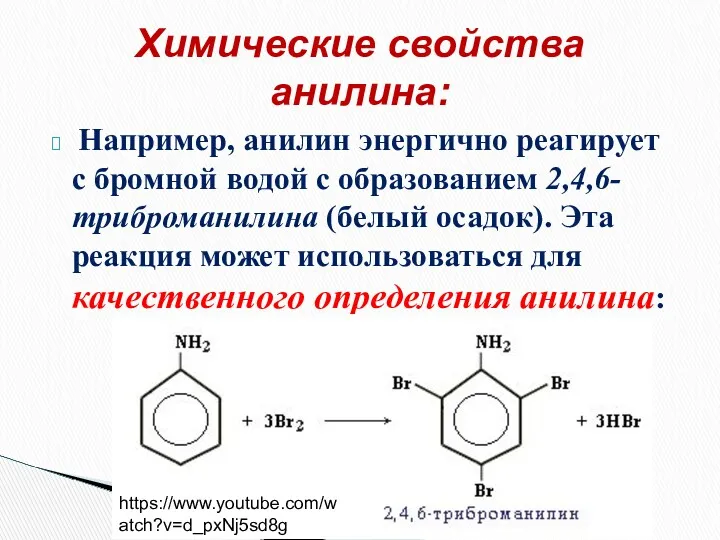
- 30. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться
- 31. 2. Взаимодействуя с кислотами, анилин образует соли: https://www.youtube.com/watch?v=VNUTpSaWQ0Q Химические свойства аминов Хлорид фениламмония
- 32. 1. Наиболее общим методом получения первичных аминов является восстановление нитросоединений: Получение аминов
- 33. Важнейший ароматический амин - анилин - образуется при восстановлении нитробензола (восстановители - водород в присутствии металлических
- 34. ЗИНИН Николай Николаевич (25.VIII.1812–18.II.1880) академик, возглавлял кафедру общей химии Медико-хирургической академии в Петербурге, организатор и первый
- 35. C6H5NH2 + O2 --> CO2 + N2 + H2O https://www.youtube.com/watch?v=cYtCWMczFFs Реакция горения анилина
- 37. Широкое применение в качестве полупродукта в производстве витаминов и лекарственных средств (сульфаниламидные препараты). Применение анилина
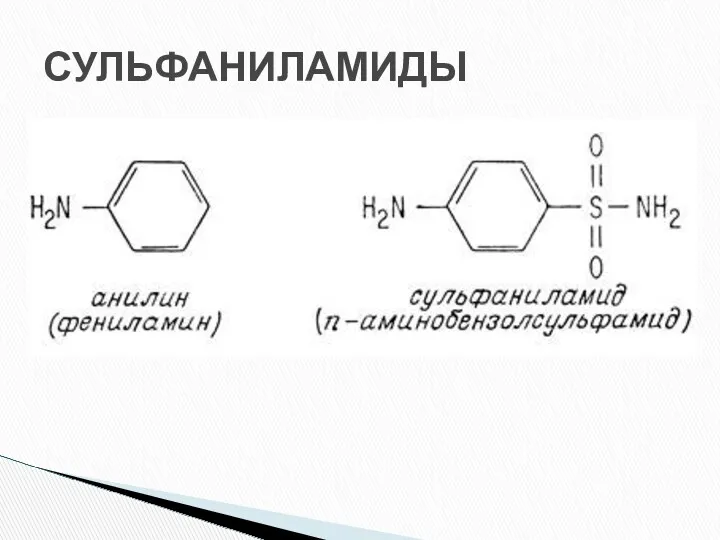
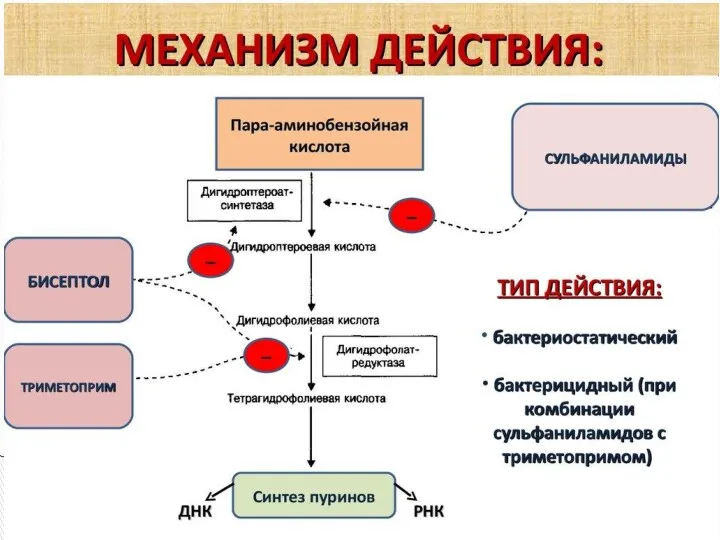
- 39. СУЛЬФАНИЛАМИДЫ
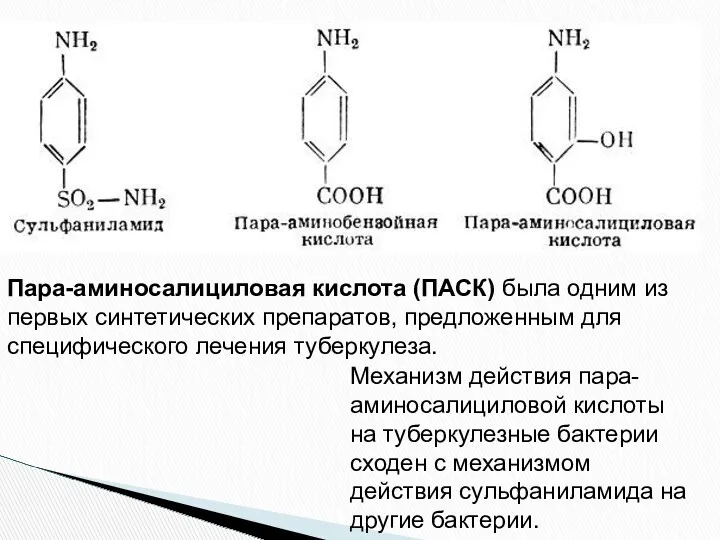
- 40. Пара-аминосалициловая кислота (ПАСК) была одним из первых синтетических препаратов, предложенным для специфического лечения туберкулеза. Механизм действия
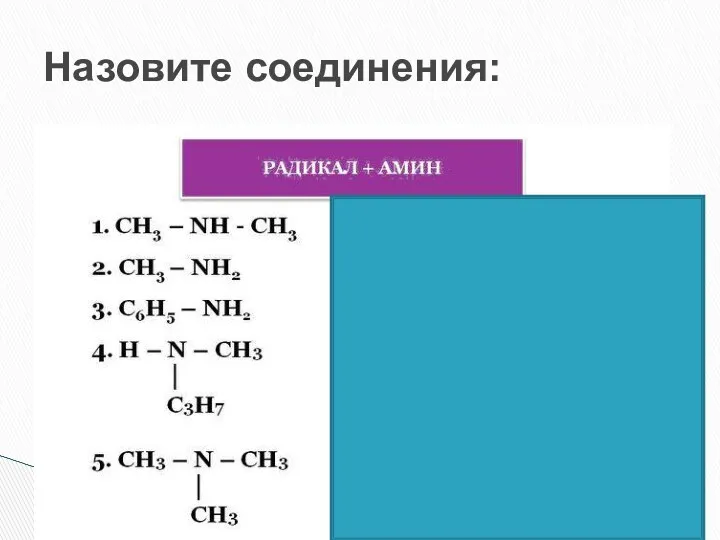
- 42. Назовите соединения:
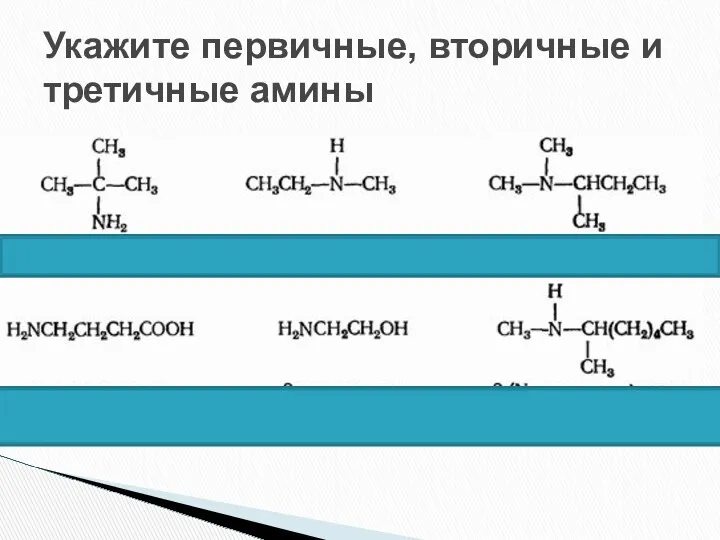
- 43. Укажите первичные, вторичные и третичные амины
- 44. Амины Номенклатура и изомерия
- 46. Скачать презентацию























 Жиры
Жиры Хром и его соединения
Хром и его соединения Открытие Периодического закона
Открытие Периодического закона Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Основные виды и понятия курса органической химии в старшей школе
Основные виды и понятия курса органической химии в старшей школе Химические свойства металлов
Химические свойства металлов Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Кислородные соединения азота
Кислородные соединения азота Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Общая характеристика галогенов
Общая характеристика галогенов Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Классы неорганических веществ. Лекция №4
Классы неорганических веществ. Лекция №4 Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Алкани. Ізомерія та номенклатура алканів
Алкани. Ізомерія та номенклатура алканів Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Глицерин. Свойства и применение
Глицерин. Свойства и применение КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Элементы VII группы периодической таблицы Д.И. Менделеева
Элементы VII группы периодической таблицы Д.И. Менделеева Redox Reactions
Redox Reactions Термический анализ
Термический анализ Растворы электролитов. Ионизация воды и шкала рН
Растворы электролитов. Ионизация воды и шкала рН Колдовство волшебницы ОВ: окислительные или восстановительные превращения
Колдовство волшебницы ОВ: окислительные или восстановительные превращения Мотивирующие цитаты великих людей
Мотивирующие цитаты великих людей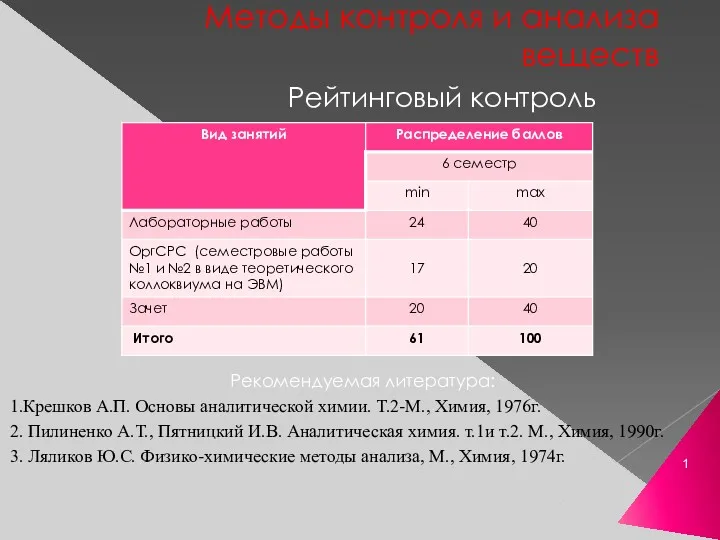 Методы контроля и анализа веществ
Методы контроля и анализа веществ Карбоновые кислоты
Карбоновые кислоты Анализ лекарственных форм
Анализ лекарственных форм