Содержание
- 2. 1. Проработайте теоретический материал параграфа № 84 совместно с презентацией. 2. https://www.youtube.com/watch?v=bymkbOH6EP8 просмотреть видеоролик (первые 7
- 3. Тема урока 10.4.2.38 составлять уравнения реакций галогеноалканов с нуклеофильными реагентами; 10.4.2.39 объяснять механизм реакций нуклеофильного замещения
- 4. Типы разрыва ковалентной связи Гомолитический Гетеролитический Симметричный разрыв связи - , при котором каждый атом получает
- 5. Частицы, образованные при гетеролитическом разрыве химической связи Электрофил [El] – частица с недостатком электронной плотности, имеющая
- 6. Примеры нуклеофильных и электрофильных частиц Нуклеофильные реагенты [Nu] - образуют новые ковалентные связи с партнёром, предоставляя
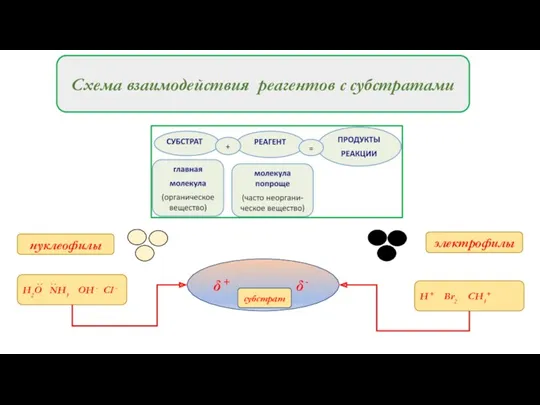
- 7. Схема взаимодействия реагентов с субстратами δ + δ - нуклеофилы электрофилы . . . . Н2О
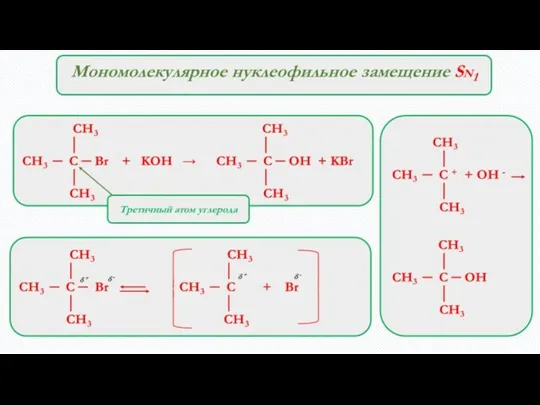
- 8. Реакции нуклеофильного замещения SN За счёт смещения электронной плотности к хлору (более ЭО) у углерода недостаток
- 9. Реакции нуклеофильного замещения SN2 SN2 ─ бимолекулярное замещение – одностадийный процесс в ходе которого присоединение нуклеофила
- 10. Примеры нуклеофильного замещения CH3 ─ Cl SN + NaOH + NaCN + NaI + AgNO2 +
- 12. Задания. 1. В какой молекуле связь между галогеном и углеродом более полярная А) СH3Cl Б) CH3Br
- 14. Скачать презентацию



![Частицы, образованные при гетеролитическом разрыве химической связи Электрофил [El] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/244577/slide-4.jpg)
![Примеры нуклеофильных и электрофильных частиц Нуклеофильные реагенты [Nu] - образуют](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/244577/slide-5.jpg)




 Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Способы производства железоуглеродистых сплавов
Способы производства железоуглеродистых сплавов Суспензии: получение, свойства
Суспензии: получение, свойства Соли (12 класс)
Соли (12 класс) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Химические опасности. Нитраты
Химические опасности. Нитраты Lipid metabolism
Lipid metabolism Контроль результатов обучения химии
Контроль результатов обучения химии Галогены. Строение атомов и молекул галогенов
Галогены. Строение атомов и молекул галогенов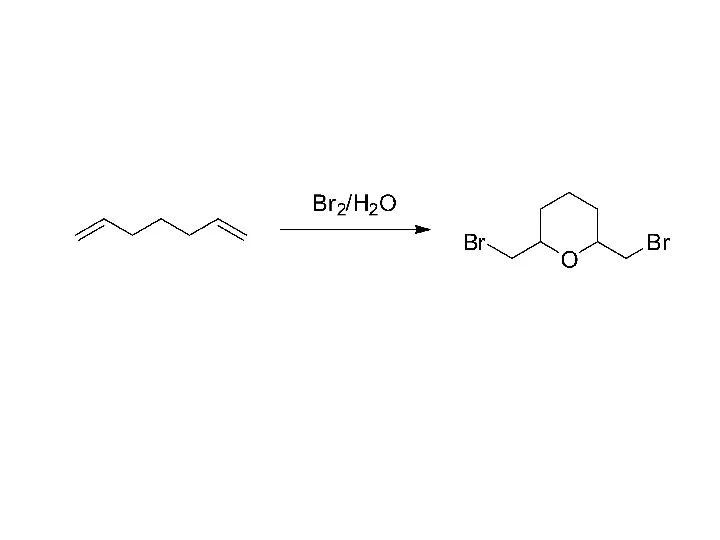 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Три состояния вещества
Три состояния вещества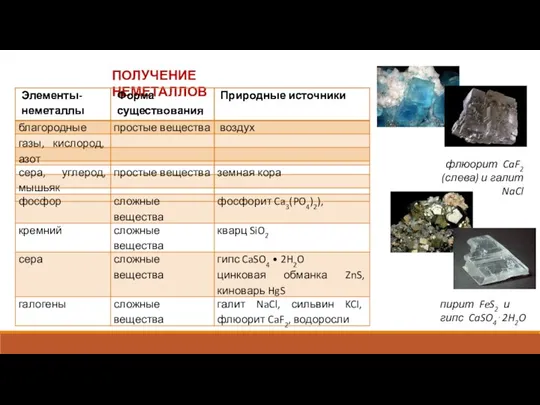 Получение неметаллов
Получение неметаллов Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Алюминий. Определите элемент
Алюминий. Определите элемент Оксид кальция (СаО)
Оксид кальция (СаО) Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция Растворы. Основные понятия и определения
Растворы. Основные понятия и определения Игра - викторина
Игра - викторина Лекция 2 Периодический закон
Лекция 2 Периодический закон Techniques for preparation of gaseous samples with a desired concentration of analyte
Techniques for preparation of gaseous samples with a desired concentration of analyte Химия в повседневной жизни человека
Химия в повседневной жизни человека Предмет органической химии
Предмет органической химии Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения Атом құрылысы
Атом құрылысы Химический элемент - водород
Химический элемент - водород Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Періодична система хімічних елементів
Періодична система хімічних елементів