Содержание
- 2. Оксид кальция является веществом в виде кристаллов белого цвета. Он также носит название негашеной извести, окиси
- 3. Природные соединения кальция (мел, мрамор, известняк, гипс) и продукты их простейшей переработки (известь) были известны людям
- 4. 1. Внешний вид: кристаллическое соединение белого цвета. Кристаллизуется по типу хлорида натрия (NaCl) в кубической кристаллической
- 5. Оксид кальция (формула CaO) – это основной оксид. Поэтому он может: – растворяться в воде (H2O)
- 6. В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция) В промышленности оксид кальция получают термическим
- 7. 1. Основные объемы рассматриваемого нами вещества используются при производстве силикатного кирпича в строительстве. Раньше негашеную известь
- 8. 2. В качестве огнеупорного материала оксид кальция подходит как недорогой и доступный материал. Плавленый кальциевый оксид
- 9. Оксид кальция используется и с целью нейтрализации кислых сред, например, во время сброса сточных вод в
- 10. Вред оксида кальция Саму по себе добавку можно считать безвредной, поскольку она не сможет вызвать неблагоприятных
- 12. Скачать презентацию









 Природные источники углеводородов
Природные источники углеводородов 5-я группа элементов
5-я группа элементов Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Аминокислоты. Физические свойства. Химические свойства
Аминокислоты. Физические свойства. Химические свойства Простые эфиры
Простые эфиры Генетическая связь между классами неорганических веществ. 8 класс
Генетическая связь между классами неорганических веществ. 8 класс Ионные уравнения
Ионные уравнения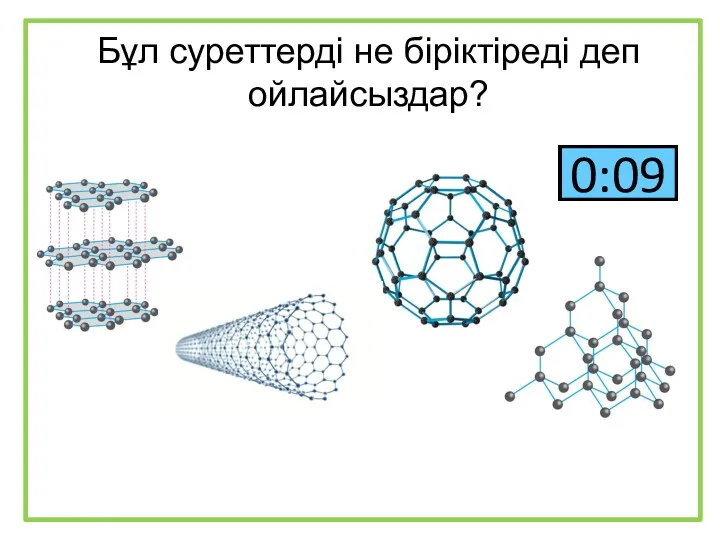 Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар?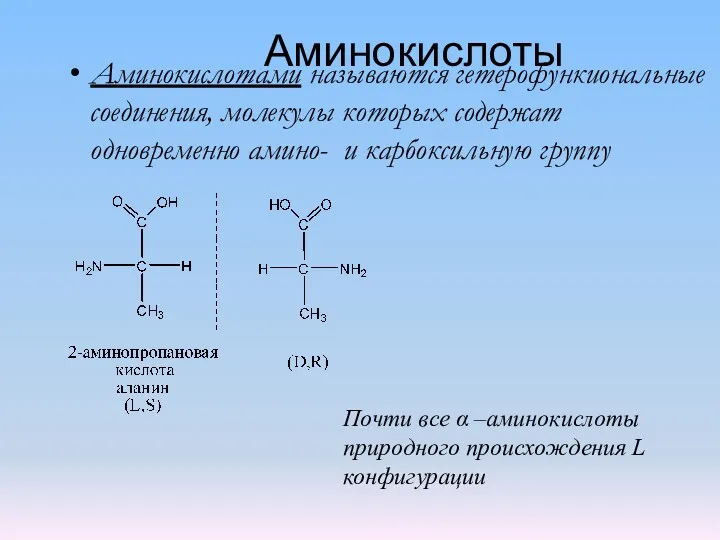 Аминокислоты 1
Аминокислоты 1 Жескость воды
Жескость воды Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома Чистые вещества и смеси
Чистые вещества и смеси Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов
Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов Масса и формулы (8 класс)
Масса и формулы (8 класс) Гетероциклды қосылыстар. Алкалоидтар
Гетероциклды қосылыстар. Алкалоидтар Окисление и восстановление
Окисление и восстановление Химическая промышленность. География. 9 класс
Химическая промышленность. География. 9 класс Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Реакции ионного обмена
Реакции ионного обмена Гидролиз. Классификация солей
Гидролиз. Классификация солей Органическая химия. Ацетилен
Органическая химия. Ацетилен Спирты
Спирты Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Попутные нефтяные газы
Попутные нефтяные газы