Содержание
- 2. Оксиды азота: Степени окисления N в оксидах: +1, +2, +3, +4, +5. N2O, NO - бесцветные
- 3. Растворение золота в царской водке: Au + HNO3 + 3HCl ? AuCl3 + NO + 2H2O
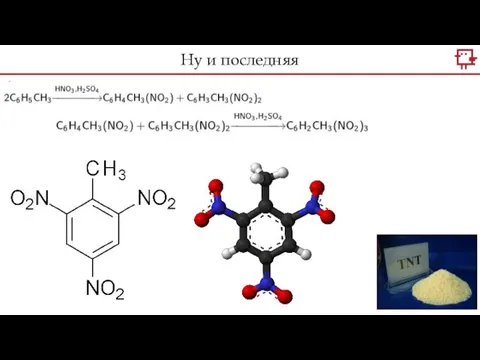
- 4. Ну и последняя
- 5. Апатит Ca10(PO4)6(OH,F,Cl) Апатитовая руда Коллекционный апатит
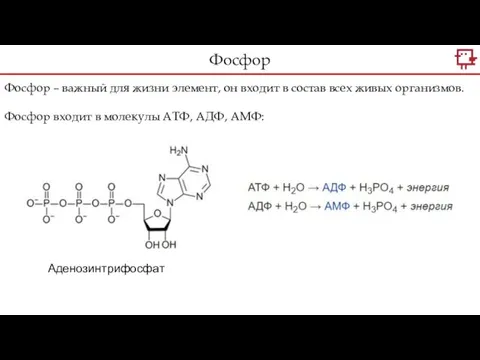
- 6. Фосфор – важный для жизни элемент, он входит в состав всех живых организмов. Имеет множество аллотропных
- 7. Фосфор – элемент 5й группы. Он имеет 3 электронных уровня и 5 электронов на внешнем уровне.
- 8. Фосфор – важный для жизни элемент, он входит в состав всех живых организмов. Фосфор входит в
- 9. Для белого фосфора характерна повышенная химическая активность, при комнатной температуре: Р4 + 5О2 ? P4O10 (ангидрид
- 10. Фосфор реагирует с металлами, образуя фосфиды: 6Mg + P4 ? 2Mg3P2 Mg3P2 + 6H2O ? 3Mg(OH)2
- 11. Водородное соединение фосфора – фосфин PH3. Оно менее устойчивое, нежели аммиак и является чрезвычайно ядовитым газом.
- 12. Галогениды фосфора. Они широко используются в органической химии, как хлорирующие реагенты. PCl3 + 3H2O ? H3PO4
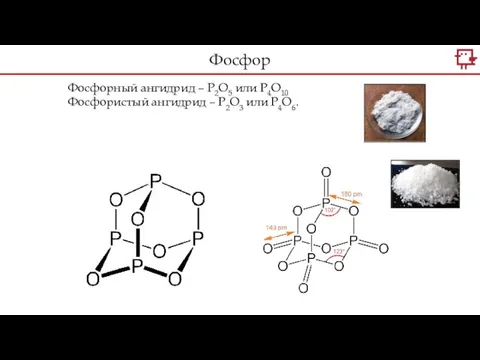
- 13. Фосфорный ангидрид – P2O5 или P4O10 Фосфористый ангидрид – P2O3 или P4O6. Фосфор
- 14. Фосфорный ангидрид – P2O5 или P4O10 Фосфористый ангидрид – P2O3 или P4O6. P4O6 + 6H2O ?
- 15. Ортофосфорная кислота. Получают её реакции оксида фосфора с водой при нагревании… Или взаимодействием ортофосфата кальция (есть
- 16. Ортофосфорная кислота. Получают её реакции оксида фосфора с водой при нагревании… P4O10 + H2O ? H3PO4
- 17. Ортофосфорная кислота. H3PO4. Физические свойства. Ортофосфорная кислота – твёрдое вещество, бесцветна, хорошо растворимое в воде. Применение,
- 18. Ортофосфорная кислота. H3PO4. Ортофосфорная кислота средней силы. Имеет трёхступенчатую диссоциацию. Фосфор
- 19. Ортофосфорная кислота. H3PO4. С металлами до водорода в ряду электродных потенциалов: 3Mg + 2H3PO4 ? Mg3(PO4)2
- 20. Ортофосфорная кислота. H3PO4. Качественная реакция (выпадает желтый осадок): H3PO4 + 3AgNO3 ?Ag3PO4 + 3HNO3 Фосфор
- 21. В состав растений входит около 70 элементов. Некоторые из них имеют низкие концентрации, другие же требуются
- 23. Скачать презентацию

















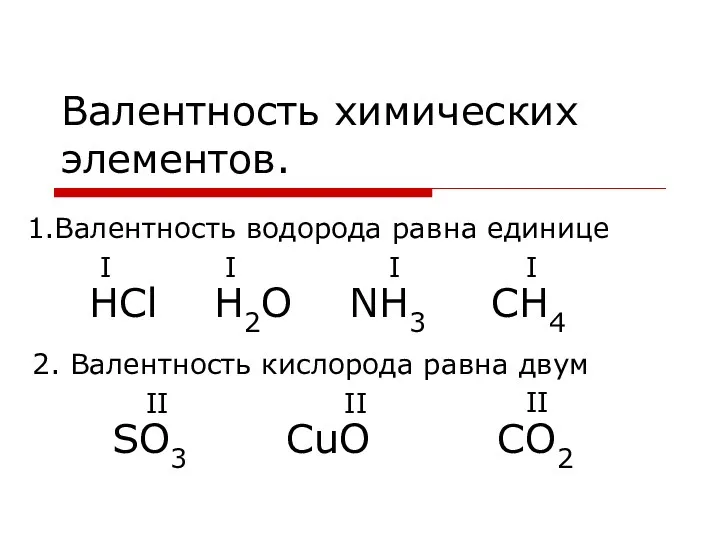 Валентность химических элементов
Валентность химических элементов Азотные удобрения
Азотные удобрения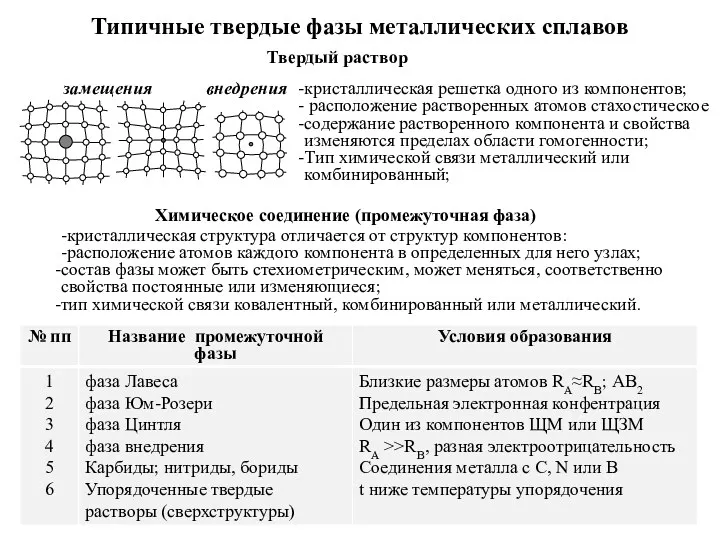 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Природные и синтетические полимеры
Природные и синтетические полимеры Тема 10- Гетроциклические соединения
Тема 10- Гетроциклические соединения Хинолин. Строение хинолина
Хинолин. Строение хинолина Дисперсные системы
Дисперсные системы Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией О каком веществе идёт речь?
О каком веществе идёт речь? Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Көміртек
Көміртек Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Ауыр металлдар
Ауыр металлдар Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Карбоновые кислоты
Карбоновые кислоты Растворение. Растворы.
Растворение. Растворы. Алкадиены
Алкадиены Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Uses of chlorine and its compounds
Uses of chlorine and its compounds Удивительное вещество - вода
Удивительное вещество - вода Періодична система
Періодична система Ионная химическая связь
Ионная химическая связь Organic molecules
Organic molecules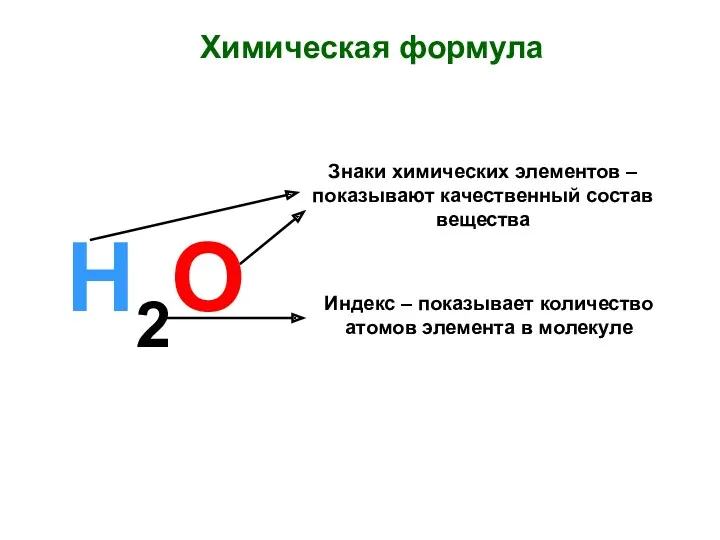 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Материалы и изделия на основе полимеров. Лекция 16
Материалы и изделия на основе полимеров. Лекция 16 Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі