Содержание
- 2. 3Fe + 2O2 = Fe3O4 Fe2O3 + 3H2 = 2Fe + 3H2O
- 3. Окисление - добавление кислорода 3Fe + 2O2 = Fe3O4 Восстановление – потеря атомов кислорода Fe2O3 +
- 4. Тема урока: «Окисление и восстановление» В ходе урока должны: раскрыть смысл «окислитель», «восстановитель», «окисление», «восстановление»; определить
- 5. CuO + H2 = Cu + H2O окисление одного вещества (водорода) сопровождается восстановлением другого (меди). Вместо
- 6. ОКИСЛИТЕЛЬ Получает электроны Окисляет Восстанавливается Понижает свою степень окисления ВОССТАНОВИТЕЛЬ Отдает электроны Восстанавливает Окисляется Повышает свою
- 7. Вспомните! - Что такое степень окисления? - Какие правила определения степени окисления атомов химических элементов вы
- 8. Правила вычисления степени окисления (СО) элементов: 1. СО свободных атомов и атомов в составе простых веществ
- 9. Степень окисления атома – условный заряд атома, вычисленный из предположения, что все связи атома ионные Пользуясь
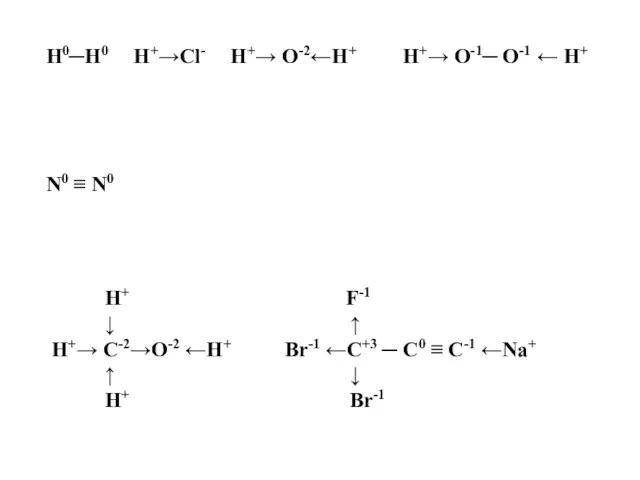
- 10. H0─H0 H+→Cl- H+→ O-2←H+ H+→ O-1─ O-1 ← H+ N0 ≡ N0 H+ F-1 ↓ ↑
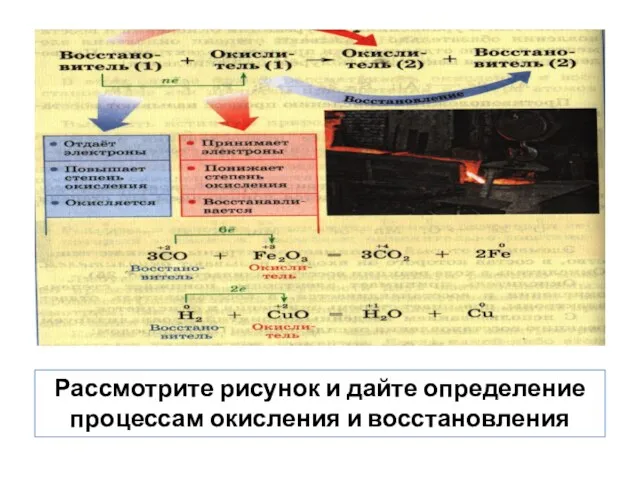
- 11. Рассмотрите рисунок и дайте определение процессам окисления и восстановления
- 12. Окисление – процесс отдачи электронов, сопровождается увеличением степени окисления Восстановление – процесс взятия электронов, сопровождается уменьшением
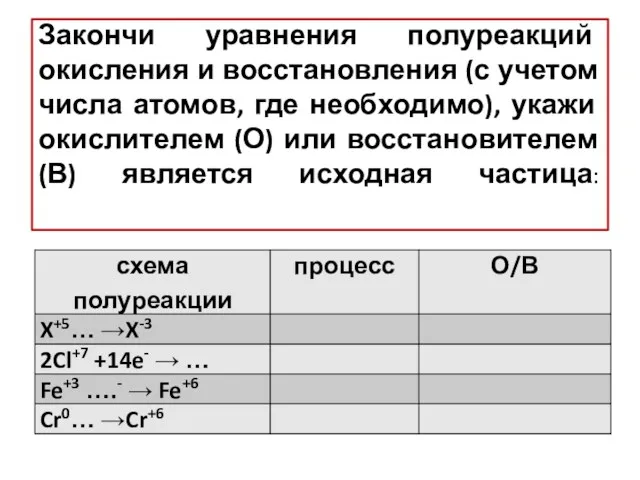
- 13. Закончи уравнения полуреакций окисления и восстановления (с учетом числа атомов, где необходимо), укажи окислителем (О) или
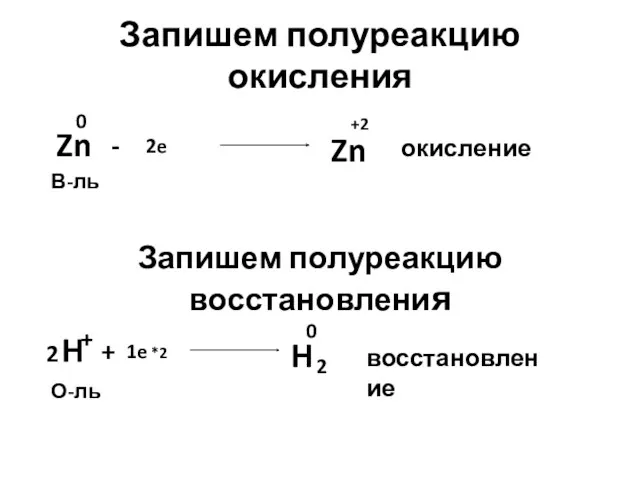
- 14. Задание: Определите окислитель и восстановитель в реакции цинка с соляной кислотой, напишите уравнения полуреакций окисления и
- 15. Запишем полуреакцию окисления Zn 0 Zn +2 - 2e В-ль окисление Запишем полуреакцию восстановления H +
- 16. задание Определите окислитель и восстановитель в реакции между сероводородом и бромом с образованием бромоводорода и серы.
- 17. Домашнее задание Вариант 1 Расставьте степени окисления в формулах следующих веществ: NO2, Fe, Fe2O3, Fe(OH)3, SO3,
- 18. Дополните схемы полуреакций, указав число отданных и принятых электронов, укажите процесс
- 20. Скачать презентацию













 Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Методы анализа. Классификация методов анализа
Методы анализа. Классификация методов анализа Physical and chemical properties of oil
Physical and chemical properties of oil Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас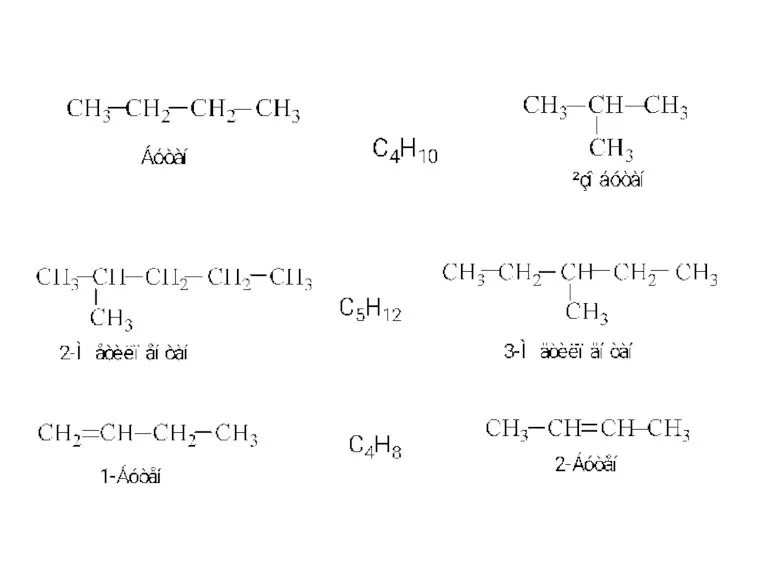 Структурна ізомерія
Структурна ізомерія Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Алкени і алкіни
Алкени і алкіни алканы 170
алканы 170 Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Спирты
Спирты Терминология и основные понятия в химии высокомолекулярных соеденений
Терминология и основные понятия в химии высокомолекулярных соеденений Основные постулаты квантовой механики
Основные постулаты квантовой механики Магний (Mg)
Магний (Mg) Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Альдегиды и кетоны
Альдегиды и кетоны Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Строение атома
Строение атома Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии Гомологический ряд алканов. Изомерия и номенклатура
Гомологический ряд алканов. Изомерия и номенклатура Активационный анализ
Активационный анализ Природный газ и нефть
Природный газ и нефть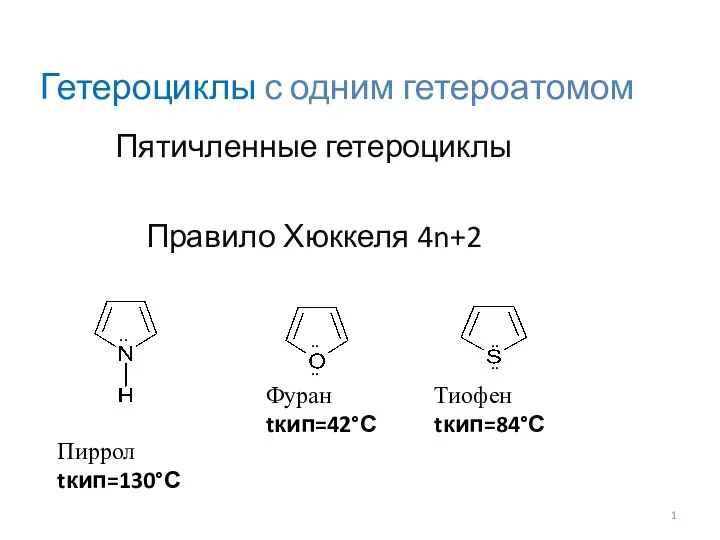 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Массовая доля вещества в растворе
Массовая доля вещества в растворе Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Комплексті қосылыстар
Комплексті қосылыстар Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание