Содержание
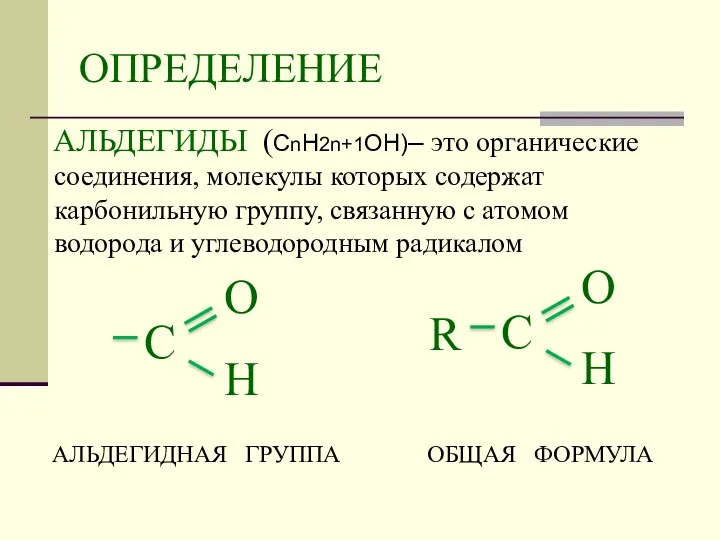
- 2. ОПРЕДЕЛЕНИЕ АЛЬДЕГИДЫ (СnH2n+1OН)– это органические соединения, молекулы которых содержат карбонильную группу, связанную с атомом водорода и
- 3. КЕТОНЫ КЕТОНЫ – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами R1
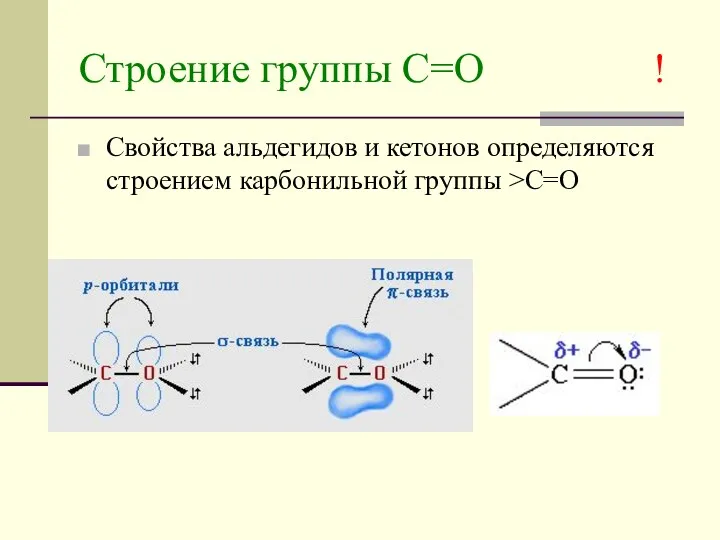
- 4. Строение группы С=О ! Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O
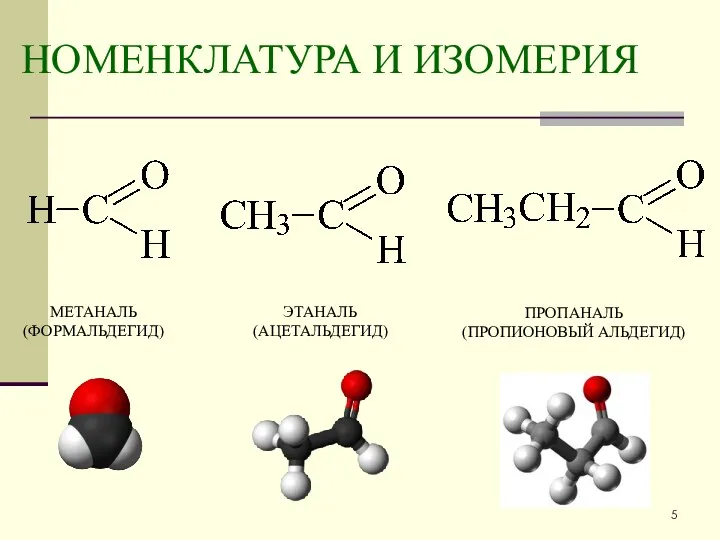
- 5. НОМЕНКЛАТУРА И ИЗОМЕРИЯ МЕТАНАЛЬ (ФОРМАЛЬДЕГИД) ЭТАНАЛЬ (АЦЕТАЛЬДЕГИД) ПРОПАНАЛЬ (ПРОПИОНОВЫЙ АЛЬДЕГИД)
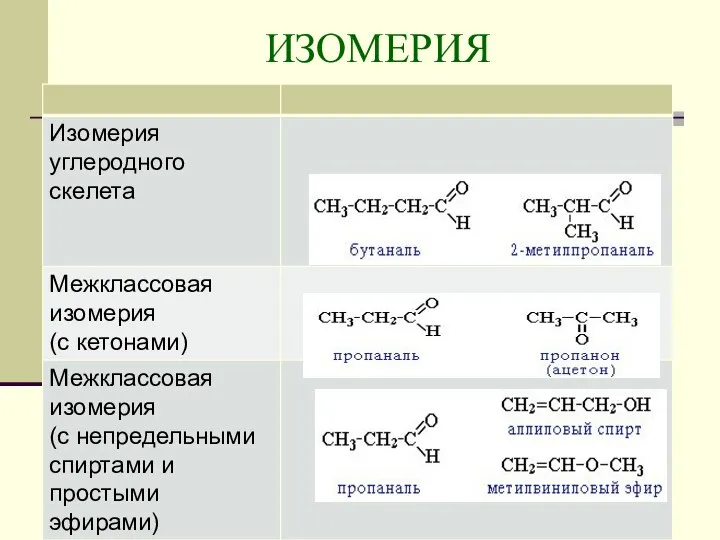
- 6. ИЗОМЕРИЯ
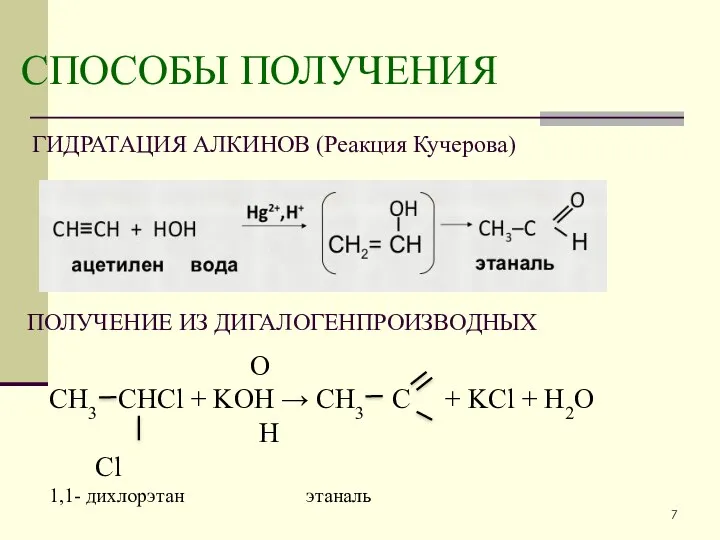
- 7. СПОСОБЫ ПОЛУЧЕНИЯ ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова) ПОЛУЧЕНИЕ ИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ O СН3 СНСl + KOH → СН3
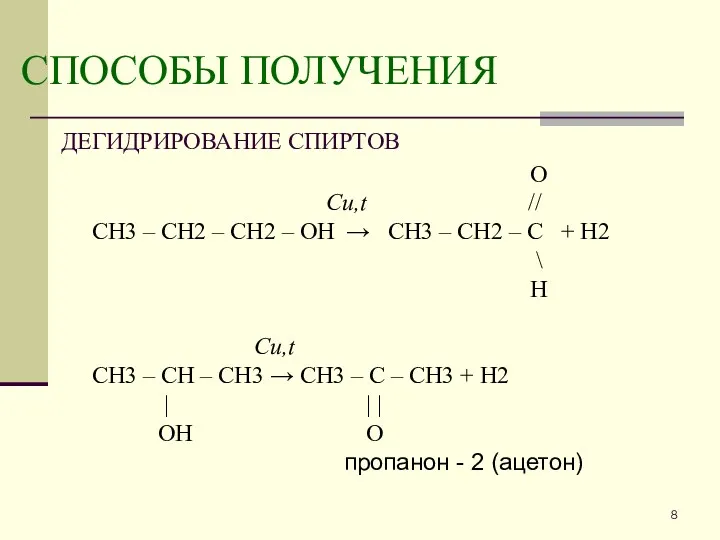
- 8. СПОСОБЫ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ СПИРТОВ O Cu,t // CH3 – CH2 – CH2 – OH → СH3
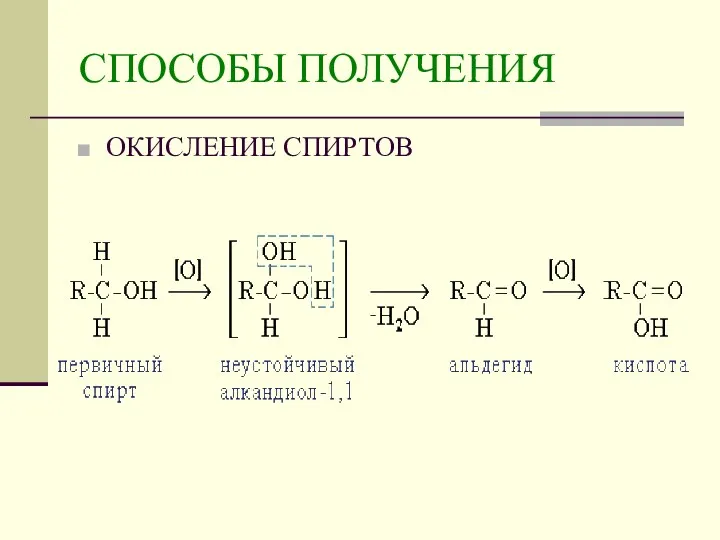
- 9. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ СПИРТОВ
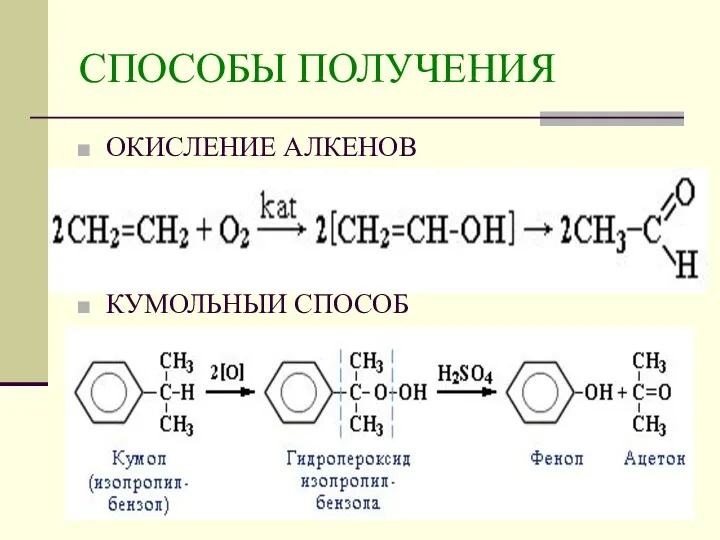
- 10. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ АЛКЕНОВ КУМОЛЬНЫЙ СПОСОБ
- 12. ХИМИЧЕСКИЕ СВОЙСТВА ! РЕАКЦИИ ОКИСЛЕНИЯ Реакция серебряного зеркала О О СН3 С + 2[Ag(NH3)2]OH → СН3
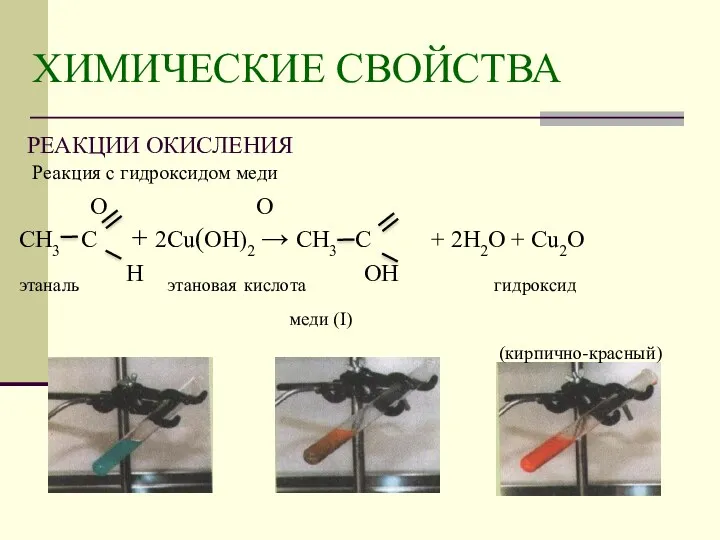
- 13. Реакция с гидроксидом меди О О СН3 С + 2Cu(OH)2 → СН3 С + 2H2O +
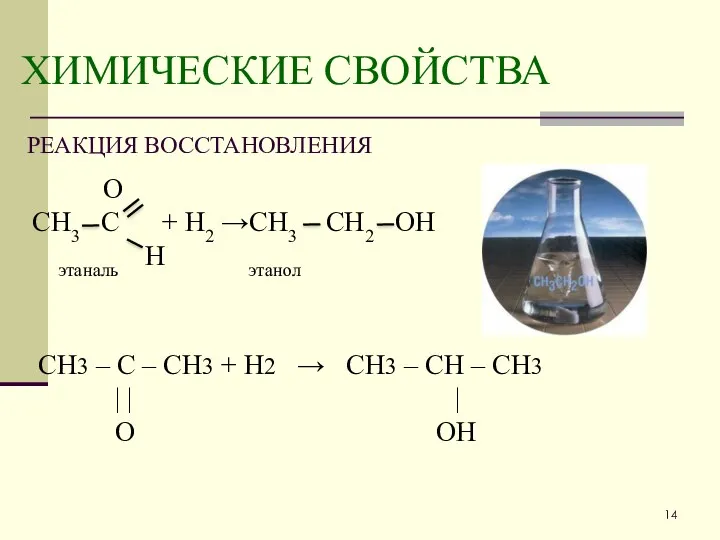
- 14. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИЯ ВОССТАНОВЛЕНИЯ О СН3 С + Н2 →СН3 СН2 ОН этаналь Н этанол CH3
- 15. НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ Процесс протекает ступенчато и начинается с медленной атаки нуклеофила (:Nu−) по карбо-нильному углероду; образовавшийся
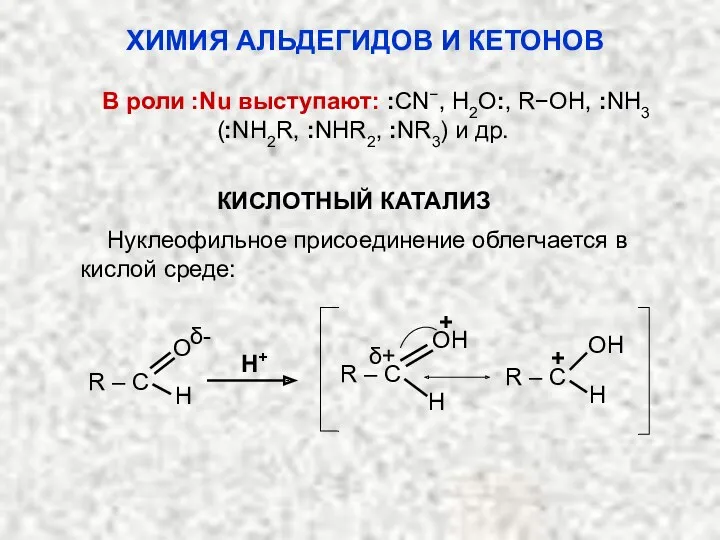
- 16. В роли :Nu выступают: :CN−, H2O:, R−OH, :NH3 (:NH2R, :NHR2, :NR3) и др. КИСЛОТНЫЙ КАТАЛИЗ Нуклеофильное
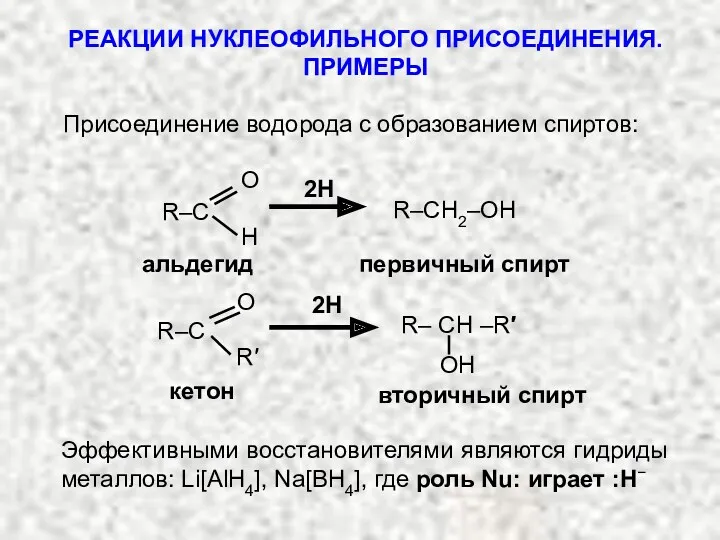
- 17. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ. ПРИМЕРЫ Присоединение водорода с образованием спиртов: R–CH2–OH альдегид первичный спирт 2Н R–C H
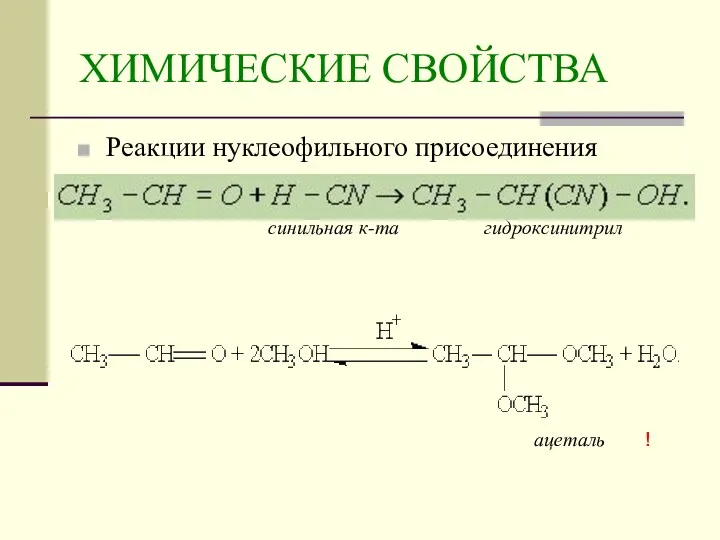
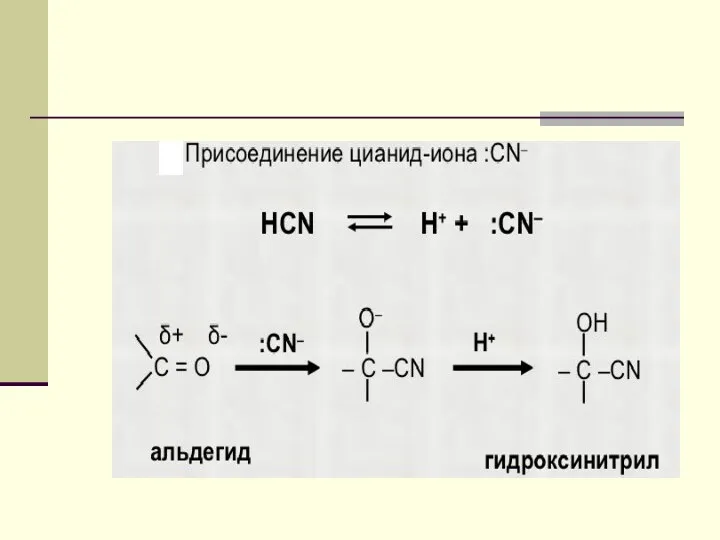
- 18. ХИМИЧЕСКИЕ СВОЙСТВА Реакции нуклеофильного присоединения синильная к-та гидроксинитрил ацеталь !
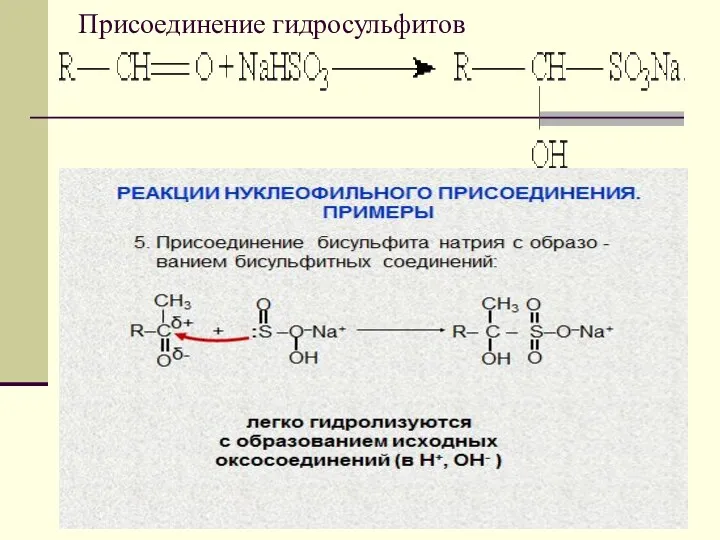
- 19. Присоединение гидросульфитов
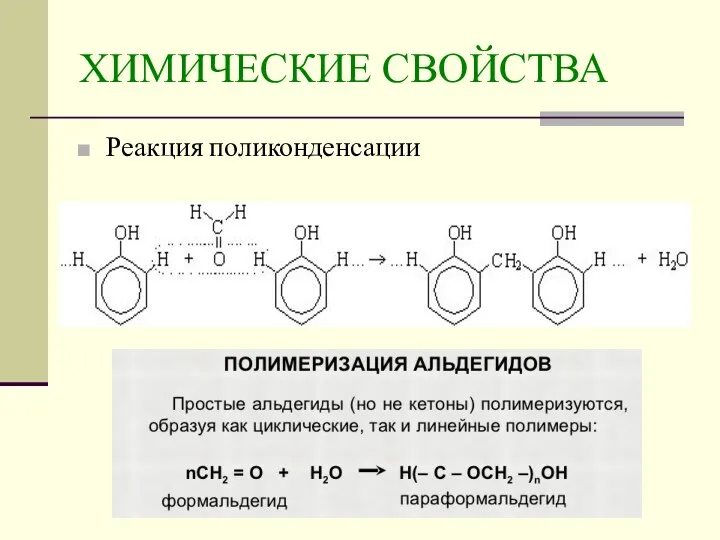
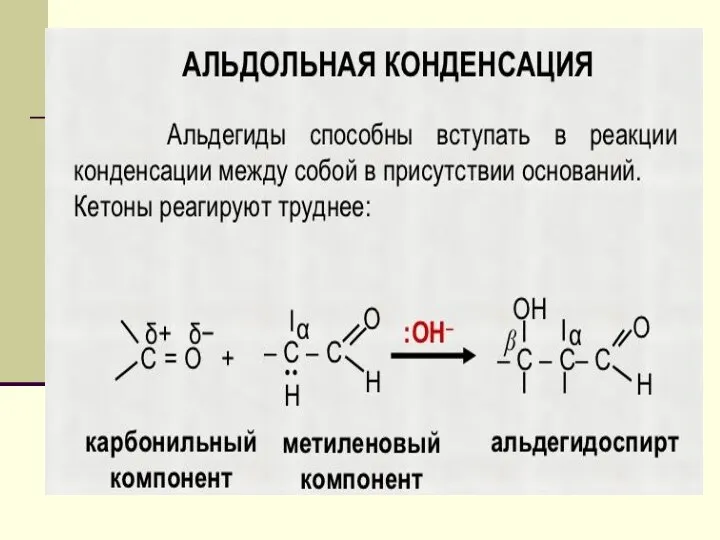
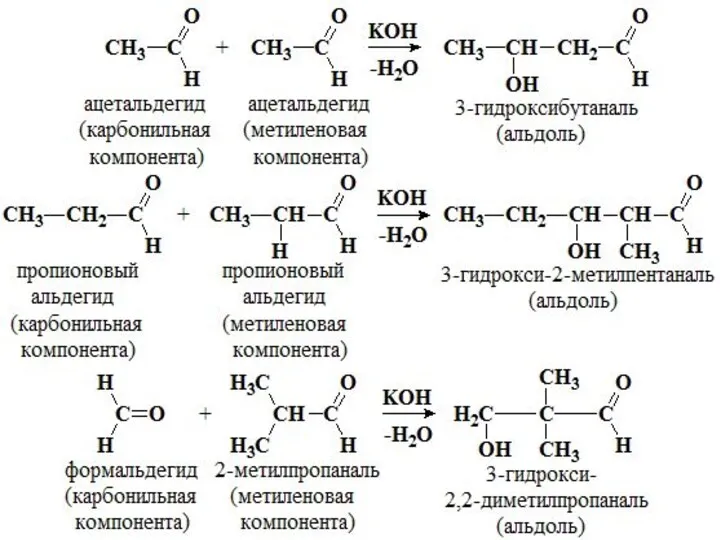
- 21. ХИМИЧЕСКИЕ СВОЙСТВА Реакция поликонденсации
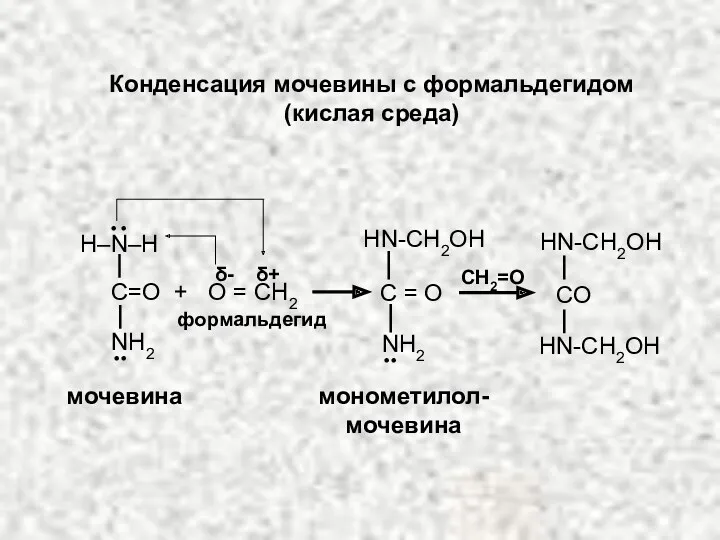
- 22. Конденсация мочевины с формальдегидом (кислая среда) CH2=O монометилол- мочевина HN-CH2OH HN-CH2OH HN-CH2OH CO NH2 .. мочевина
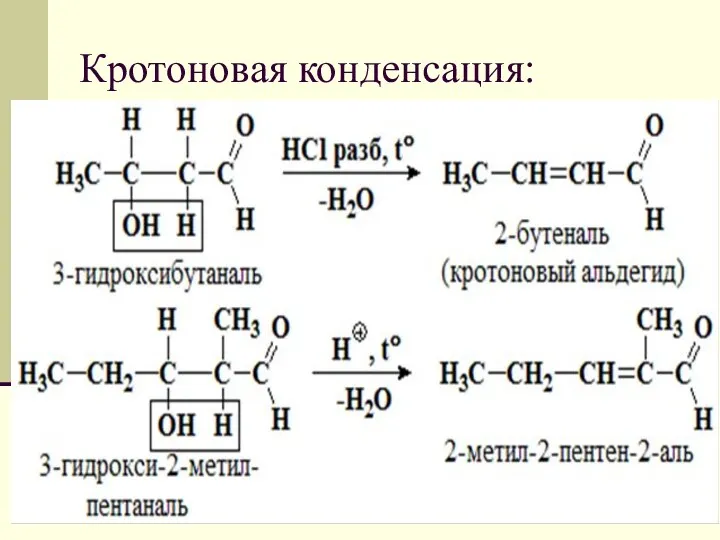
- 25. Кротоновая конденсация:
- 26. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПАРФЮМЕРИЯ Альдегид анисовый, обепин – жидкость с приятным запахом мимозы Альдегид дециловый, деканаль –
- 27. АЛЬДЕГИДЫ В ПРИРОДЕ
- 28. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПОЛИМЕРНЫЕ МАТЕРИАЛЫ Фенолформальдегидные смолы
- 29. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПРОИЗВОДСТВО ВЕЩЕСТВ Уксусная кислота Этилацетат Формалин
- 30. Гомологический ряд кетонов
- 31. Физические свойства Низшие представители – жидкость, растворимые в воде со своеобразным запахом. Высшие - твердые вещества,
- 32. Изомерия кетонов
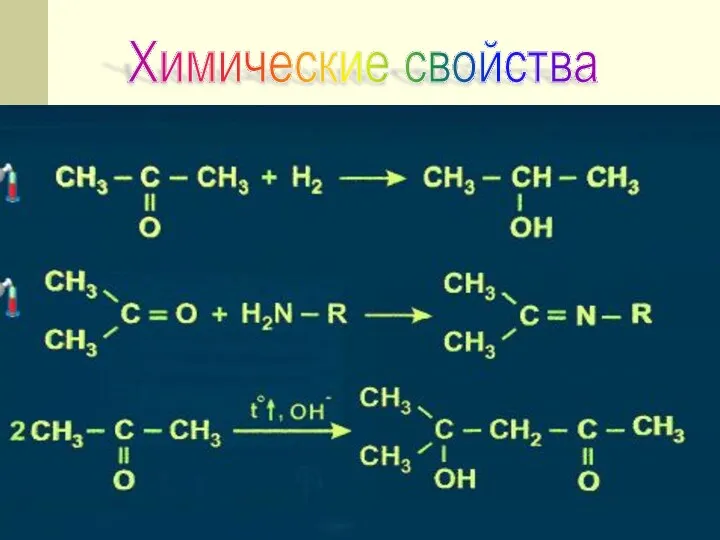
- 33. Химические свойства
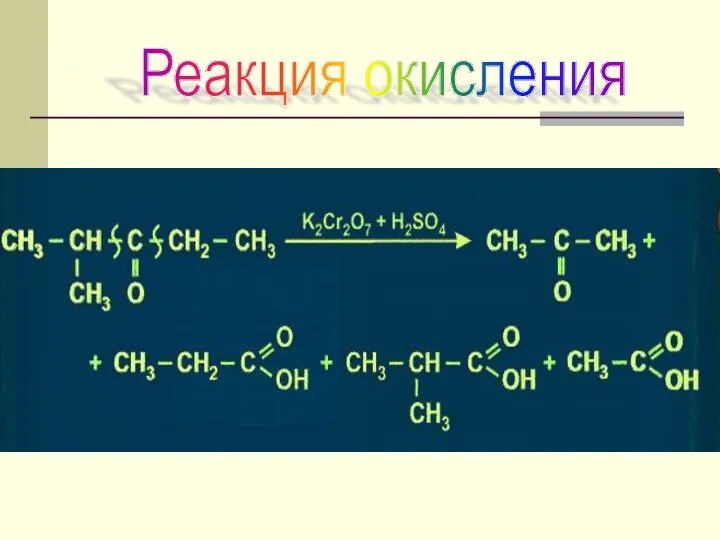
- 34. Реакция окисления
- 35. Применение Растворители в лабораторной практике Пищевой промышленности Фармацевтической промышленности Производство искусственного шелка Бездымного пороха Химической промышленности
- 37. Скачать презентацию












 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями