Содержание
- 2. 1. Сущность методов осаждения Метод осаждения объединяет титриметрические определения, при которых в результате реакции между определяемым
- 3. Требования к реакциям в методах осаждения: 1) осадок должен быть практически нерастворимым; 2) осадок должен выпадать
- 4. Точка эквивалентности наступает тогда, когда исследуемое вещество полностью переходит в осадок. Конец, реакции определяется с помощью
- 5. Аргентометрический метод анализа основан на применении в качестве рабочего раствора стандартного раствора нитрата серебра : Аg+
- 6. В зависимости от индикатора, рабочего раствора и условий титрования различают: метод Мора метод Фольгарда метод Фаянса
- 7. Метод Мора (прямая аргентометрия) - наиболее простой из всех методов аргентометрии и в то же время
- 8. Метод Мора Основной реакцией титриметрической реакцией в аргентометрии явлеется: Наl- + Аg+ = АgНаl↓
- 9. Методом Мора определяют: Ag+ + Cl- = AgCl↓ Ag+ + Br- = AgBr↓
- 10. Иодиды этим методом не определяют, так как выпадающий в осадок йодид серебра Agl сильно адсорбирует К2Сr04,
- 11. Индикатором является раствор хромата калия К2Сr04, дающий с ионами серебра красно-кирпичный осадок хромата серебра Ag2Cr04
- 12. В точке эквивалентности: K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3
- 13. Стандартизация 0,1 М раствора АgNО3 проводится по 0,1 М раствору натрия хлорида
- 14. Растворимость AgCl (AgBr) значительно меньше, чем растворимость Ag2Cr04, поэтому, если постепенно добавлять раствор AgN03 к раствору,
- 15. После того как, ионы СI – или Br -) будут практически полностью выделены в виде AgCl
- 16. Формула расчета массовой доли бромидов и хлоридов: fэкв(NaBr)=1
- 17. Условия проведения метода: среда: нейтральная
- 18. 2. Метод Фаянса (прямая аргентометрия) Титрант – 0,1М AgNO3, индикаторы – эозинат натрия (для Br–, I–),
- 19. В основе метода лежит реакция NaI + AgNO3 → AgI↓ + NaNO3. Эозинат натрия в точке
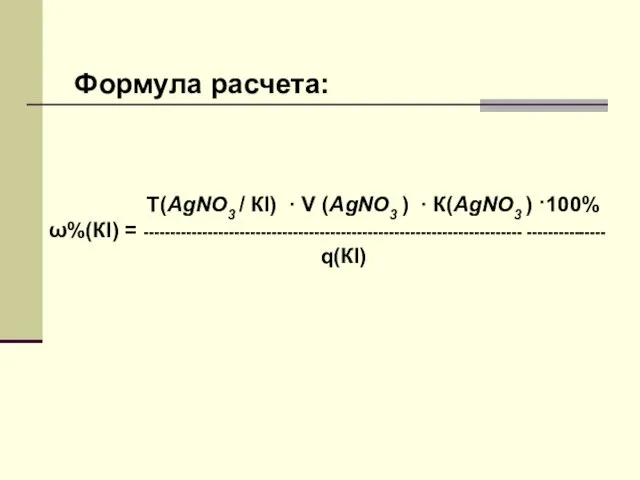
- 20. Т(AgNO3 / КI) · V (AgNO3 ) · К(AgNO3 ) ·100% ω%(КI) = ----------------------------------------------------------------------- --------------- q(КI)
- 21. 3. Метод Фольгарда (обратная аргентометрия, роданометрия) Рабочим раствором является раствор роданида калия 0,1М KSCN или аммония
- 22. Сущность метода Титранты – 1) 0,1М AgNO3, 2) 0,1М NH4SCN или КSCN; Индикаторы – NH4Fe(SO4)2 железоаммонийные
- 23. Определение хлоридов и бромидов по методу Фольгарда сводится к следующему К определяемому раствору прибавляют из пипетки
- 24. Химические реакции в основе метода: KBr + AgNO3 → AgBr↓ + KNO3+ AgNO3 (избыток) Желтоватый осадок
- 25. Преимущества перед другими методами 1. Сильнокислая среда, 2. Не мешают другие ионы; Недостатки: 1. Меньшая точность
- 26. Стандартизация 0,1 М раствора NH4SCN или КSCN Проводится по 0,1 М раствору AgNO3
- 28. Скачать презентацию
























 Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення
Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Физические свойства минералов
Физические свойства минералов Химия элементов VIA группы
Химия элементов VIA группы Физические и химические явления
Физические и химические явления Методы контроля и анализа веществ
Методы контроля и анализа веществ Кремний, его физические и химические свойства
Кремний, его физические и химические свойства Синтез и химические модификации индиго
Синтез и химические модификации индиго Инертные газы
Инертные газы Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Признаки химических реакций
Признаки химических реакций Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Повторение. Ионные уравнения реакции
Повторение. Ионные уравнения реакции Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Техника безопасности на уроках химии
Техника безопасности на уроках химии Кислоты. Состав кислот
Кислоты. Состав кислот Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Химическая промышленность
Химическая промышленность Морские льды. Их классификация и закономерности движения
Морские льды. Их классификация и закономерности движения Начала органической химии
Начала органической химии Электроотрицательность химических элементов
Электроотрицательность химических элементов Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Алюминий
Алюминий Органическая химия
Органическая химия