Слайд 2

Если вещество выпадает в осадок, то рядом с его формулой ставят
стрелку, направленную вниз ( ↓ ); а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх ( ↑ ).
Слайд 3

Формулы слабых электролитов ( в т.ч. H2O ), нерастворимых и газообразных
веществ записываются в молекулярной форме
Слайд 4

Реакции ионного обмена в растворах электролитов практически осуществимы (протекают до конца)
только в тех случаях, когда в результате реакции образуется осадок, газ или малодиссоциирующее вещество.
Слайд 5

Вспомним методику образования ионных уравнений
1) 2KOH + H2SO4 = K2SO4 +
2H2O
Записываем уравнение реакции, уравниваем обе части уравнения,расставляем степени окисления
2) 2K+ + 2OH- + 2H+ + SO42- = 2K+ + SO42-
+2H2O
Расписываем уравнение реакции по ионам, не забываем указывать перед ионом количество молекул.
Слайд 6

3) 2K+ + 2OH- + 2H+ + SO42- = 2K+ +
SO42-
+2H2O
2H+ + 2OH- = 2H2O
Сокращаем одинаковые ионы с левой и правой части уравнения, записываем оставшиеся ионы в сокращенное ионное уравнение.
Слайд 7

Итог:
2KOH + H2SO4 = K2SO4 + 2H2O молекулярное уравнение
2K+ +2OH- +2H+
+SO42- = 2K+ + SO42- + 2H2O ионное уравнение
H+ + OH- = H2O сокращенное ионное уравнение
Слайд 8

Молекулярное уравнение
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
Ионный вид
2H+
+ SO42- + Ba2+ + 2OH- = =BaSO4↓ + 2H2O
Сокращенное ионное уравнение
2H+2OH=2H2O







 Цветные металлы и сплавы
Цветные металлы и сплавы Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Гидролиз неорганических солей
Гидролиз неорганических солей Химия в быту
Химия в быту Предмет органической химии
Предмет органической химии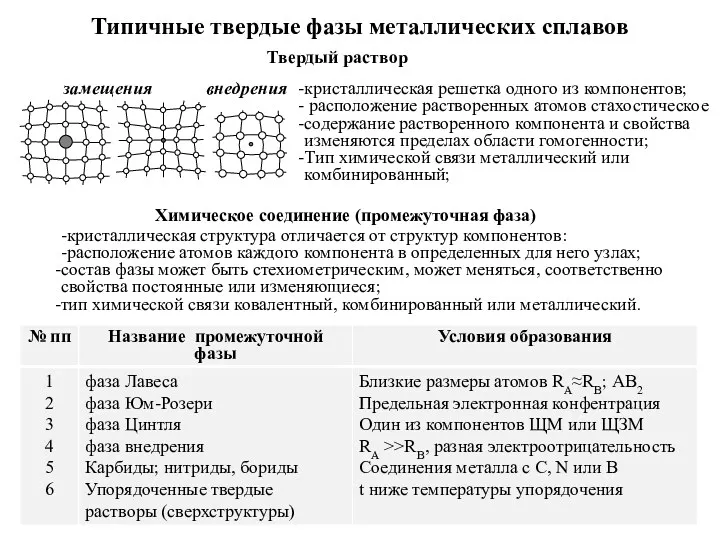 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Топливный элемент
Топливный элемент kremniy
kremniy Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Простые вещества металлы
Простые вещества металлы Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Why use plastics
Why use plastics Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде 20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii
20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Молярный объём газов
Молярный объём газов 20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx
20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx 20230306_oni_byli_pervymi
20230306_oni_byli_pervymi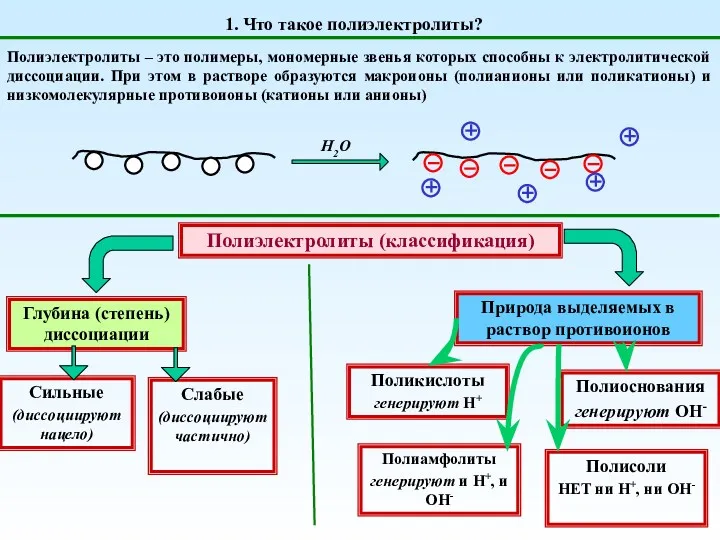 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Классификация химических реакций
Классификация химических реакций Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Удивительные свойства воды
Удивительные свойства воды Гель-хроматография. Бумажная хроматография
Гель-хроматография. Бумажная хроматография Гомологический ряд алканов. Изомерия и номенклатура
Гомологический ряд алканов. Изомерия и номенклатура Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива Азот. Строение атома и молекулы
Азот. Строение атома и молекулы Удобрения. 9 класс
Удобрения. 9 класс Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция