Содержание
- 2. Мастер-класс по химии Окислительно-восстановительные реакции в органической химии
- 3. Окислительно – восстановительные реакции - основа производства лекарств, парфюмерии, красителей, стройматериалов, пластмасс, удобрений, кислот, щелочей
- 4. Основной целью мастер-класса является обмен опыта с коллегами. Основной принцип мастер-класса-Я знаю как это делать, и
- 5. ФГОС и проектная деятельность. Показателем качества в контексте модернизации образования является компетентность, которая определяется не через
- 6. Информация о ЕГЭ по химии. Мнения родителей и учащихся. Школьные выпускные экзамены это первая по настоящему
- 7. Тема мастер-класса: « Окислительно-восстановительные реакции в органической химии». Единственный путь, ведущий к знанию - деятельность. Бернард
- 8. ЗАДАЧИ Углубить представления учащихся об ОВР с участием органических веществ; научить прогнозировать состав продуктов ОВР; совершенствовать
- 9. Окислительно-восстановительные реакции (ОВР) - – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в
- 10. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. В этих реакциях число
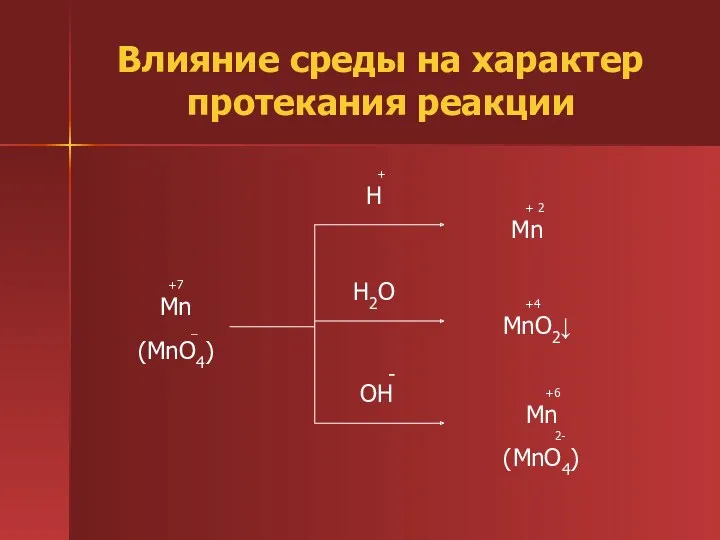
- 11. Влияние среды на характер протекания реакции +7 Mn _ (MnO4) + H H2O - OH +
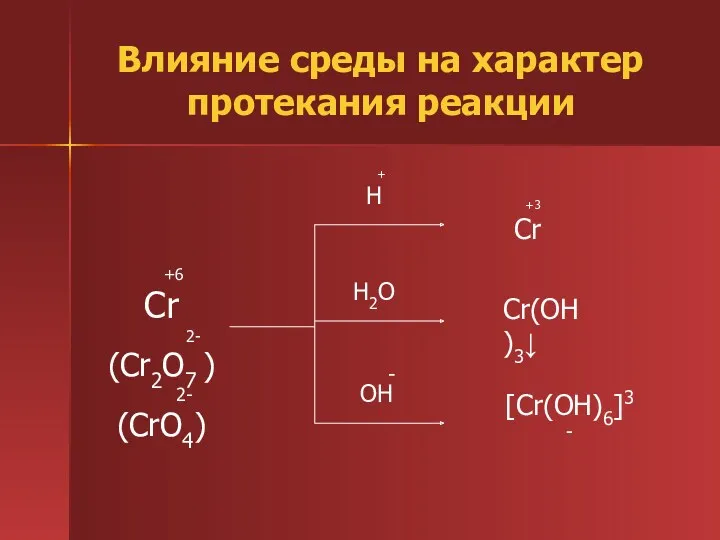
- 12. Влияние среды на характер протекания реакции +6 Cr 2- (Cr2O7 ) 2- (CrO4) + H H2O
- 13. Типичные окислители и восстановители в органической химии Окислители: перманганаты, хроматы (дихроматы),кислород Восстановители:органические соединения
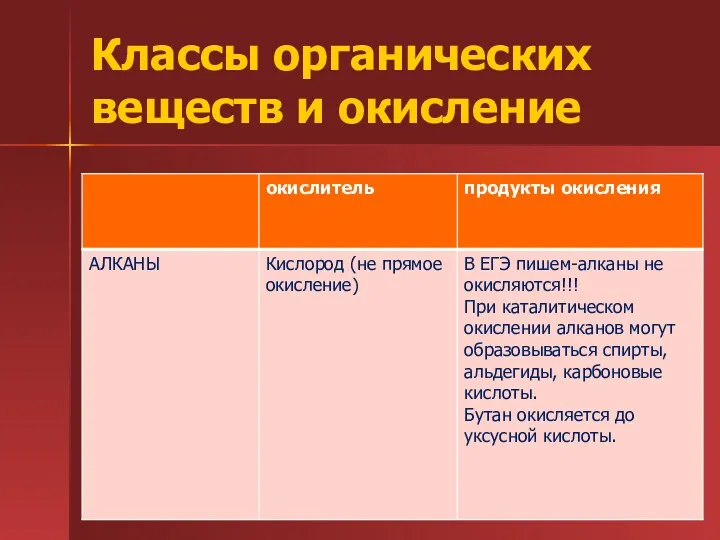
- 14. Алканы→ (Алкены→ Алкадиены)→ Алкины→ Спирты → Альдегиды → Кетоны → Карбоновые кислоты → СО2 Окисляются →
- 15. Классы органических веществ и окисление
- 16. -3 -2 -3 0 +4 -2 СН3–СН2–СН3+ 5О2→ 3СО2+ 4Н2О СН4 +О2→ Н-СОН+H2O СН3-СН(СН3)-СН3 + О2→
- 17. Окисление алкенов в нейтральной среде: 3C2H4 + 2KMnO4 + 4H2O→ 3CH2OH–CH2OH + 2MnO2 + 2KOH Окисление
- 18. Окисление симметричных алкенов(жесткое) 5CH3─CH=CH─CH3+ 8KMnO4+ 12H2SO4→ 10CH3COOH + 8MnSO4+ 4K2SO4+ 12H2O -1 +3 2С -2▪4ē= 2С
- 19. Окисление несимметричных алкенов(жесткое) -2 -1 +7 CH2=CH─CH2─СН3+ 2KMnO4+ 3H2SO4 → +4 +3 +2 СО2+ C2H5COOH +
- 20. Окисление алкенов с образованием альдегидов и кетонов Задание. В каком случае будет образовываться альдегид и кетон?
- 21. Окисление алкенов(окислитель –хромат, среда щелочная)
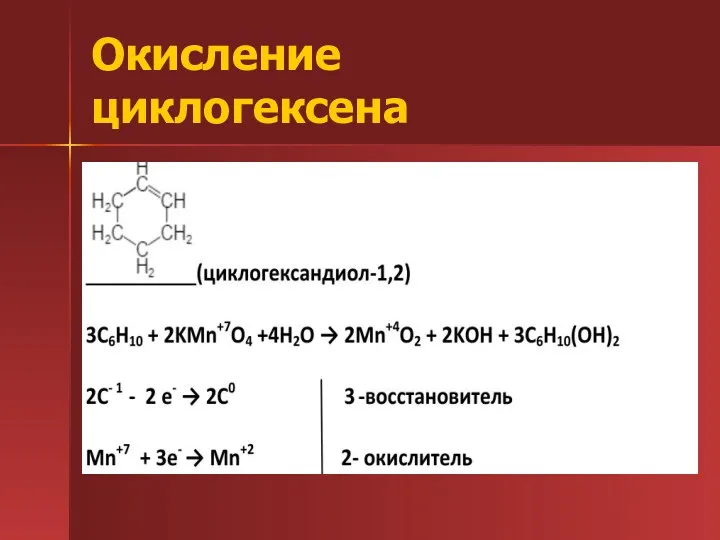
- 22. Окисление циклогексена
- 23. ОКИСЛЕНИЕ АЛКИНОВ Алкины окисляются в более жестких условиях, чем алкены, при окислении разрывается углеродная цепь по
- 24. Окисление алкинов «Мягкое» окисление(для внутренних алкинов) «Жесткое» окисление
- 25. Окисление алкинов. Внимание! Нейтральная и слабощелочная среда Задание1) Окисление ацетилена перманганатом калия в кислой среде. 2)
- 26. Окисление ацетилена (проверка) 1. В нейтральной среде: 3CH≡CH +8KMnO4→3KOOC – COOK +8MnO2 +2КОН +2Н2О 2C-1 –
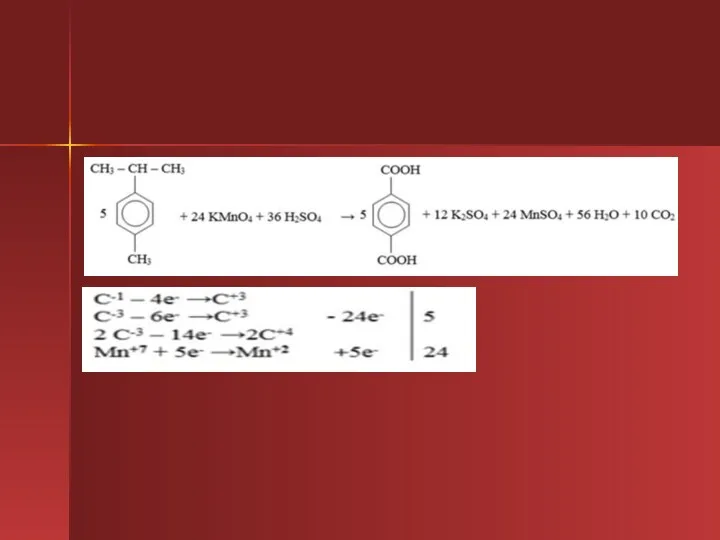
- 27. Бензол не окисляется! Гомологи бензола окисляются раствором перманганата калия Алкильные цепи, соединенные с ароматическими кольцами, окисляются
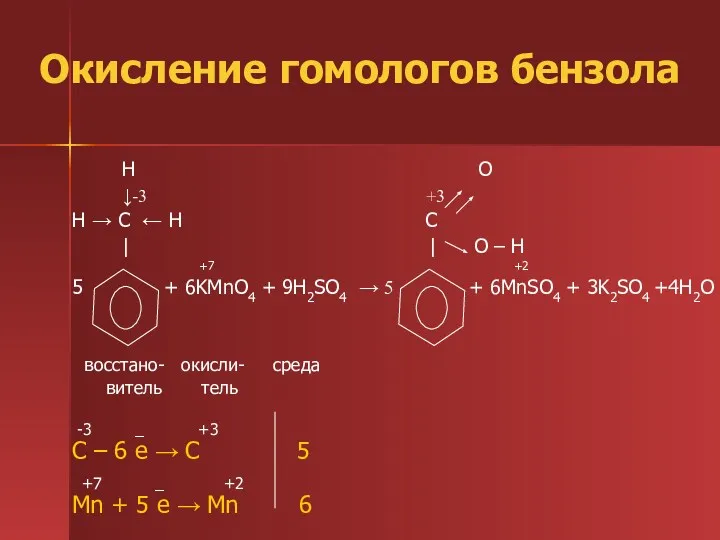
- 28. Окисление гомологов бензола H O ↓-3 +3 H → C ← H C | | O
- 29. Окисление гомологов бензола Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до
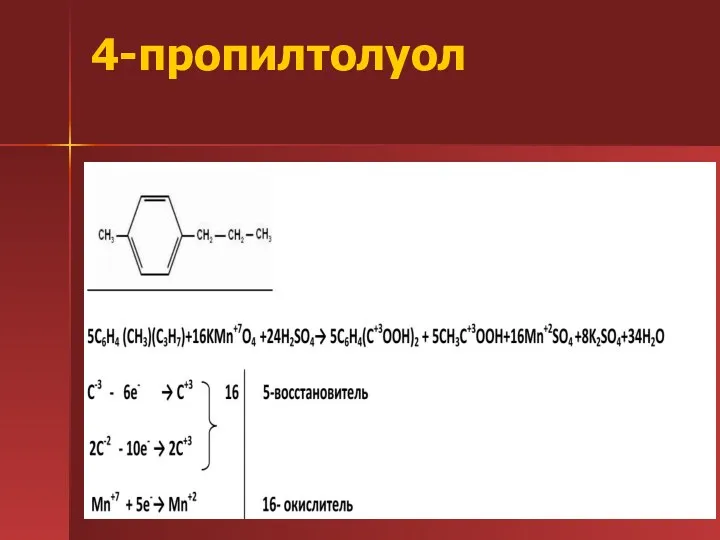
- 31. 4-пропилтолуол
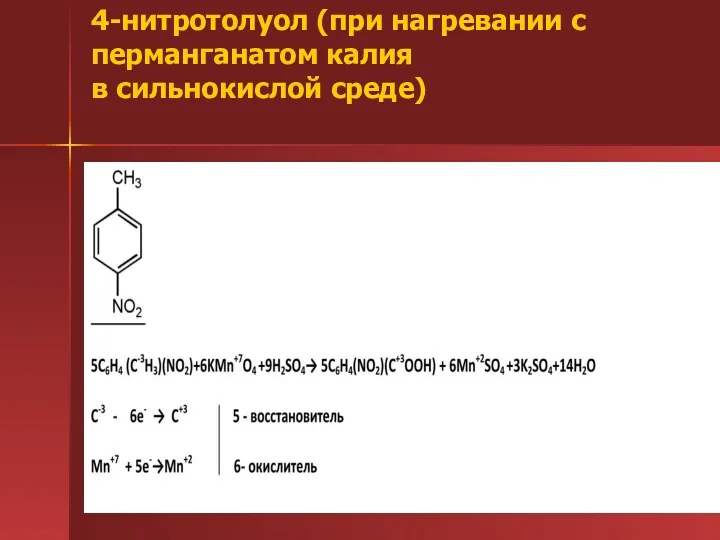
- 32. 4-нитротолуол (при нагревании с перманганатом калия в сильнокислой среде)
- 33. 1,3,5-триметилбензол
- 34. 1,2-диметилбензол (окисление бихроматом калия)
- 35. Окисление стирола В нейтральной среде: 3C6H5-CH =CH2+2 KMnO4+ H2O→ 3C6H5-CH(OH) -CH2(OH)+2MnO2+2KOH В кислой среде: C6H5-CH=CH2 +2KMnO4+3H2SO4→
- 36. Окисление фенилацетилена
- 37. ОКИСЛЕНИЕ СПИРТОВ При окислении первичные спирты легко превращаются в альдегиды, а вторичные — в кетоны. Для
- 38. Кислая среда
- 41. Окисление непредельного спирта в нейтральной среде Окисление ароматического спирта
- 42. Этиленгликоль HOCH2–CH2OH (двухатомный спирт), при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется
- 43. Окисление пропандиола-1,4 Окисление бутен-2-диол-1,4
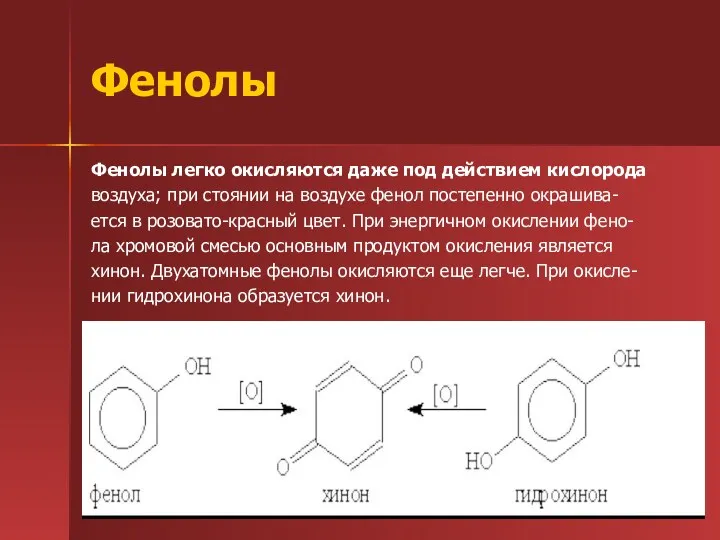
- 44. Фенолы Фенолы легко окисляются даже под действием кислорода воздуха; при стоянии на воздухе фенол постепенно окрашива-
- 45. ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ Альдегиды легко окисляются до карбоновых кислот. Окисле- ние можно проводить без нагревания
- 46. Окисление сильными окислителями при нагревании: Метаналь окисляется хромовой смесью и перманганатом калия в кислой среде до
- 47. Окисление этаналя в кислой среде
- 48. Окисление этаналя в щелочной среде
- 49. Окисление этаналя гидроксидом меди (II). Окисление бензальдегида в кислой среде
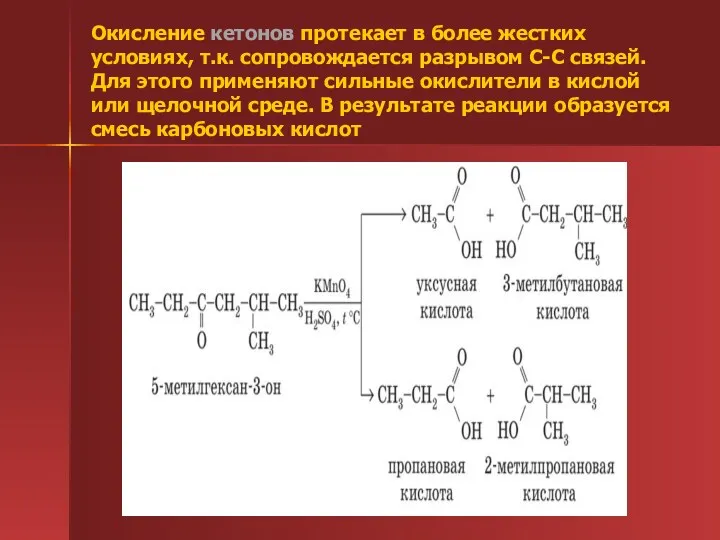
- 50. Окисление кетонов протекает в более жестких условиях, т.к. сопровождается разрывом С-С связей. Для этого применяют сильные
- 51. Окисление карбоновых кислот НСООН + HgCl2 →CO2 + Hg + 2HCl HCOOH+ Cl2 → CO2 +2HCl
- 53. Скачать презентацию







































 Rates of reaction
Rates of reaction Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Ароматические соединения
Ароматические соединения Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Кислоты. Состав, названия и определение кислот
Кислоты. Состав, названия и определение кислот Introduction to Periodic Table
Introduction to Periodic Table Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Етери та естери
Етери та естери Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Азотная кислота
Азотная кислота Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Метал конструкциялық материалдар
Метал конструкциялық материалдар Вуглеводи
Вуглеводи Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ