Содержание
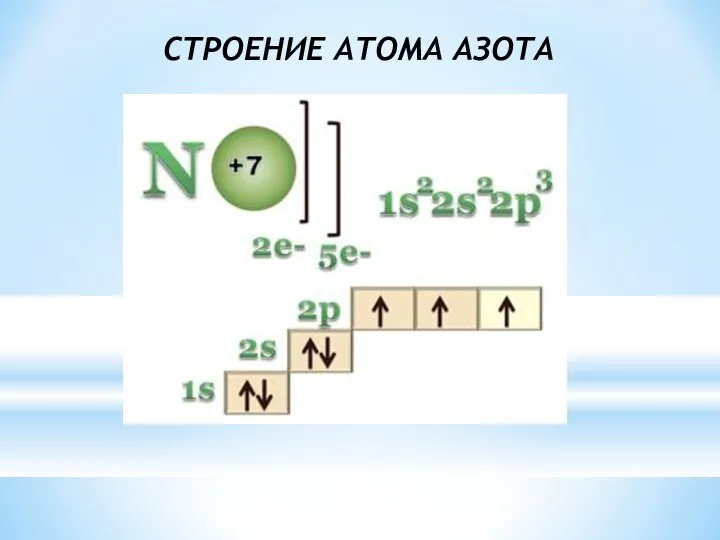
- 2. СТРОЕНИЕ АТОМА АЗОТА
- 3. Распростаненность азота Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет
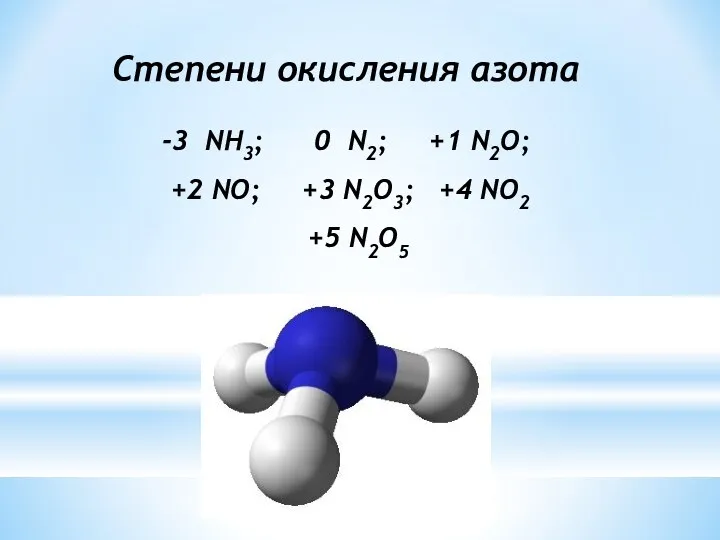
- 4. Степени окисления азота -3 NH3; 0 N2; +1 N2O; +2 NO; +3 N2O3; +4 NO2 +5
- 5. Азот – простое вещество. Азот – это газ, без цвета, запаха, вкуса. Строение молекулы. Молекула азота
- 6. Химические свойства азота В химическом отношении азот довольно инертный газ из-за прочной ковалентной связи. 1. Взаимодействие
- 7. Получение азота В лабораториях его можно получать 1. По реакции разложения нитрита аммония: NH4NO2 → N2↑
- 8. Аммиак Физические свойства Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким
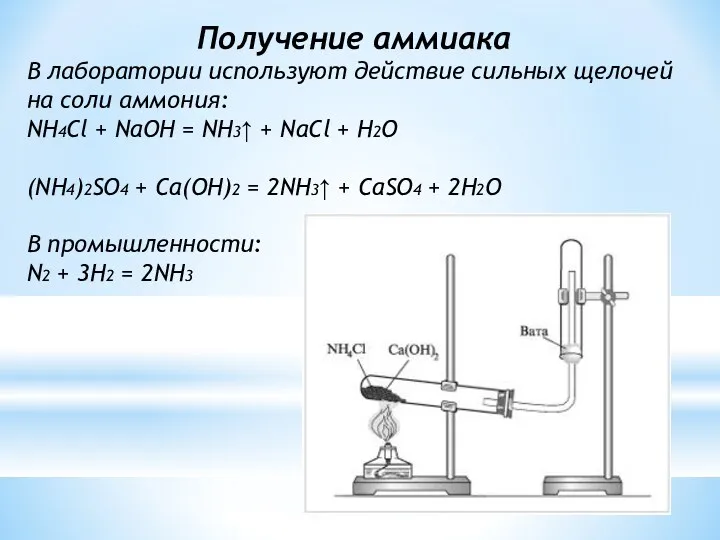
- 9. Получение аммиака В лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑
- 10. Из сложных веществ аммиак реагирует При 20 градусах один объем воды поглощает до Аммиак - чемпион
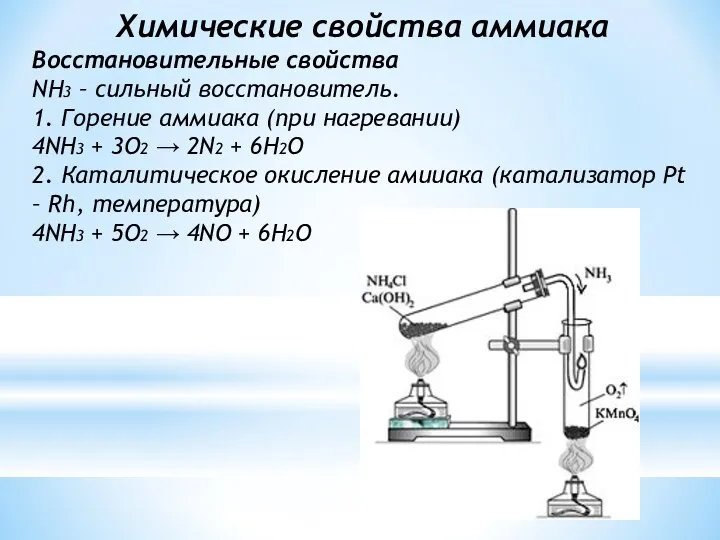
- 11. Химические свойства аммиака Восстановительные свойства NH3 – сильный восстановитель. 1. Горение аммиака (при нагревании) 4NH3 +
- 12. Образование связи по донорно-акцепторному механизму Катион аммония получается в результате того, что атом азота имеет свободную
- 13. Взаимодействие с водой и кислотами NH3 + Н2О NН4 ОН NH3 + HCl = NH4Cl 2NH3
- 14. Соли аммония Твердые, бесцветные, кристаллические, хорошо растворимые в воде вещества, при нагревании разлагаются. NH4Cl NH4 NO3
- 15. Соли аммония 1. Вступают в обменную реакцию с кислотами и солями: (NH4)2SO4 + Ba(NO3)2 → BaSO4
- 17. Скачать презентацию










 Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Обмен нуклеопротеинов
Обмен нуклеопротеинов Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Геохимия
Геохимия Электрохимические процессы
Электрохимические процессы Аммиак
Аммиак Предмет и история геохимии
Предмет и история геохимии Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Предмет органической химии
Предмет органической химии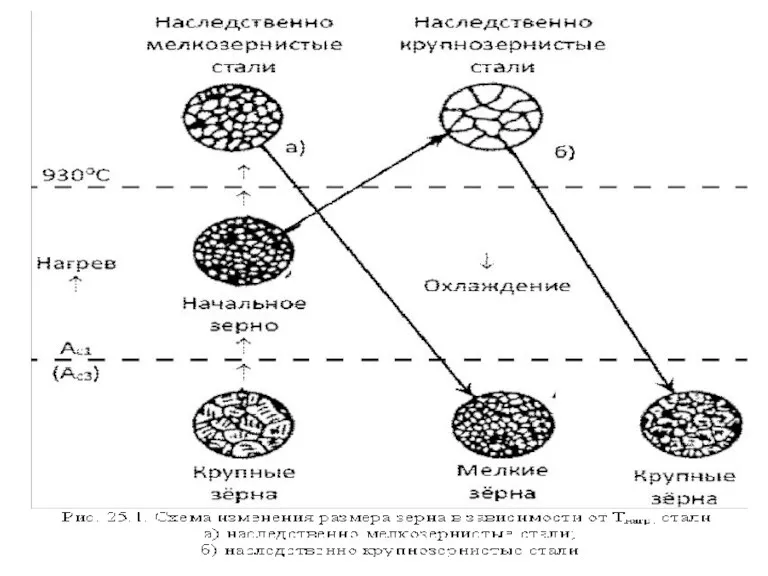 Материаловедение-2
Материаловедение-2 Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения Алюминий и его соединения
Алюминий и его соединения 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI)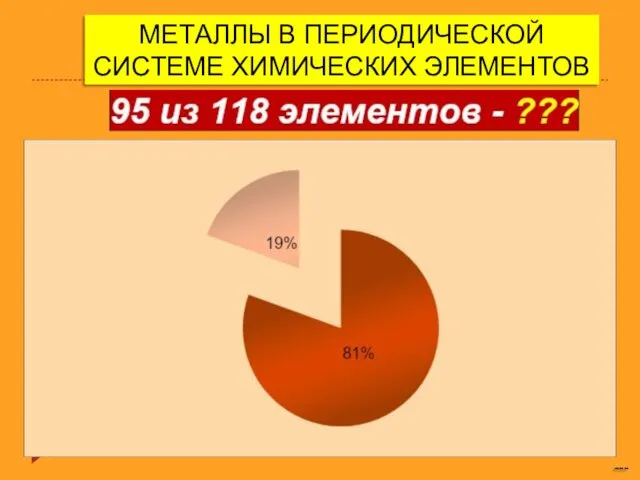 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Требования к осадителю
Требования к осадителю Protein Chemistry
Protein Chemistry Газообразное состояние вещества
Газообразное состояние вещества Кислоты. Состав кислот
Кислоты. Состав кислот 5.Алкины
5.Алкины Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Chemical kinetics
Chemical kinetics Фенол қосылыстары
Фенол қосылыстары Кевлар. Структура кевлара
Кевлар. Структура кевлара Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9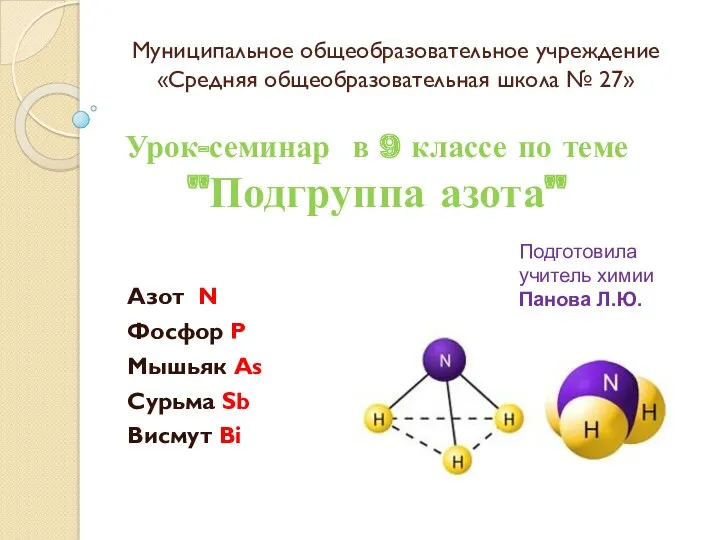 Подгруппа азота
Подгруппа азота Фосфор
Фосфор