Содержание
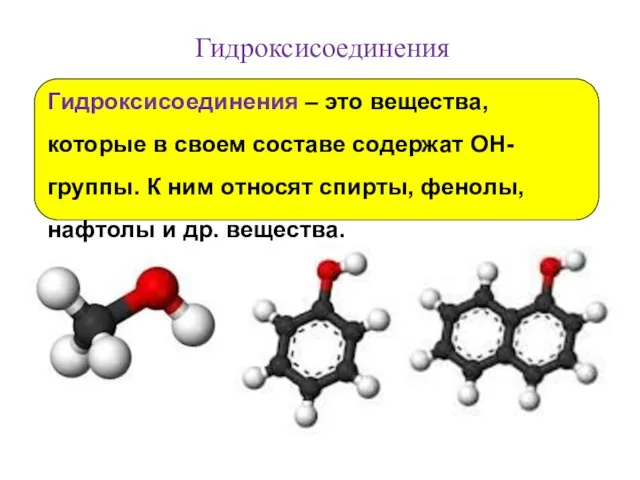
- 2. Гидроксисоединения Гидроксисоединения – это вещества, которые в своем составе содержат OH-группы. К ним относят спирты, фенолы,
- 3. Спирты – это гидроксисоединения, в молекулах которых OH-группы связаны с насыщенным атомом углерода, находящимся в состоянии
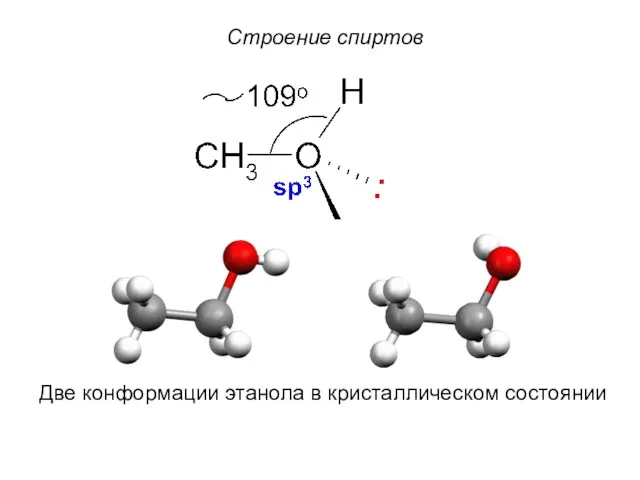
- 4. Строение спиртов Две конформации этанола в кристаллическом состоянии
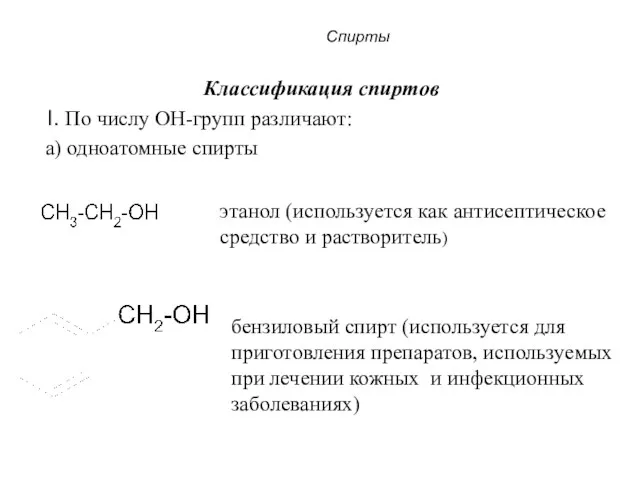
- 5. Спирты Классификация спиртов I. По числу OH-групп различают: a) одноатомные спирты этанол (используется как антисептическое средство
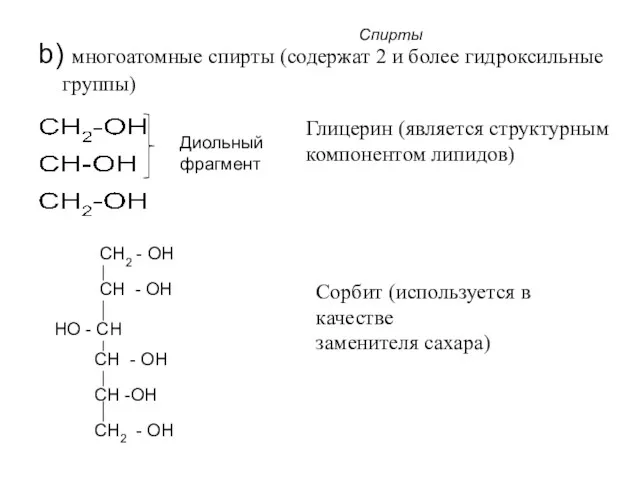
- 6. Спирты b) многоатомные спирты (содержат 2 и более гидроксильные группы) Глицерин (является структурным компонентом липидов) Диольный
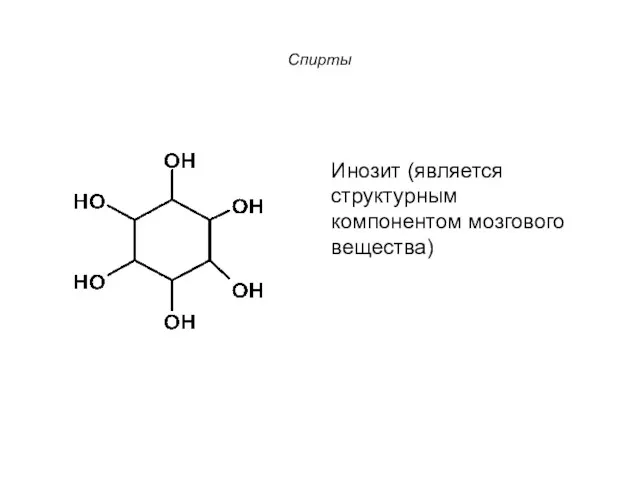
- 7. Спирты Инозит (является структурным компонентом мозгового вещества)
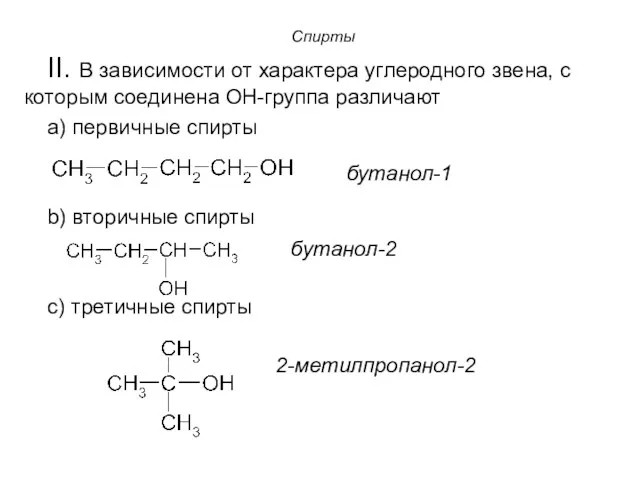
- 8. Спирты II. В зависимости от характера углеродного звена, с которым соединена OH-группа различают a) первичные спирты
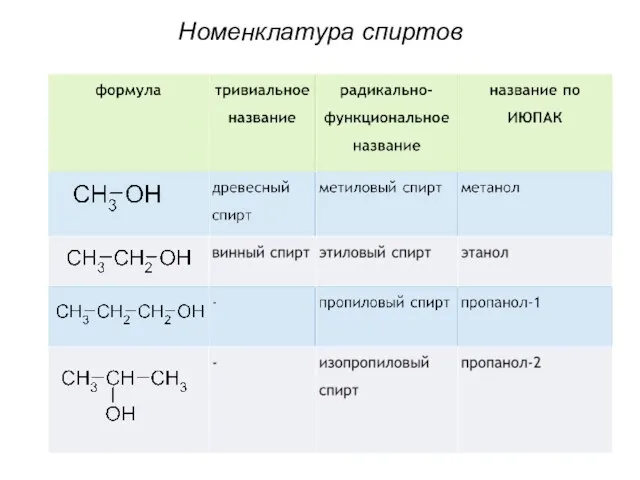
- 9. Номенклатура спиртов
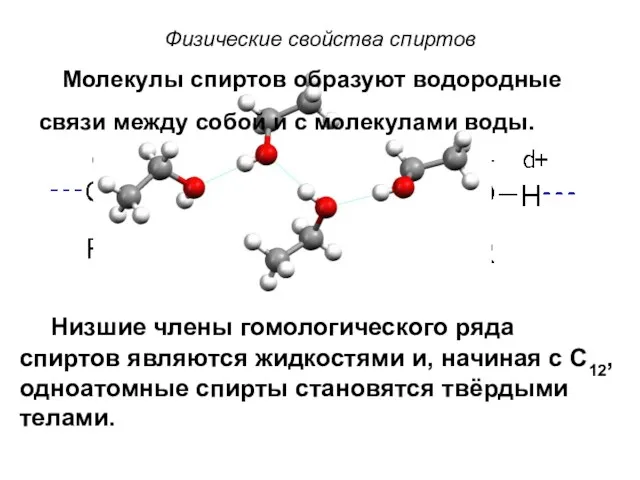
- 10. Физические свойства спиртов Низшие члены гомологического ряда спиртов являются жидкостями и, начиная с C12, одноатомные спирты
- 11. Спирты Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол
- 12. Спирты Метиловый спирт считается самым ядовитым спиртом. Прием внутрь вызывает слепоту или смерть. НЕ ПЕЙ МЕТИЛОВЫЙ
- 13. Общее действие этанола характеризуется угнетением функции ЦНС, а возникающие на начальных этапах эйфория и возбуждение являются
- 14. Злоупотребление этанолом ведёт к развитию алкоголизма, деградации личности, психическим расстройствам и соматическим заболеваниям. Спирты
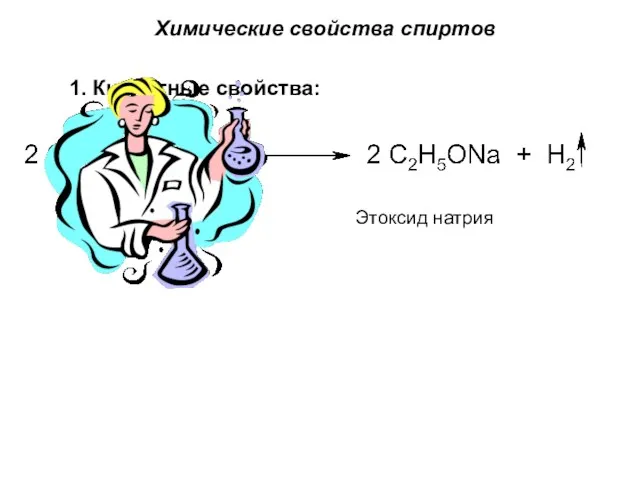
- 15. Химические свойства спиртов 1. Кислотные свойства: Этоксид натрия
- 16. Спирты 2. Реакции окисления: внутри организма (in vivo) эти реакции протекают с участием ферментов дегидрогеназ. Н
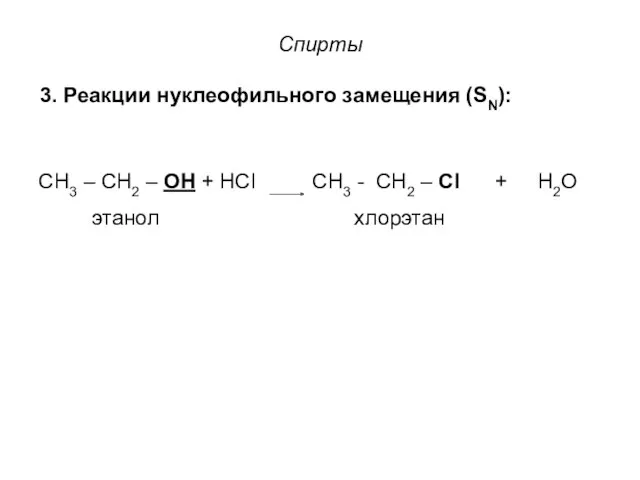
- 17. Спирты 3. Реакции нуклеофильного замещения (SN): СН3 – СН2 – ОН + НCl СН3 - СН2
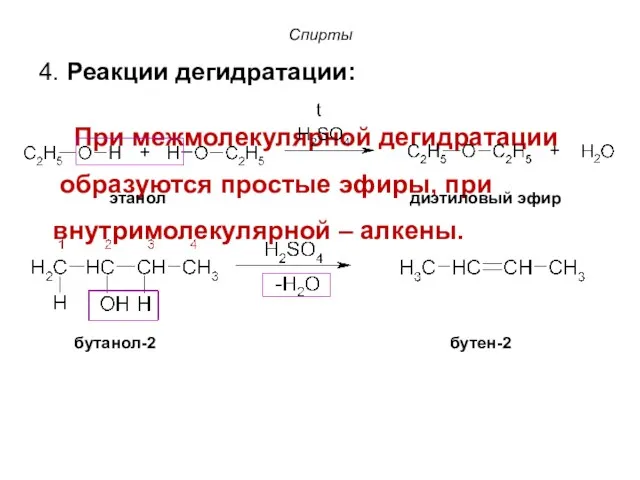
- 18. Спирты 4. Реакции дегидратации: При межмолекулярной дегидратации образуются простые эфиры, при внутримолекулярной – алкены. бутанол-2 бутен-2
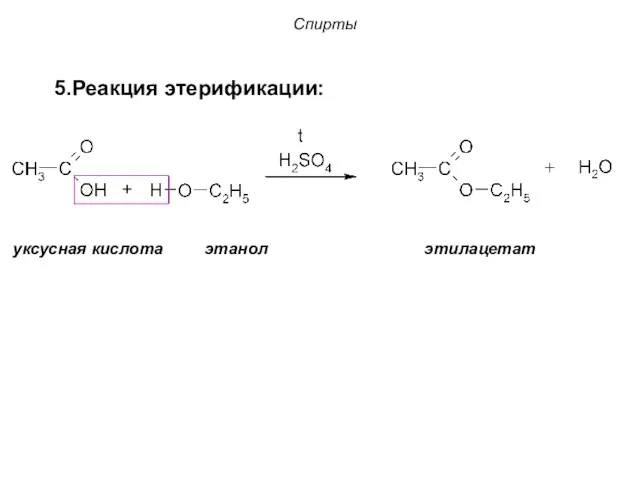
- 19. Спирты уксусная кислота этанол этилацетат 5.Реакция этерификации:
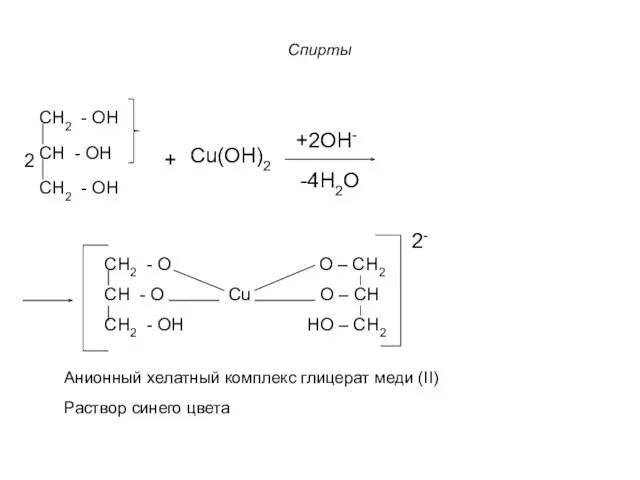
- 20. Спирты 6. Реакция хелатообразования: Многоатомные спирты, проявляя более выраженные кислотные свойства по сравнению с одноатомными спиртами
- 21. Спирты CH2 - OH CH - OH CH2 - OH Cu(ОН)2 +2ОН- -4Н2О CH2 - O
- 22. Фенолы По количеству OH-групп различают: фенол a) Одноатомные фенолы Фенолы – гидроксисоединения, в молекулах которых OH-группы
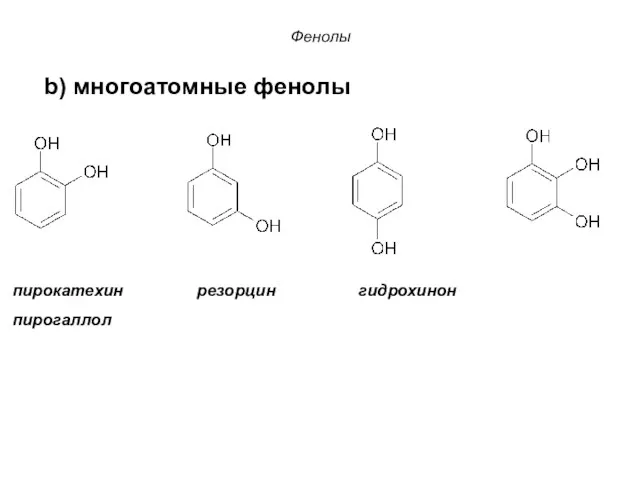
- 23. Фенолы пирокатехин резорцин гидрохинон пирогаллол b) многоатомные фенолы
- 24. Физические свойства фенола Фенол- кристаллическое вещество, антисептик.
- 25. Фенол - сильное дезинфицирующее средство; применяется для обезвреживания ран, в процессе лечения воспалительных заболеваний полости рта,
- 26. Применение фенолов в стоматологии Препараты на основе пара-хлофенола
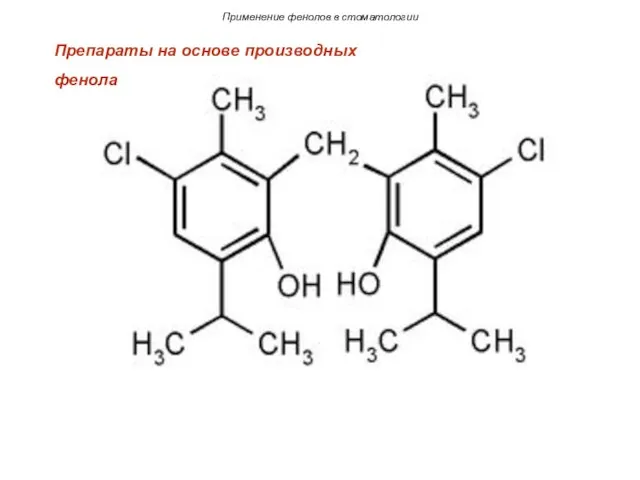
- 27. Применение фенолов в стоматологии Препараты на основе производных фенола
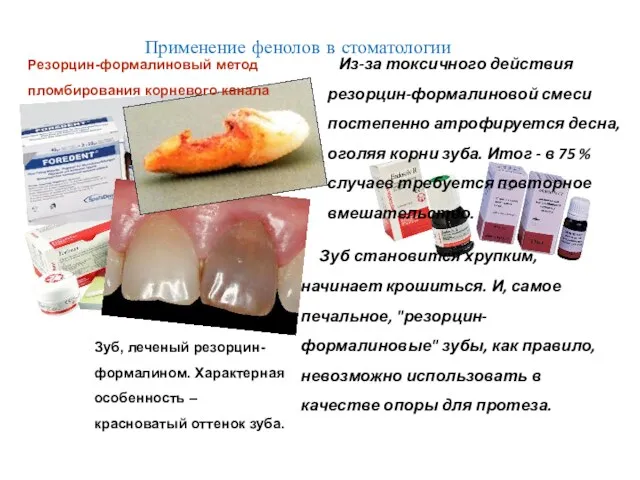
- 28. Зуб, леченый резорцин-формалином. Характерная особенность – красноватый оттенок зуба. Зуб становится хрупким, начинает крошиться. И, самое
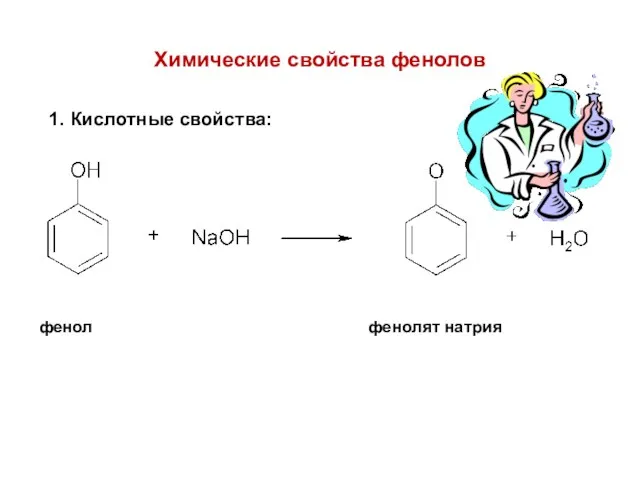
- 29. Химические свойства фенолов 1. Кислотные свойства: фенол фенолят натрия
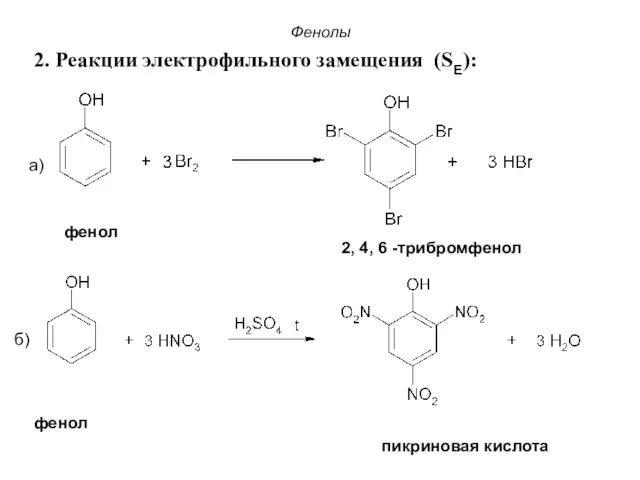
- 30. Фенолы 2. Реакции электрофильного замещения (SE): а) б) фенол пикриновая кислота фенол 2, 4, 6 -трибромфенол
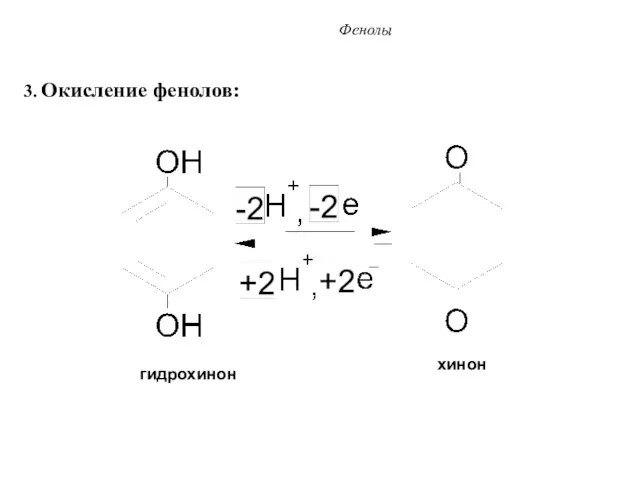
- 31. Фенолы 3. Окисление фенолов: гидрохинон хинон
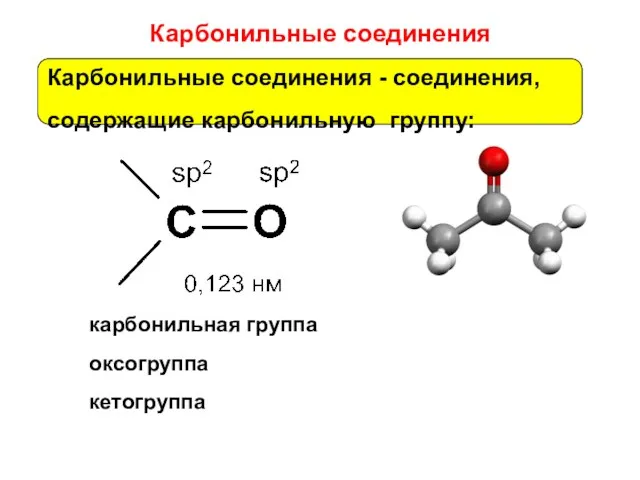
- 32. Карбонильные соединения карбонильная группа оксогруппа кетогруппа Карбонильные соединения - соединения, содержащие карбонильную группу:
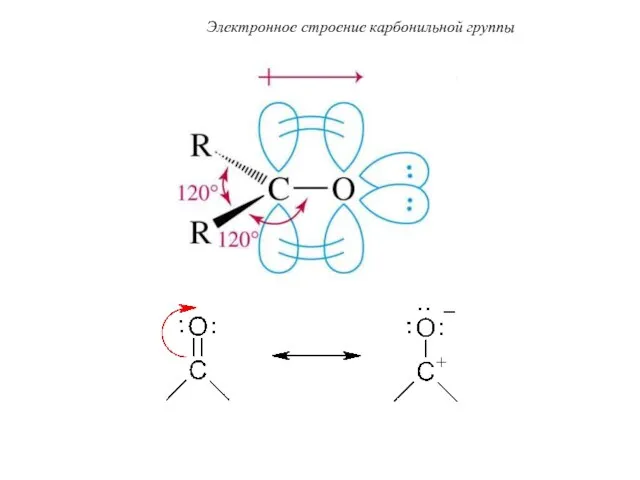
- 33. Электронное строение карбонильной группы Атом углерода находится в состоянии sp -гибридизации. Гибридные орбитали располагаются в одной
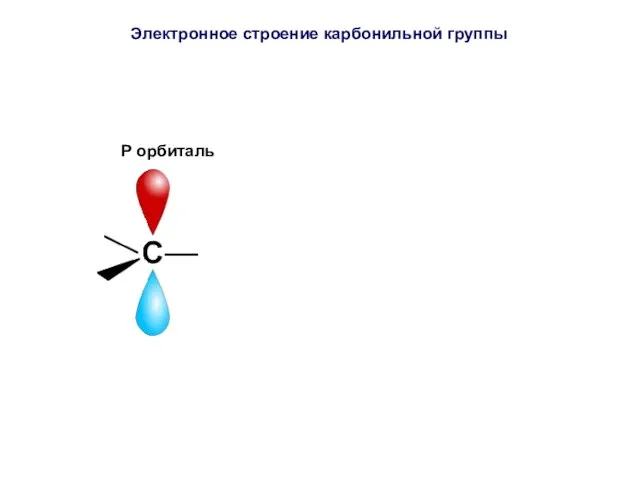
- 34. P орбиталь Электронное строение карбонильной группы
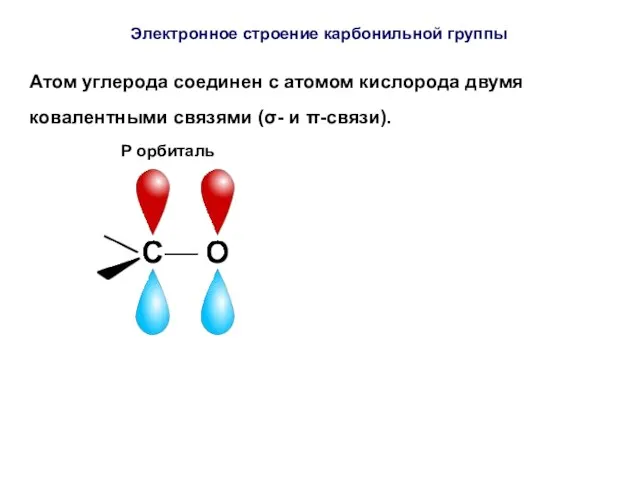
- 35. Атом углерода соединен с атомом кислорода двумя ковалентными связями (σ- и π-связи). P орбиталь Электронное строение
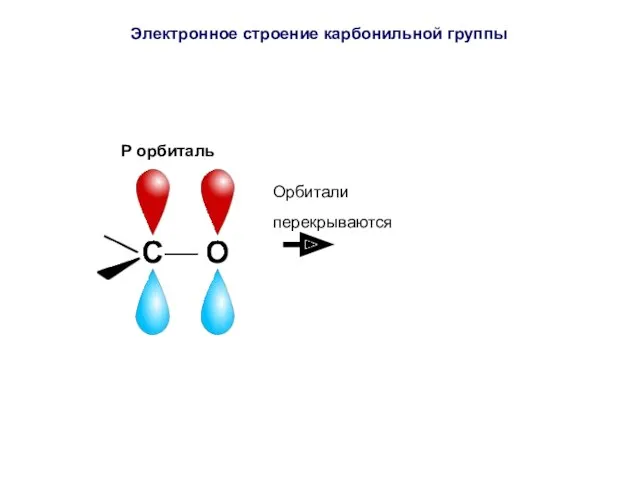
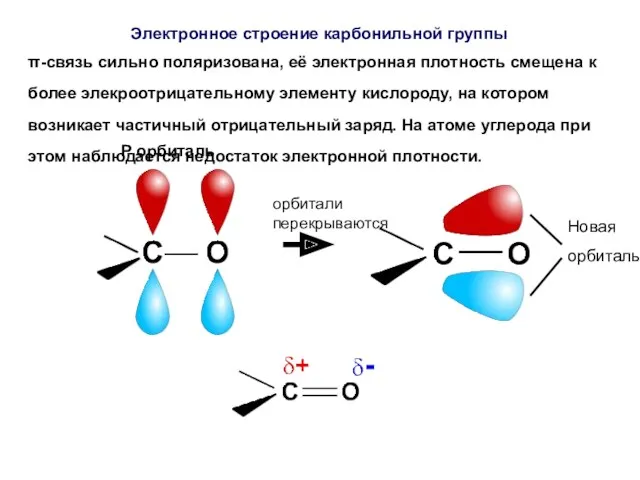
- 36. P орбиталь Орбитали перекрываются Электронное строение карбонильной группы
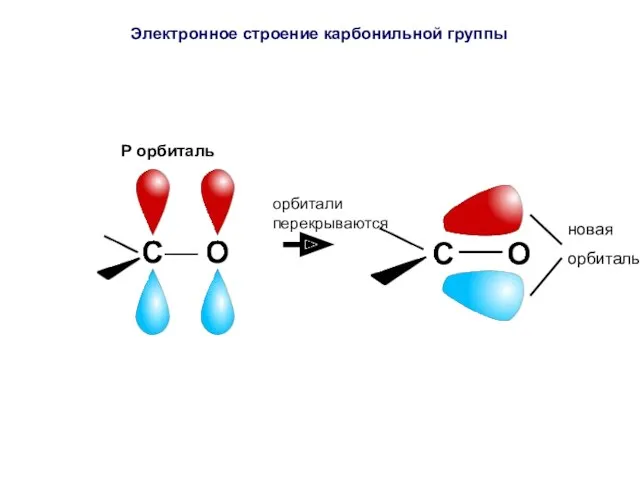
- 37. P орбиталь орбитали перекрываются новая орбиталь Электронное строение карбонильной группы
- 38. π-связь сильно поляризована, её электронная плотность смещена к более элекроотрицательному элементу кислороду, на котором возникает частичный
- 39. Электронное строение карбонильной группы
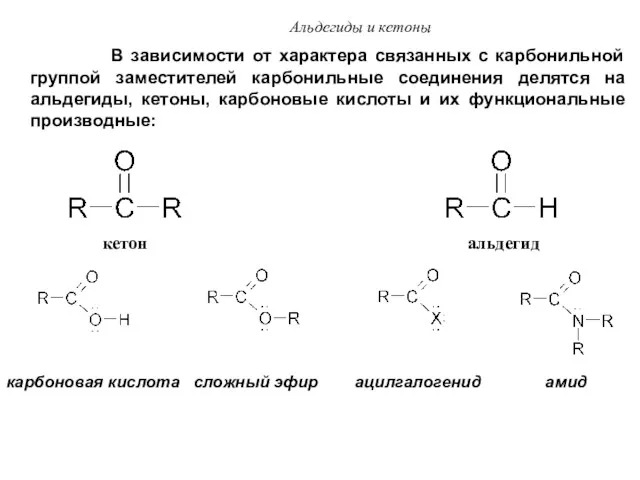
- 40. Альдегиды и кетоны В зависимости от характера связанных с карбонильной группой заместителей карбонильные соединения делятся на
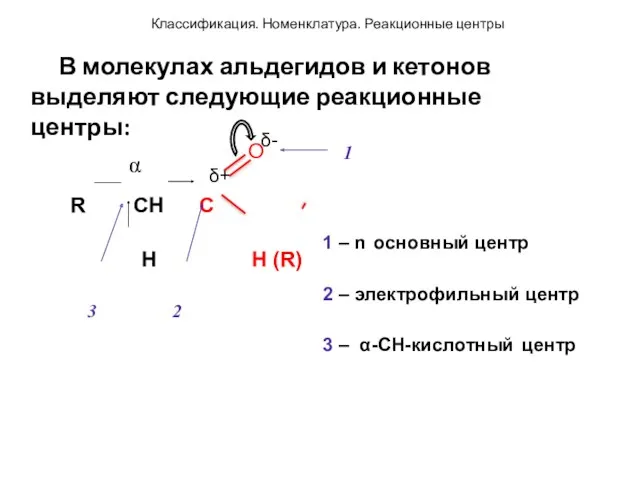
- 41. O 1 R CH C H H (R) 3 2 1 – n основный центр 2
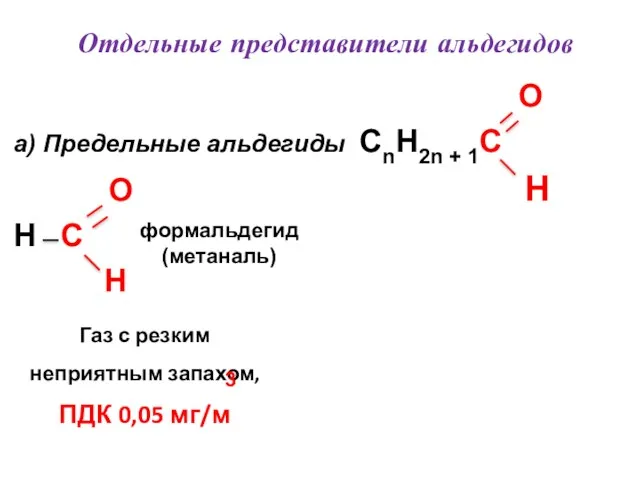
- 42. Отдельные представители альдегидов O a) Предельные альдегиды CnH2n + 1C O H H C H формальдегид
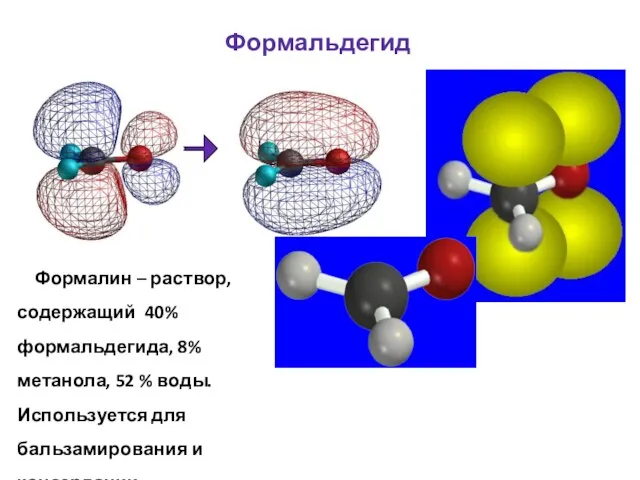
- 43. Формальдегид Формалин – раствор, содержащий 40% формальдегида, 8% метанола, 52 % воды. Используется для бальзамирования и
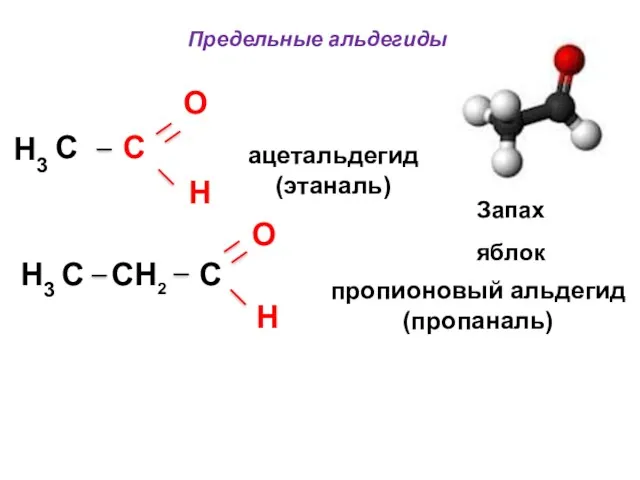
- 44. Предельные альдегиды O C C H ацетальдегид (этаналь) пропионовый альдегид (пропаналь) H3 H3 C CH2 C
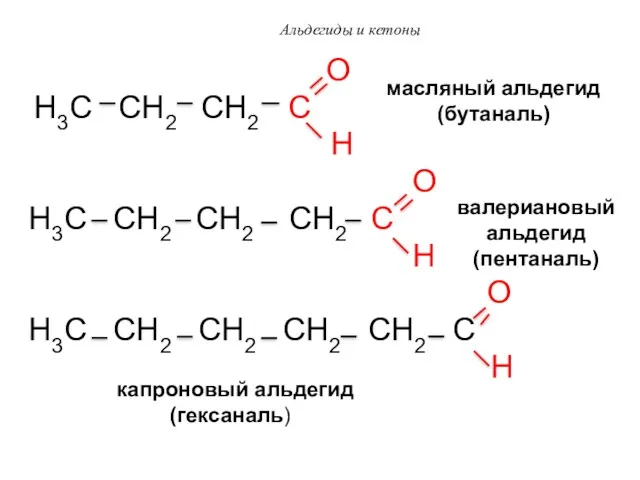
- 45. Альдегиды и кетоны O H3C CH2 CH2 C H O H3C CH2 CH2 CH2 C H
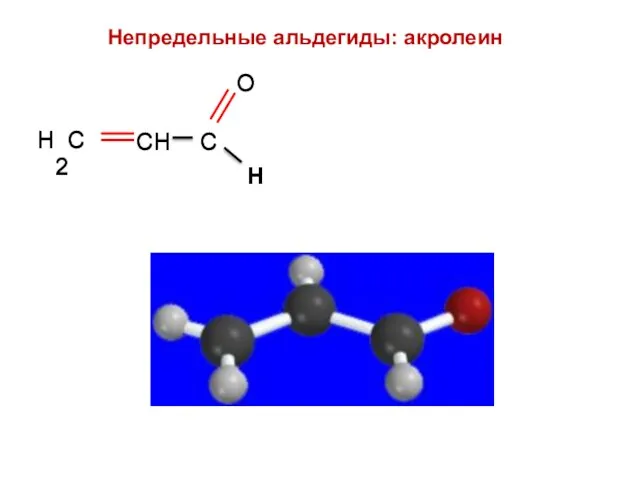
- 46. Н Непредельные альдегиды: акролеин Н
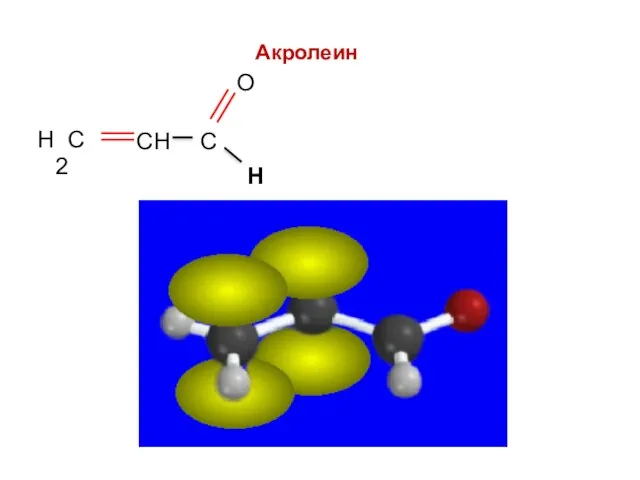
- 47. Акролеин Н
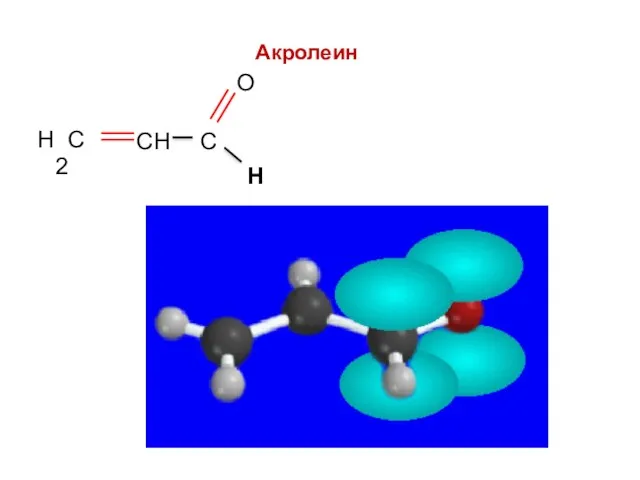
- 48. Акролеин Н
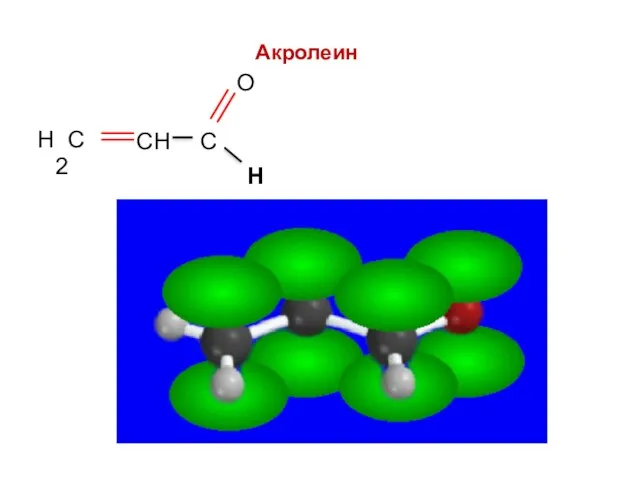
- 49. Акролеин Н
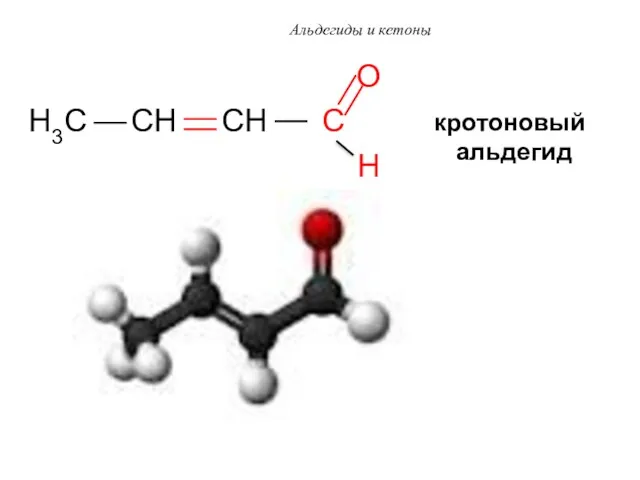
- 50. Альдегиды и кетоны O H3C CH CH C H кротоновый альдегид
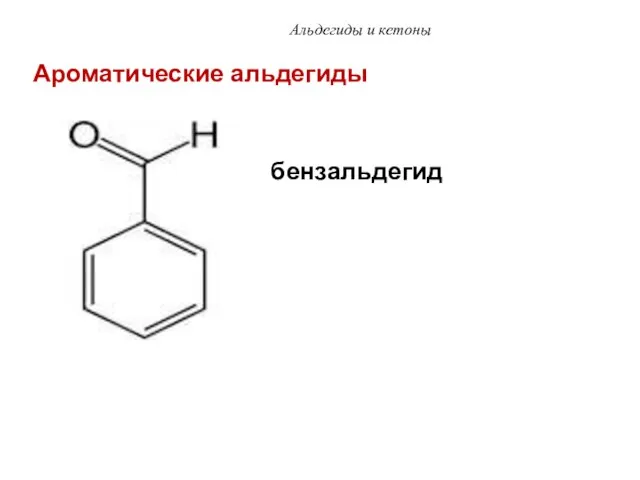
- 51. Альдегиды и кетоны бензальдегид Ароматические альдегиды
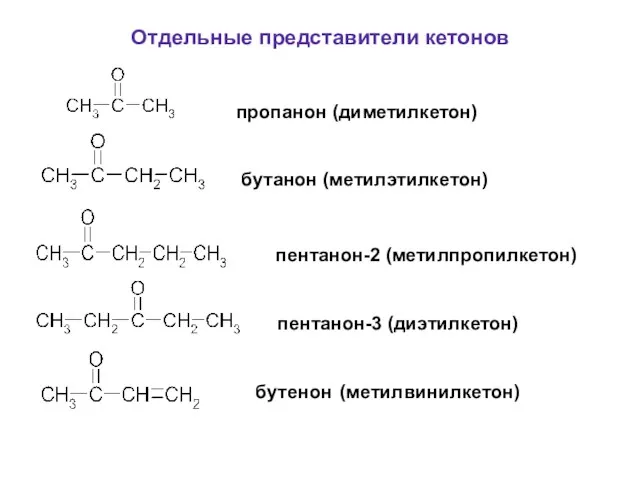
- 52. Отдельные представители кетонов пропанон (диметилкетон) бутанон (метилэтилкетон) пентанон-2 (метилпропилкетон) пентанон-3 (диэтилкетон) бутенон (метилвинилкетон)
- 53. Физические свойства альдегидов и кетонов Низшие альдегиды – газы с резким запахом. Низшие кетоны являются подвижными
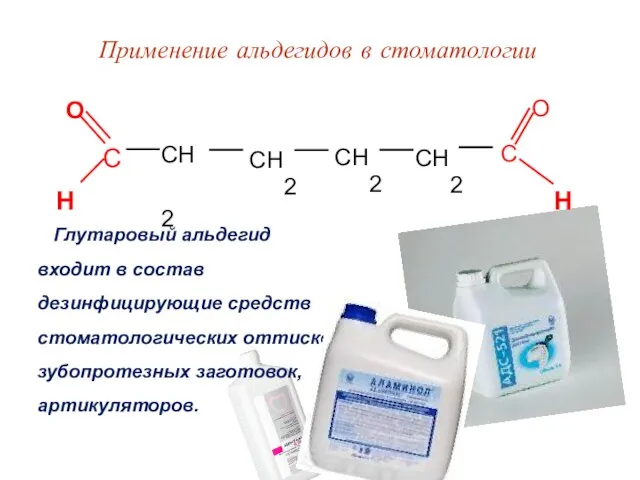
- 54. Применение альдегидов в стоматологии Глутаровый альдегид входит в состав дезинфицирующие средств стоматологических оттисков, зубопротезных заготовок, артикуляторов.
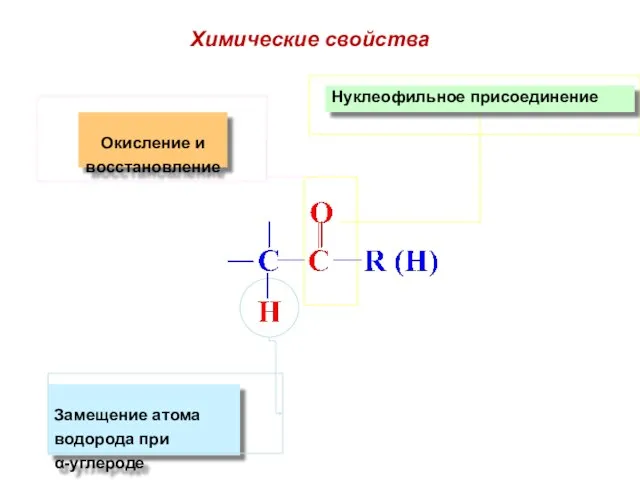
- 55. Нуклеофильное присоединение Окисление и восстановление Замещение атома водорода при α-углероде Химические свойства
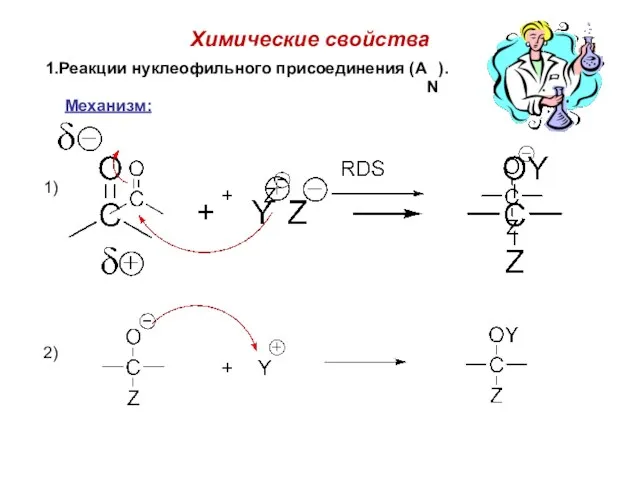
- 56. Химические свойства 1.Реакции нуклеофильного присоединения (AN). Механизм: 1) 2)
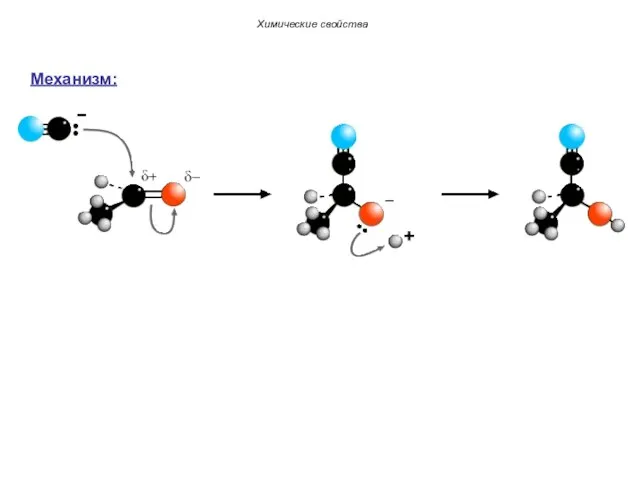
- 57. Химические свойства Механизм:
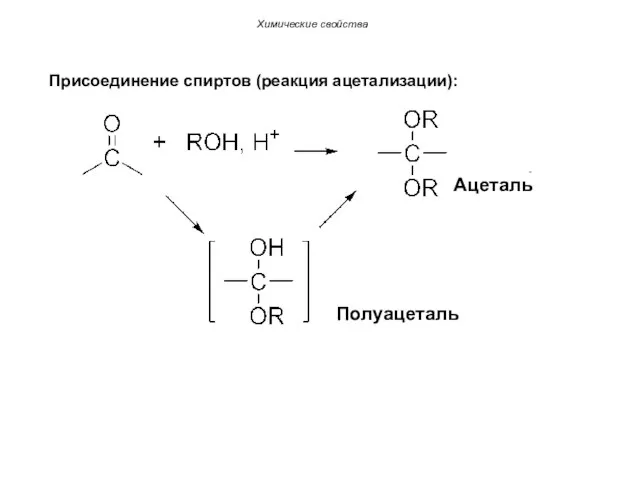
- 58. Присоединение спиртов (реакция ацетализации): Химические свойства Ацеталь Полуацеталь
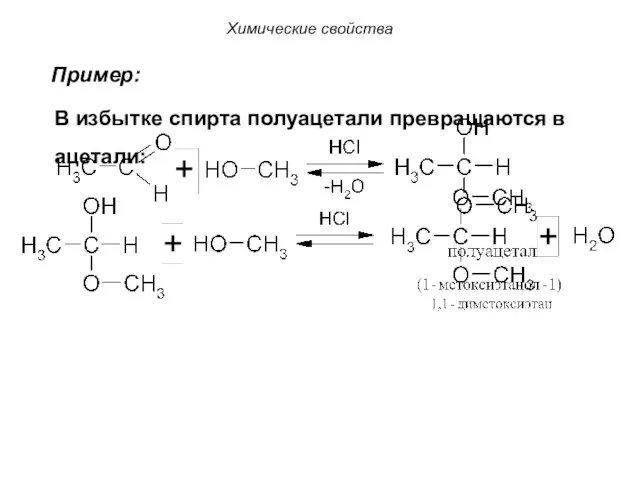
- 59. Химические свойства Пример: В избытке спирта полуацетали превращаются в ацетали:
- 60. Альдегиды и кетоны 2. Окисление альдегидов: O а) H3C C + 2 Cu(OH)2 H O H3C
- 61. Альдегиды и кетоны ацетальдегид уксусная кислота б) Реакция «серебряного зеркала»:
- 62. Общая схема альдольной конденсации: 3. Альдольная и кротоновая конденсация Под влиянием основных катализаторов альдегиды реагируют с
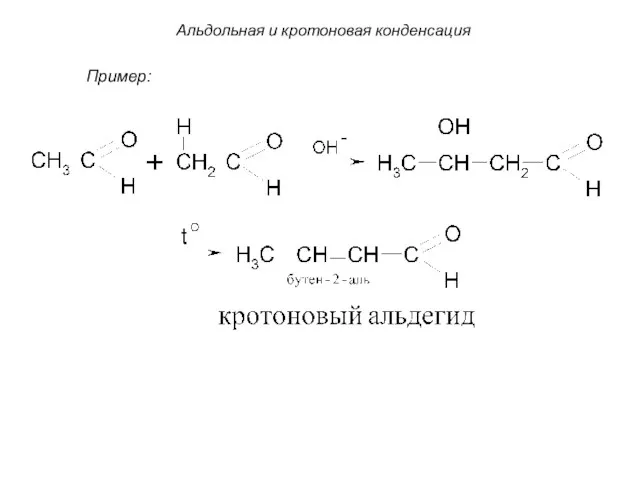
- 63. Альдольная и кротоновая конденсация Пример:
- 64. Шарль-Адольф Вюртц (1817 – 1884) Александр Порфирьевич Бородин (1833 —1887) Альдольная конденсация была открыта практически одновременно
- 65. А. П. Бородин. Портрет работы Ильи Репина (1888) А.П. Бородин открыл реакцию Бородина-Хунсдикера, впервые получил фторорганическое
- 67. Скачать презентацию














 Types of chemical bonds in crystals
Types of chemical bonds in crystals Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Подгруппа азота
Подгруппа азота Материаловедение. Контрольная работа
Материаловедение. Контрольная работа Вода - розчинник. Урок 41
Вода - розчинник. Урок 41 Щелочные металлы
Щелочные металлы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Тағам қоспалары
Тағам қоспалары Оксиды в минералогии
Оксиды в минералогии Классификация минералов по химическому принципу. Занятие 14
Классификация минералов по химическому принципу. Занятие 14 Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических Строение и свойства циклоалканов
Строение и свойства циклоалканов Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс Галогены
Галогены Алюминий и его соединения
Алюминий и его соединения Решение экспериментальных задач по теме Металлы и их соединения. Практическая работа №4
Решение экспериментальных задач по теме Металлы и их соединения. Практическая работа №4 Chemistry of Coordination Compounds
Chemistry of Coordination Compounds Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант kremniy
kremniy Соли, их классификация и свойства
Соли, их классификация и свойства Коллоидная химия
Коллоидная химия Тема 6-Альдегиды и кетоны
Тема 6-Альдегиды и кетоны Хімія і здоров'я людини
Хімія і здоров'я людини Особенности строения соединений органической химии. 10 класс
Особенности строения соединений органической химии. 10 класс Металлы главных подгрупп
Металлы главных подгрупп 20230419_soli
20230419_soli Агрегатные состояния вещества
Агрегатные состояния вещества