Содержание
- 2. ЩЕЛОЧНЫ́Е МЕТА́ЛЛЫ — ЭТО ЭЛЕМЕНТЫ 1-Й ГРУППЫ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (ПО УСТАРЕВШЕЙ КЛАССИФИКАЦИИ — ЭЛЕМЕНТЫ
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА ЩЕЛОЧНЫХ МЕТАЛЛОВ В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения
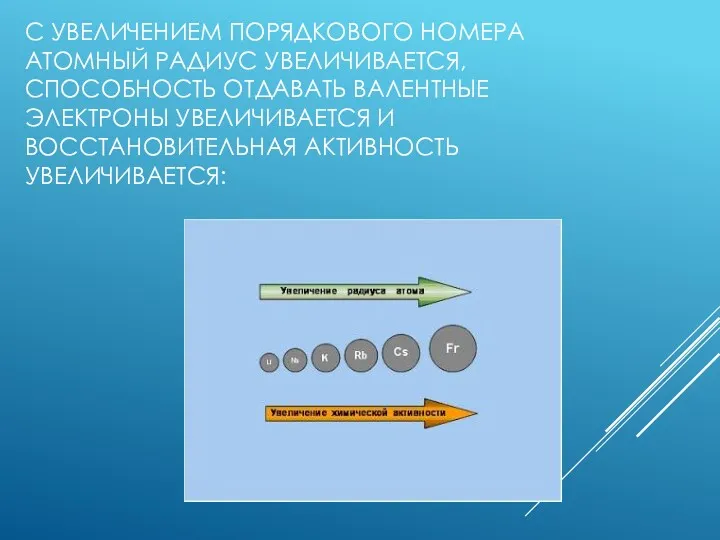
- 4. С УВЕЛИЧЕНИЕМ ПОРЯДКОВОГО НОМЕРА АТОМНЫЙ РАДИУС УВЕЛИЧИВАЕТСЯ, СПОСОБНОСТЬ ОТДАВАТЬ ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ УВЕЛИЧИВАЕТСЯ И ВОССТАНОВИТЕЛЬНАЯ АКТИВНОСТЬ УВЕЛИЧИВАЕТСЯ:
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА НИЗКИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ, МАЛЫЕ ЗНАЧЕНИЯ ПЛОТНОСТЕЙ, МЯГКИЕ, РЕЖУТСЯ НОЖОМ.
- 6. ХИМИЧЕСКИЕ СВОЙСТВА ТИПИЧНЫЕ МЕТАЛЛЫ, ОЧЕНЬ СИЛЬНЫЕ ВОССТАНОВИТЕЛИ. В СОЕДИНЕНИЯХ ПРОЯВЛЯЮТ ЕДИНСТВЕННУЮ СТЕПЕНЬ ОКИСЛЕНИЯ +1. ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ
- 7. 4. В РЕАКЦИЯХ С ДРУГИМИ НЕМЕТАЛЛАМИ ОБРАЗУЮТСЯ БИНАРНЫЕ СОЕДИНЕНИЯ: 2LI + CL2 → 2LICL (ГАЛОГЕНИДЫ) 2NA
- 8. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КАТИОНЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ - ОКРАШИВАНИЕ ПЛАМЕНИ В СЛЕДУЮЩИЕ ЦВЕТА: LI+ – КАРМИНОВО-КРАСНЫЙ NA+
- 10. Скачать презентацию






 Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Камни и Козерог
Камни и Козерог Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution
Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution Классификация химических реакций
Классификация химических реакций Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Классы неорганических соединений
Классы неорганических соединений Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Альдегиды и кетоны
Альдегиды и кетоны Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Дисперсные системы
Дисперсные системы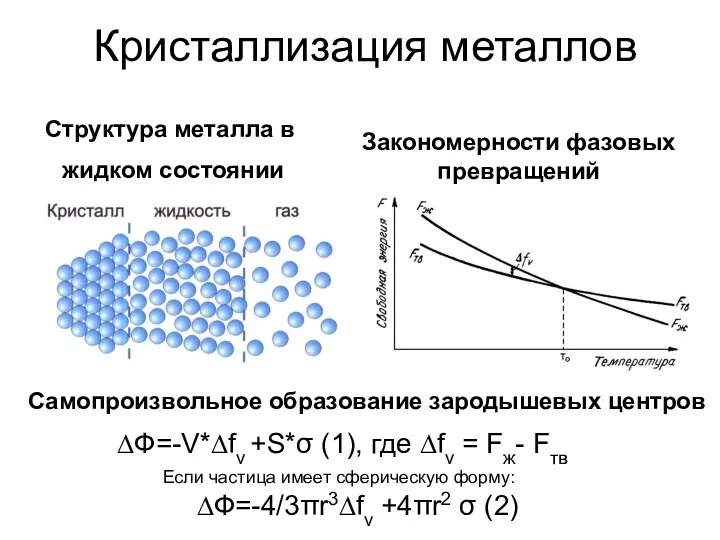 Закономерности фазовых превращений
Закономерности фазовых превращений Органическая химия
Органическая химия Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Основания
Основания Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Хімічні та фізичні явища
Хімічні та фізичні явища Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Материаловедение. Химия функциональных материалов
Материаловедение. Химия функциональных материалов Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства