Содержание
- 2. Электрокинетические свойства Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности
- 3. Обусловлены наличием заряда у частиц д. ф. и противоположного заряда д. с. Существует два вида: Электрокинетические
- 4. 1809 г. Ф.Ф. Рейсс изучал электрофорез на глине. Д. ф. заряжена «–»: кремнезём [mSiO2]∙nSiO- ∙ (n
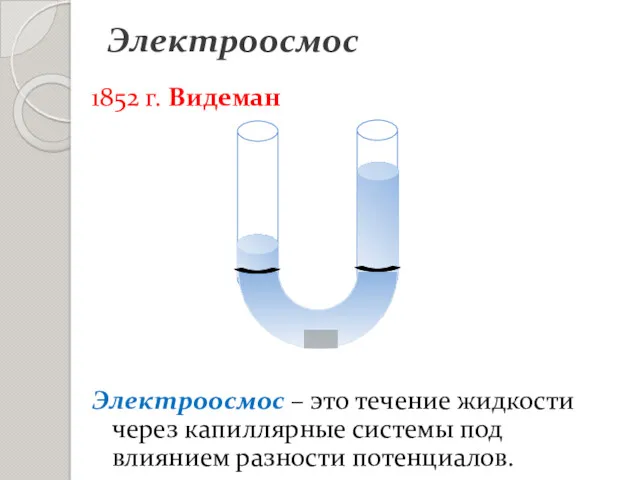
- 5. Электроосмос 1852 г. Видеман Электроосмос – это течение жидкости через капиллярные системы под влиянием разности потенциалов.
- 6. Эффект Дорна Эффект Дорна или потенциал седиментации (1878г.) – явление возникновения разности потенциалов между двумя электродами
- 7. Эффект Квинке Эффект Квинке или потенциал протекания (1859 г.) –возникновение разности потенциалов при течение воды и
- 8. ДЭС Возникает в результате двух причин: - или в результате избирательной адсорбции одного из ионов электролита;
- 9. ДЭС в результате избирательной адсорбции одного из ионов электролита. ДЭС
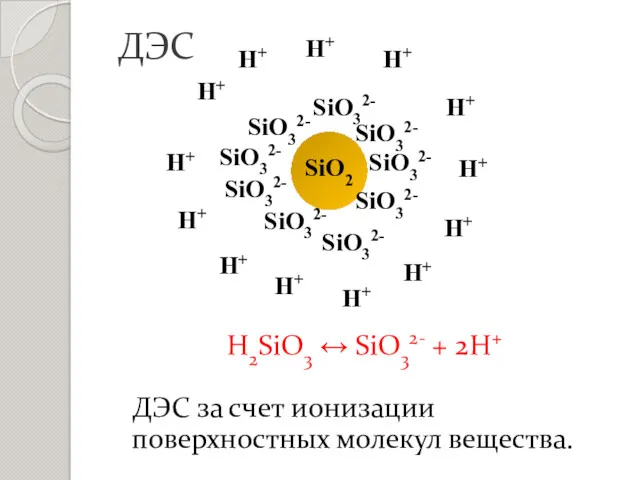
- 10. ДЭС за счет ионизации поверхностных молекул вещества. ДЭС H2SiO3 ↔ SiO32- + 2H+
- 11. Строение двойного электрического слоя Существует несколько моделей: Модель Гельмгольца-Перрена Модель Гуи-Чэпмена Модель Штерна
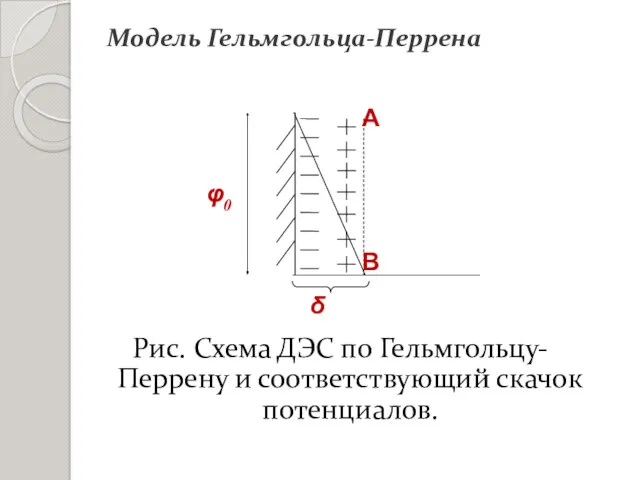
- 12. Модель Гельмгольца-Перрена ДЭС – это два близко расположенных слоя ионов: один на поверхности (потенциалопределяющие ионы), другой
- 13. Рис. Схема ДЭС по Гельмгольцу-Перрену и соответствующий скачок потенциалов. Модель Гельмгольца-Перрена
- 14. ДЭС является как бы плоским конденсатором. где φ0 – разность потенциалов между дисперсной фазой и дисперсионной
- 15. Недостатки теории: - толщина ДЭС Гельмгольца-Перрена очень мала и приближена к молекулярным размерам; – невозможно определить
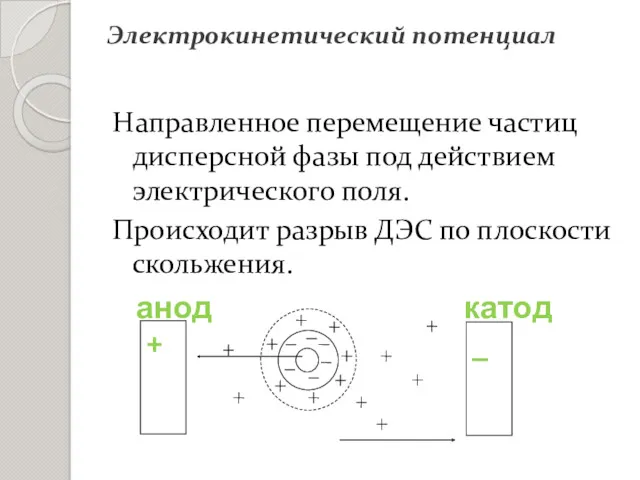
- 16. Плоскость скольжения (АВ) – место разрыва при перемещении твердой и жидкой фазы относительно друг друга. Электрокинетический
- 17. Модель Гуи-Чэпмена Теория ДЭС с диффузным слоем противоионов предложена независимо друг от друга Гуи (1910 г.)
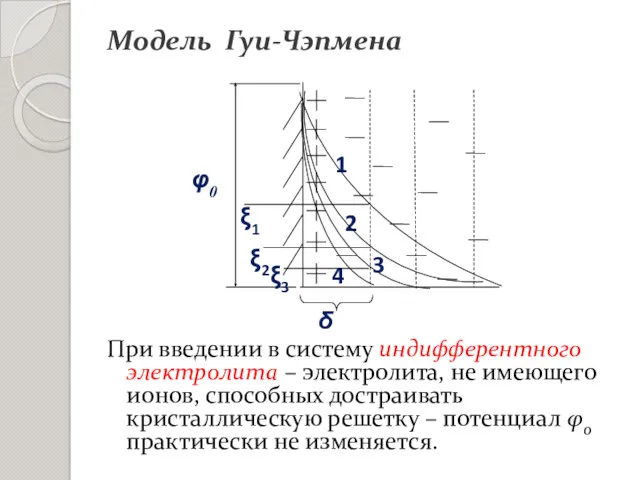
- 18. Рис. Схема ДЭС по Гуи-Чэпмену и падение в нём потенциала. Модель Гуи-Чэпмена
- 19. Величина электрокинетического потенциала зависит от: Модель Гуи-Чэпмена концентрации противоионов индифферентного электролита валентности противоиона
- 20. При введении в систему индифферентного электролита – электролита, не имеющего ионов, способных достраивать кристаллическую решетку –
- 21. С увеличением валентности противоиона резко уменьшается ξ-потенциал. Модель Гуи-Чэпмена
- 22. Недостатки теории: не принимается во внимание объем ионов; не объясняет явление перезарядки - перемены знака электрокинетического
- 23. Модель Штерна 1924 г. Штерн объединил схему строения ДЭС Гельмгольца-Перрена и Гуи-Чэпмена.
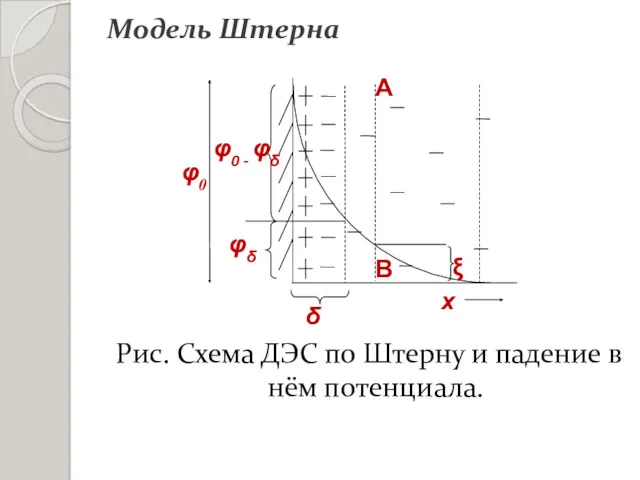
- 24. Рис. Схема ДЭС по Штерну и падение в нём потенциала. Модель Штерна
- 25. Падение потенциала φ0 складывается из φδ – падения потенциала в диффузнном слое - и разности потенциалов
- 26. Зависимость электрокинетического потенциала от валентности противоиона определяется адсорбционной способностью, обусловленной их поляризуемостью и гидратацией. Перезарядка ДЭС:
- 27. Электрокинетический потенциал Направленное перемещение частиц дисперсной фазы под действием электрического поля. Происходит разрыв ДЭС по плоскости
- 28. Линейная скорость (U) – движение частиц относительно мембраны при электроосмосе и движение частиц при электрофорезе: -
- 30. Скачать презентацию




















 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы