Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність презентация
Содержание
- 2. Положення Алюмінію в періодичній системі, будова його атома Алюміній — хімічний елемент ІІІА групи 3 періоду;
- 3. Алюміній Фізичні властивості алюмінію: Сріблясто-білий метал, легкий і пластичний, ρ = 2,7 г/см3, tпл = 660
- 4. Природні сполуки Алюмінію Каолініт входить до складу глини. Корунд Al2 O3, кристали: червоні (рубіни), сині (сапфіри).
- 5. Боксит Нефелін Кріоліт
- 6. Хімічні властивості Алюмінію Добування - електроліз розплавленої суміші алюміній оксиду Al2O3 з криолітом Na3AlF6. Глинозем плавиться
- 7. Хімічні властивості Алюмінію Активний метал: реагує з неметалами; виявляє амфотерні властивості – розчиняється в кислотах та
- 8. Хімічні властивості Алюмінію Взаємодія з водой 2Al + 6H2O = 2Al(OH)3 + 3H2↑ Взаємодія з йодом
- 9. Алюміній оксид Al2 O3 Біла тугоплавка речовина, нерозчинна у воді, tпл = 2 050 °C. За
- 10. Алюміній гідроксид Al(OН)3 Біла, тверда, нерозчинна у воді речовина За хімічними властивостями належить до амфотерних гідроксидів
- 11. Застосування Алюмінію
- 12. Застосування Алюмінію • У металургії для одержання інших менш активних металів методом алюмотермії. • Алюміній є
- 13. Закріплюємо матеріал: Обчисліть об'єм розчину сульфатної кислоти з масовою часткою розчиненої речовини 18% (густина 1,127 г/мл),
- 15. Скачать презентацию












 ОВР в органической химии
ОВР в органической химии Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции
Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов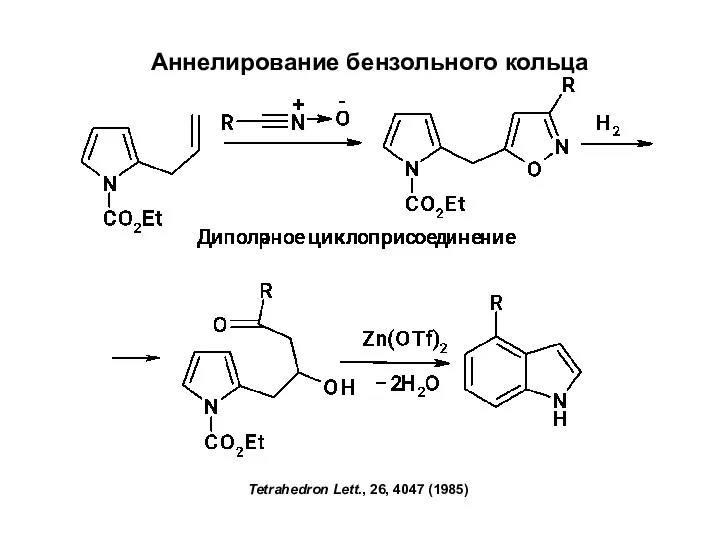 Аннелирование бензольного кольца
Аннелирование бензольного кольца Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона Хімія та обмін вуглеводів
Хімія та обмін вуглеводів Алюминий и его соединения
Алюминий и его соединения Выращивание кристаллов методом Чохральского
Выращивание кристаллов методом Чохральского Супутній нафтовий газ
Супутній нафтовий газ Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Соли, как производные кислот и оснований. Их состав и номенклатура
Соли, как производные кислот и оснований. Их состав и номенклатура Сахар - вред или польза?
Сахар - вред или польза? Алюминий и его соединения
Алюминий и его соединения Жесткость воды. Способы ее устранения
Жесткость воды. Способы ее устранения Объёмная доля компонента смеси
Объёмная доля компонента смеси МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Различные теории кислот и оснований
Различные теории кислот и оснований Прочность полимеров
Прочность полимеров Оксиды и гидроксиды
Оксиды и гидроксиды Оксид углерода-С
Оксид углерода-С Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Физико-химические процессы в тропосфере. Температурные инверсии. Смог в атмосфере городов. Аэрозоли
Физико-химические процессы в тропосфере. Температурные инверсии. Смог в атмосфере городов. Аэрозоли