Содержание
- 2. Цели и задачи Цели и Задачи: - Образовательные - Развивающие - Воспитательные
- 3. Образовательные Образовательные Сформировать представление у учащихся о строении, важнейших свойствах алюминия и его соединений, нахождении в
- 4. Развивающие Развивающие На основе теории строения атома и периодической системы химических элементов Д. И. Менделеева развить
- 5. Воспитательные Воспитательные Воспитание познавательного интереса у учащихся, расширение их кругозора в связи с изучением применения алюминия
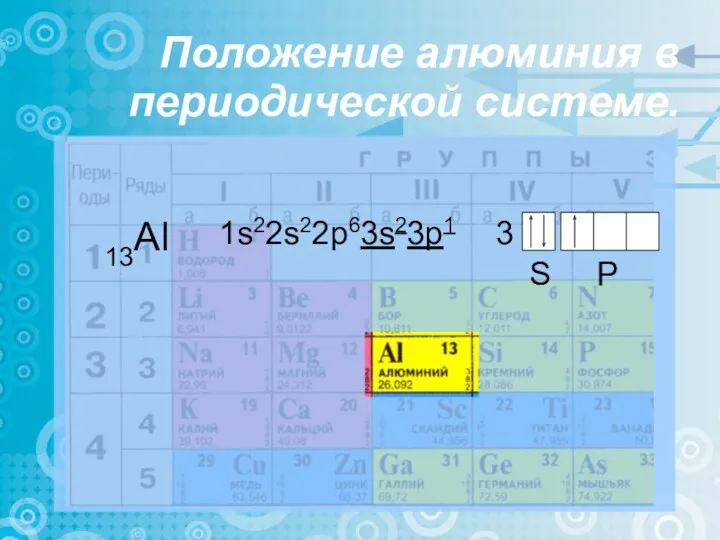
- 6. Положение алюминия в периодической системе. 13Al 1s22s22p63s23p1 3 S P
- 7. Открытие алюминия. Первые упоминания об «легком серебристом металле» можно встретить у Плиния старшего, и относятся они
- 8. Открытие алюминия. Первым, кому удалось получить металлический алюминий, был датский ученый Эрстед. В 1825 году в
- 9. Открытие алюминия. В 1865 году русский ученый Н. Н. Бекетов предложил способ, который быстро нашел применение
- 10. Нахождение в природе. Бокситы Нефелин Каолин Криолит Корунд
- 11. Получение. Электролиз: - это окислительно-восстановительный процесс, происходящий на электродах при прохождении электрического тока через раствор или
- 12. Физические свойства Алюминий — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Поверхность металла покрыта тонкой, но
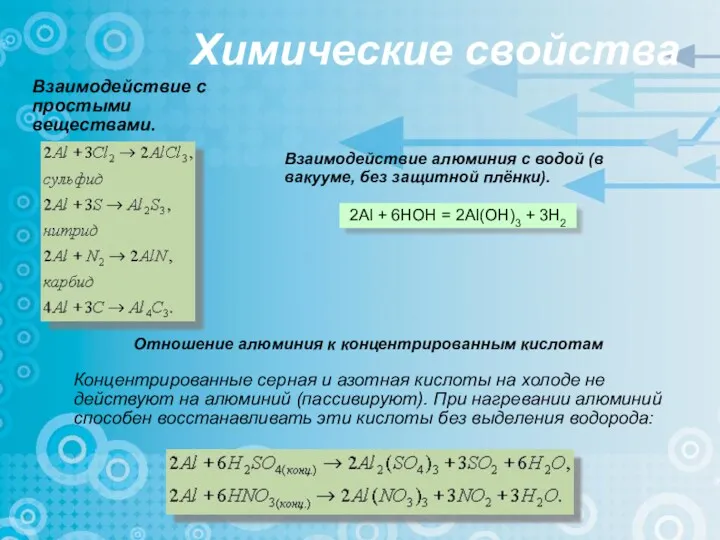
- 13. Химические свойства Взаимодействие с простыми веществами. Концентрированные серная и азотная кислоты на холоде не действуют на
- 14. Амфотерные свойства Алюминий амфотерен, т.к. может реагировать не только с кислотами, но и с щелочами. Взаимодействие
- 15. Алюминотермия Алюминотермия - это способность получать различные металлы из их оксидов путем восстановления алюминием. Алюминотермией можно
- 16. Оксид алюминия Оксид алюминия — твёрдое вещество, нерастворимое в воде, обладающее амфотерными свойствами. Взаимодействие с кислотами
- 17. Оксид алюминия Al2O3 имеет 9 кристаллических модификаций. Самая распространенная a - модификация. Она наиболее химически инертна,
- 18. Гидроксид алюминия Гидроксид алюминия — белое студенистое вещество, практически нерастворимое в воде, обладающее амфотерными свойствами. Взаимодействие
- 19. Соли алюминия Соли алюминия. Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли
- 20. Применение алюминия 1. Ракето- и самолётостроение. 2. Электротехника (линии электропередач) 3. Строительство (алюминиевые крепления, «Краска-серебрянка») 4.
- 22. Скачать презентацию

















 Основные понятия. Химический язык
Основные понятия. Химический язык Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)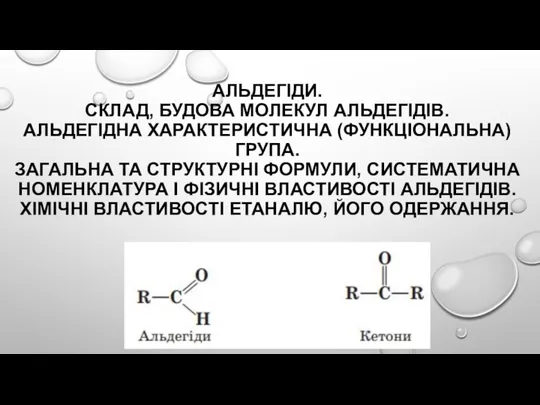 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Оксиди нітрогену
Оксиди нітрогену Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Алкадиены
Алкадиены Энергетическое топливо и его классификация
Энергетическое топливо и его классификация Білки (протеїни)
Білки (протеїни) Строение и свойства материалов
Строение и свойства материалов Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов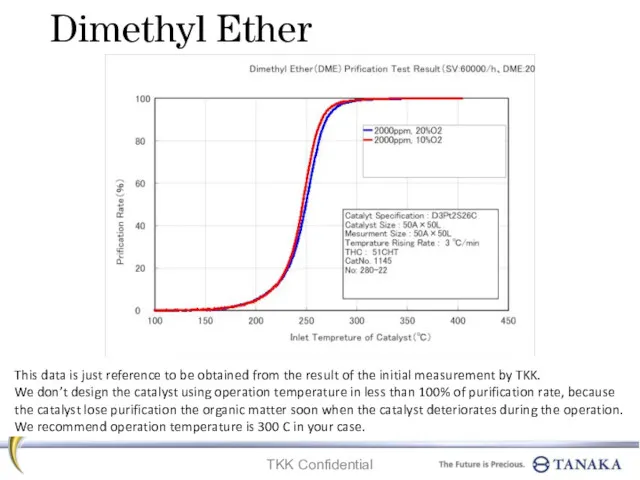 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Озон. Строние молекулы озона
Озон. Строние молекулы озона Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля