Содержание
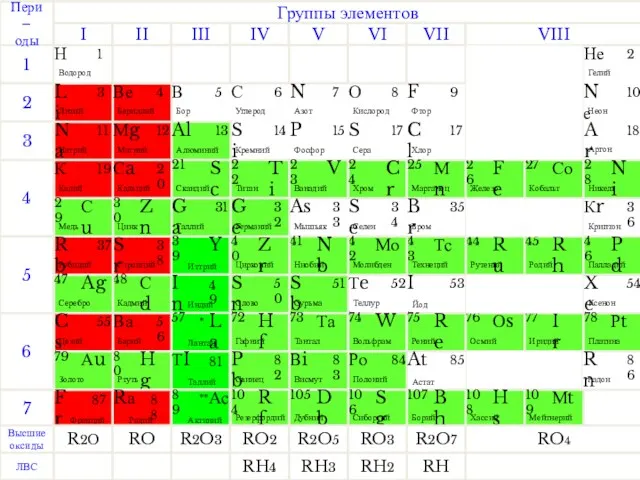
- 3. В At Условная граница между элементами-неметаллами и элементами металлами проходит ниже диагонали B – Si –
- 4. В атомах металлов на внешнем электронном слое небольшое число электронов = номеру группы Атомы металлов отдают
- 5. электропроводность теплопроводность Металлы проводят электрический ток и тепло Физические свойства металлов
- 6. Физические свойства металлов
- 7. Металлы обладают металлическим блеском Физические свойства металлов
- 8. Физические свойства металлов
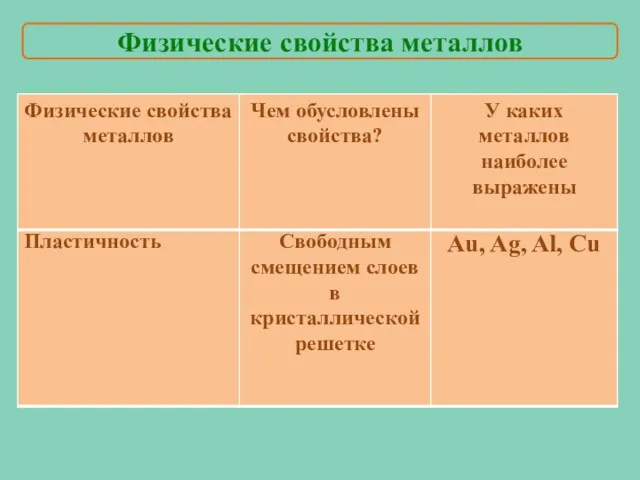
- 9. Металлы ковки и пластичны Физические свойства металлов
- 10. Физические свойства металлов
- 11. Физические свойства металлов
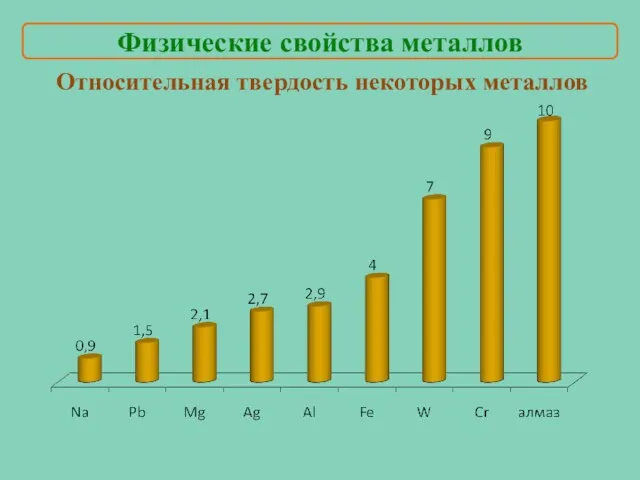
- 12. Относительная твердость некоторых металлов Физические свойства металлов
- 13. Температура плавления некоторых металлов Легкоплавкие Тугоплавкие Физические свойства металлов
- 14. Физические свойства металлов
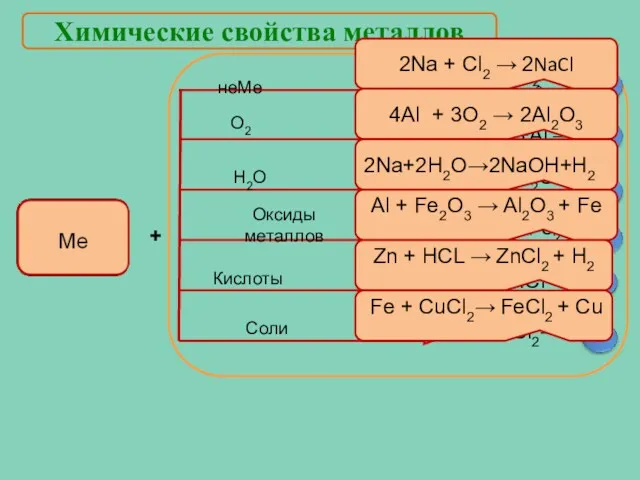
- 15. Химические свойства металлов + 2Na + Cl2 → 2NaCl 4Al + 3O2 → 2Al2O3 2Na+2Н2О→2NaOH+H2 Al
- 16. Особенности химических реакций металлов:
- 17. Взаимодействие металлов с кислотами M + HmAc → MxAcy + H2↑
- 18. Взаимодействие металлов с растворами солей M + M/xAcy → MxAcy + М/
- 19. Общие способы получения металлов Пирометаллургия – получение металлов и сплавов под действием высоких температур. Гидрометаллургия –
- 20. Общие способы получения металлов Пирометаллургия Восстановление углем (угарным газом): 2PbO + C = CO2 + 2Pb
- 21. Общие способы получения металлов Гидрометаллургия 1 стадия: растворение в кислоте нерастворимых минералов, содержащих металлы: CuS +
- 22. Общие способы получения металлов Электрометаллургия Электролиз расплавов: KCl → K+ + Cl─ катод (─) K+ +1e
- 23. Химическая Электрохимическая 4Fe + 6H2O + 3O2 = 4Fe(OH)3 Коррозия железа и образование ржавчины Коррозия железа
- 25. Скачать презентацию


















 Материалы с высокой удельной прочностью
Материалы с высокой удельной прочностью Химические реакторы. Лекция №6
Химические реакторы. Лекция №6 Простые вещества - металлы
Простые вещества - металлы ЕГЭ по химии, задание 2
ЕГЭ по химии, задание 2 Трифенилметановые красители
Трифенилметановые красители Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул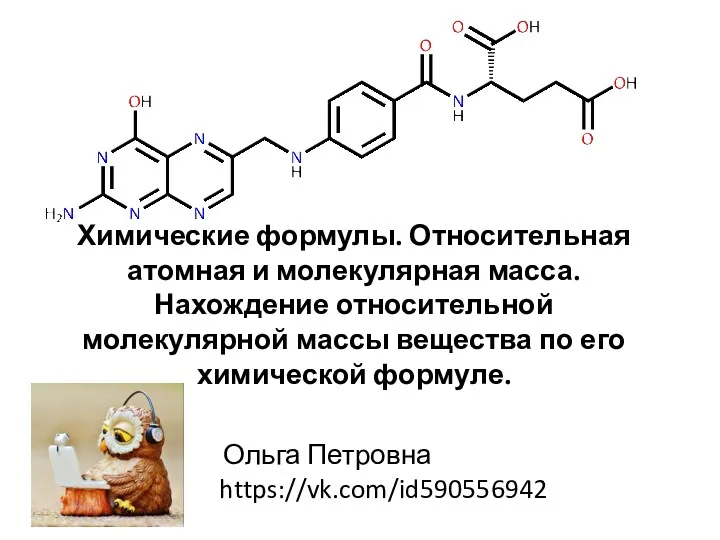 Химические формулы. Относительная атомная и молекулярная масса
Химические формулы. Относительная атомная и молекулярная масса Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Биогенді элементтер
Биогенді элементтер Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Электоролиз заңы
Электоролиз заңы Основы органической химии
Основы органической химии Металлы (урок для 8 класса)
Металлы (урок для 8 класса) Вклад М.В. Ломоносова в развитие химии
Вклад М.В. Ломоносова в развитие химии Амины
Амины Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Кислородсодержащие органические соединения (классификация и номенклатура)
Кислородсодержащие органические соединения (классификация и номенклатура) Подгруппа меди. Элементы 11 группы (Cu,Ag,Au)
Подгруппа меди. Элементы 11 группы (Cu,Ag,Au) Полимеры. Основные понятия
Полимеры. Основные понятия Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Техника безопасности на уроках химии
Техника безопасности на уроках химии Материаловедение-2
Материаловедение-2 Твердое состояние вещества. Кристаллические и аморфные тела
Твердое состояние вещества. Кристаллические и аморфные тела Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология