Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування презентация
- Главная
- Химия
- Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування

Содержание
- 7. Властивості речовин Властивості речовин
- 11. Багато хімічних елементів утворюють сполуки з Гідрогеном. Але характерною особливістю неметалічних елементів є те, що їхні
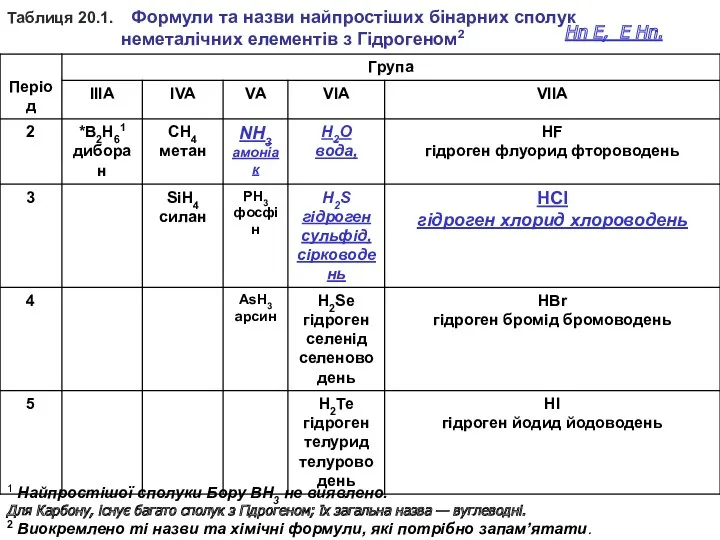
- 12. Таблиця 20.1. Формули та назви найпростіших бінарних сполук неметалічних елементів з Гідрогеном2 1 Найпростішої сполуки Бору
- 13. Сполуки неметалічних елементів з Гідрогеном безбарвні, деякі мають характерний запах — неприємний, іноді різкий. Багато цих
- 14. ФІЗИЧНІ ВЛАСТИВОСТІ АМОНІАКУ. Амоніак NH3 — газ без кольору, з різким запахом, токсичний. Вдихання його в
- 15. Будова. Сполуки неметалічних елементів з Гідрогеном складаються з молекул (див.мал.); атоми в них сполучені ковалентними зв’язками.
- 16. Водні розчини більшості летких сполук неметалічних елементів із Гідрогеном — це кислоти, амоніак і фосфін у
- 17. ОСОБЛИВОСТІ ВОДНОГО РОЗЧИНУ ГІДРОГЕН ХЛОРИДУ. Механізм розчинення гідроген хлориду НСl. Взаємодія гідроген хлориду з водою: Атом
- 18. 1 л води за нормальних умов (0 °С, 760 мм рт. ст.) розчиняється приблизно 500 л
- 19. Розчинення амоніаку у воді Під час розчинення, атом Нітрогену міцніше втримує атоми Гідрогену, ніж атом Оксигену.
- 20. Гідроген сульфід у водному розчині поводиться як дуже слабка кислота. Оксиген і Сульфур — елементи головної
- 21. Застосування гідроген хлориду, гідроген сульфіду, амоніаку зумовлено їхніми фізичними та хімічними властивостями. У повсякденному житті трапляється
- 22. Гідроген хлорид використовують в органічному синтезі для добування хлорорганічних сполук, а хлоридну кислоту - у хімічних
- 23. ПРО ГОЛОВНЕ Сполуки неметалічних елементів з Гідрогеном - молекулярні речовини з ковалентними полярними зв’язками. У найпростіших
- 24. ПІДСУМОВУЄМО ВИВЧЕНЕ • Елементи IV—VII груп періодичної системи утворюють леткі сполуки неметалічних елементів з Гідрогеном. •
- 25. Домашнє завдання. 1. Загальна формула сполуки ЕН3. До її складу входить Гідроген, масова частка якого становить
- 27. Скачать презентацию
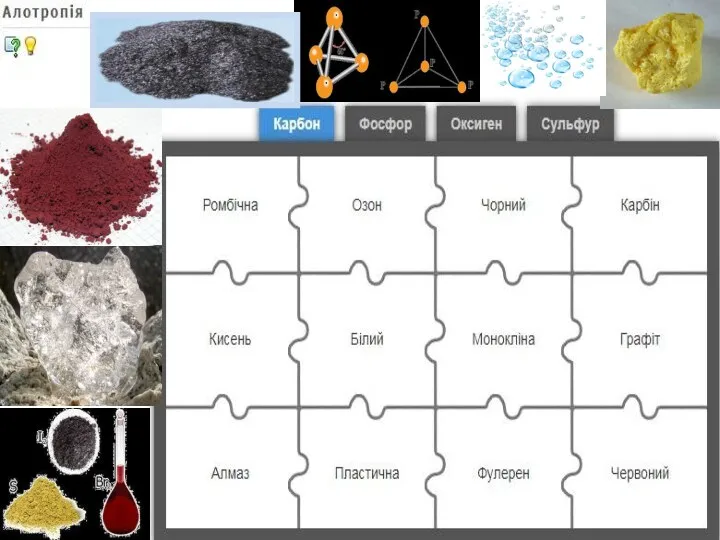
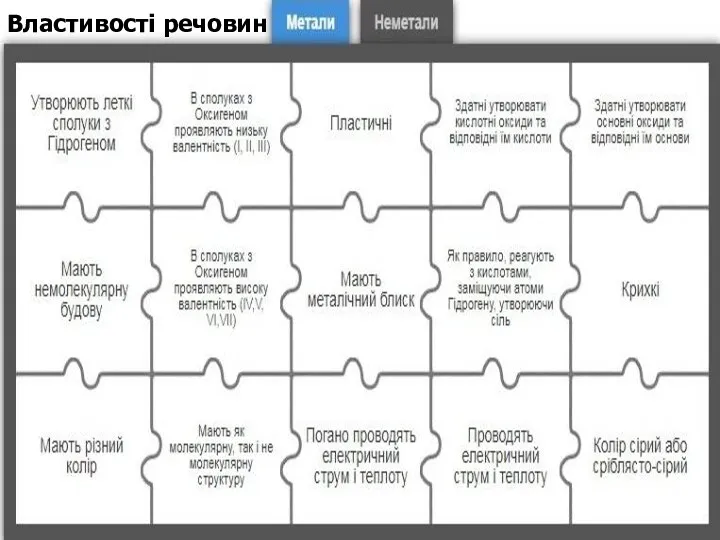
Властивості речовин
Властивості речовин
Властивості речовин
Властивості речовин
Багато хімічних елементів утворюють сполуки з Гідрогеном. Але характерною особливістю неметалічних
Багато хімічних елементів утворюють сполуки з Гідрогеном. Але характерною особливістю неметалічних
або газуватому агрегатному стані. ( гідроген хлорид HCl, амоніак NH3, гідроген сульфід H2S).
Завдання 1. Обчисліть відносну густину гідроген хлориду за повітрям. Як правильно зібрати цей газ у пробірку?
Завдання2. Математичними обчисленнями доведіть,
що збирати амоніак необхідно в пробірку, розташовану догори дном.
Нn Е, E Нn.
Таблиця 20.1. Формули та назви найпростіших бінарних сполук
неметалічних елементів
Таблиця 20.1. Формули та назви найпростіших бінарних сполук
неметалічних елементів
1 Найпростішої сполуки Бору ВН3 не виявлено.
Для Карбону, існує багато сполук з Гідрогеном; їх загальна назва — вуглеводні.
2 Виокремлено ті назви та хімічні формули, які потрібно запам’ятати.
Нn Е, E Нn.
Сполуки неметалічних елементів з Гідрогеном безбарвні, деякі мають характерний запах —
Сполуки неметалічних елементів з Гідрогеном безбарвні, деякі мають характерний запах —
Серед газоподібних речовин трапляються як добре розчинні у воді, так і погано розчинні.
Гази, що погано розчиняються у воді, можна збирати способом витіснення води (дивись мал., а).
• Добре розчинні у воді гази збирають лише способом витіснення повітря. Якщо газ легший за повітря, то посудину-приймач (пробірку, колбу) тримають догори дном (дивись мал., б), якщо важчий — навпаки (дивись мал., в).
ФІЗИЧНІ ВЛАСТИВОСТІ АМОНІАКУ.
Амоніак NH3 — газ без кольору, з різким запахом, токсичний.
ФІЗИЧНІ ВЛАСТИВОСТІ АМОНІАКУ.
Амоніак NH3 — газ без кольору, з різким запахом, токсичний.
ФІЗИЧНІ ВЛАСТИВОСТІ ГІДРОГЕН ХЛОРИДУ.
Гідрогенхлорид HCl — газ без кольору, з різким запахом, подразливо діє на дихальні шляхи, «димить» на повітрі через те, що з парами води, які завжди присутні в повітрі, утворює дрібні краплі хлоридної кислоти. Гідроген хлорид добре розчиняється у воді (за температури 20 °С приблизно 500 л гідроген хлориду розчиняється в 1 л води).
Будова. Сполуки неметалічних елементів з Гідрогеном складаються з молекул (див.мал.); атоми
Будова. Сполуки неметалічних елементів з Гідрогеном складаються з молекул (див.мал.); атоми
Якщо позитивні й негативні заряди, що виникли на атомах після зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4). В іншому випадку молекула в одній частині має невеликий негативний заряд, а в протилежній — позитивний заряд. Така молекула полярна; її називають диполем. Полярними є молекули HF, Н2О, NH3 (див.мал.) і деякі інші.
Мал. Масштабні моделі молекул НСІ, H2S, NH3 і СН4
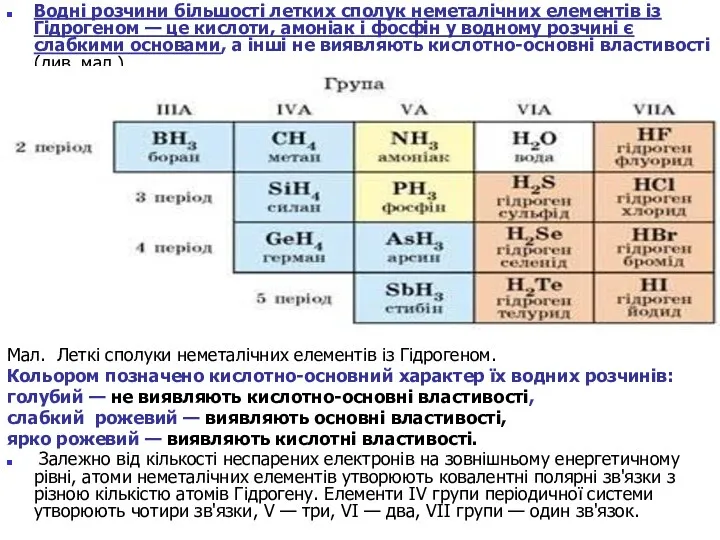
Водні розчини більшості летких сполук неметалічних елементів із Гідрогеном — це
Водні розчини більшості летких сполук неметалічних елементів із Гідрогеном — це
Мал. Леткі сполуки неметалічних елементів із Гідрогеном.
Кольором позначено кислотно-основний характер їх водних розчинів:
голубий — не виявляють кислотно-основні властивості,
слабкий рожевий — виявляють основні властивості,
ярко рожевий — виявляють кислотні властивості.
Залежно від кількості неспарених електронів на зовнішньому енергетичному рівні, атоми неметалічних елементів утворюють ковалентні полярні зв'язки з різною кількістю атомів Гідрогену. Елементи IV групи періодичної системи утворюють чотири зв'язки, V — три, VI — два, VII групи — один зв'язок.
ОСОБЛИВОСТІ ВОДНОГО РОЗЧИНУ ГІДРОГЕН ХЛОРИДУ.
Механізм розчинення гідроген хлориду НСl.
Взаємодія
ОСОБЛИВОСТІ ВОДНОГО РОЗЧИНУ ГІДРОГЕН ХЛОРИДУ.
Механізм розчинення гідроген хлориду НСl.
Взаємодія
Атом Оксигену з більшою силою притягує атоми Гідрогену. Під час розчинення йон Гідрогену відщеплюється від Хлору й завдяки наявності вільної електронної пари приєднується до Оксигену.
Утворюється йон Гідроксонію Н3О+.
Оксиген на утворення зв'язку віддав електронну пару, тому є донором, а йон Гідрогену — акцептором. Отже, механізм утворення ковалентного зв'язку в цьому випадку є донорно - акцепторним.
Якщо розчин гідроген хлориду у воді випробувати
індикатором лакмусом, то забарвлення індикатора
зміниться на червоне. Це вказує на те, що утворилася кислота.
Хлоридна кислота є водним розчином гідроген хлориду.
1 л води за нормальних умов (0 °С, 760 мм рт.
1 л води за нормальних умов (0 °С, 760 мм рт.
Для підтвердження високої розчинності хлороводню у воді й кислотних властивостей водного розчину цієї сполуки демонструють ефектний дослід. У посудину з водою додають кілька крапель розчину індикатора лакмусу або метилоранжу. Хлороводнем наповнюють колбу, додають у неї 1—2 краплі води, швидко закривають пробкою, в яку вставлена скляна трубка, і занурюють кінець трубки в посудину з розчином індикатора (див.мал.). Під час розчинення газу тиск у колбі знижується; рідина заповнює колбу, створюючи фонтан, і набуває червоного забарвлення.
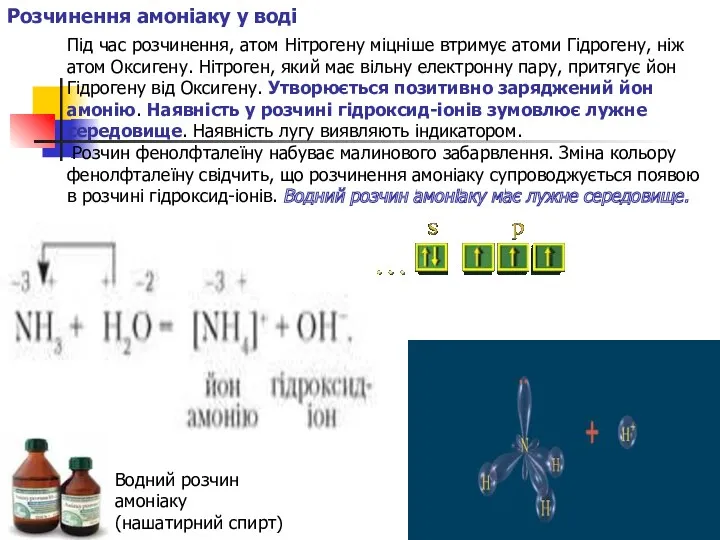
Розчинення амоніаку у воді
Під час розчинення, атом Нітрогену міцніше втримує
Розчинення амоніаку у воді
Під час розчинення, атом Нітрогену міцніше втримує
Розчин фенолфталеїну набуває малинового забарвлення. Зміна кольору фенолфталеїну свідчить, що розчинення амоніаку супроводжується появою в розчині гідроксид-іонів. Водний розчин амоніаку має лужне середовище.
Водний розчин амоніаку
(нашатирний спирт)
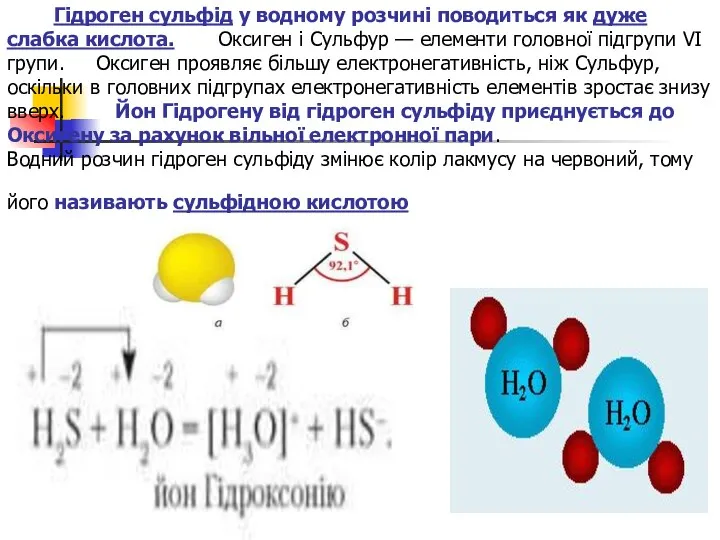
Гідроген сульфід у водному розчині поводиться як дуже слабка кислота.
Гідроген сульфід у водному розчині поводиться як дуже слабка кислота.
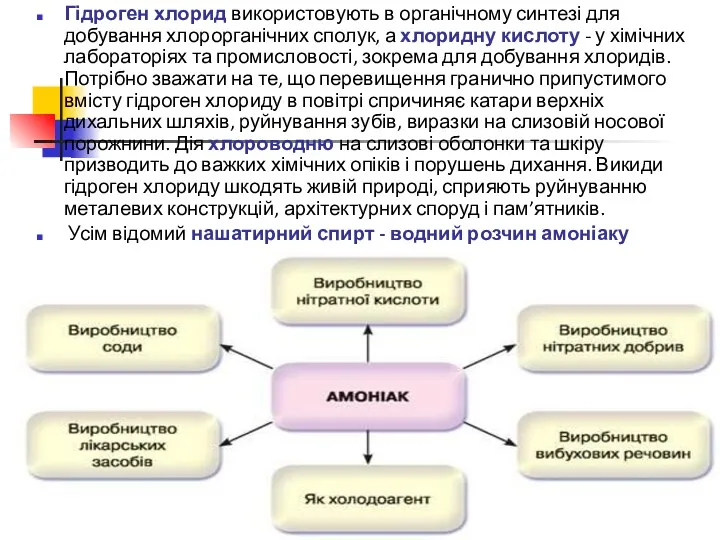
Застосування гідроген хлориду, гідроген сульфіду, амоніаку зумовлено їхніми фізичними та хімічними властивостями.
Застосування гідроген хлориду, гідроген сульфіду, амоніаку зумовлено їхніми фізичними та хімічними властивостями.
Для очищення від шару оксидів поверхню металів обробляють хлоридною кислотою. Реакцію між хлоридною кислотою та карбонатами Кальцію та Магнію геологи використовують для експрес-виявлення карбонат-іонів у складі мінералів. Сантехніки застосовують хлоридну кислоту для видалення накипу - карбонатів Кальцію та Магнію під час промивання системи парового опалення.
Гідроген хлорид використовують в органічному синтезі для добування хлорорганічних сполук, а
Гідроген хлорид використовують в органічному синтезі для добування хлорорганічних сполук, а
Усім відомий нашатирний спирт - водний розчин амоніаку
ПРО ГОЛОВНЕ
Сполуки неметалічних елементів з Гідрогеном - молекулярні речовини з
ПРО ГОЛОВНЕ
Сполуки неметалічних елементів з Гідрогеном - молекулярні речовини з
У найпростіших бінарних сполуках кількість атомів Гідрогену навколо атома неметалічного елемента дорівнює різниці між числом 8 і номером групи періодичної системи.
Амоніак і гідроген хлорид добре розчиняються у воді, а гідрогенсульфід - малорозчинна кислота.
У водному розчині амоніаку лужне середовище, водний розчин гідроген сульфіду - слабка сульфідна кислота, водний розчин гідроген хлориду - сильна хлоридна кислота.
Бінарні сполуки неметалічних елементів з Гідрогеном мають неабияке практичне значення.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Елементи IV—VII груп періодичної системи утворюють леткі сполуки неметалічних елементів з
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Елементи IV—VII груп періодичної системи утворюють леткі сполуки неметалічних елементів з
• Загальні формули летких сполук неметалічних елементів з Гідрогеном: ЕН4, ЕН3, Н2Е, НЕ. Ступені окиснення елементів у цих сполуках зростають від -4 до -1.
• Леткі сполуки неметалічних елементів з Гідрогеном загалом проявляють здатність розчинятися у воді. У періодах зліва направо властивості водних розчинів змінюються від основних до кислотних. У групах, зі зростанням радіусів атомів зверху вниз, кислотні властивості водних розчинів посилюються.
• Властивості водних розчинів летких сполук неметалічних елементів з Гідрогеном змінюються так: гідроген хлорид у водному розчині — сильна неорганічна кислота, гідроген сульфід — слабка кислота й амоніак — нестійка слабка основа.
• Сполуки неметалічних елементів з Гідрогеном набули застосування в різних галузях промислового виробництва України
ВИСНОВКИ
Майже всі неметалічні елементи, крім інертних, утворюють сполуки з Гідрогеном. Їх загальна формула — НnE або ЕНn. Для цих сполук найчастіше використовують тривіальні назви.
Сполуки неметалічних елементів із Гідрогеном мають молекулярну будову. Галогеноводні та амоніак дуже добре розчиняються у воді.
Домашнє завдання.
1. Загальна формула сполуки ЕН3.
До її складу
Домашнє завдання.
1. Загальна формула сполуки ЕН3.
До її складу
2. Складіть формули сполук неметалічних елементів,
утворених атомами: а) Карбону й Гідрогену; б) Йоду й Гідрогену.
Складіть рівняння їх одержання з простих речовин, розгляньте окисно-відновні процеси.
3. Поясніть, чому: а) амоніак збирають витісненням повітря в суху пробірку, розташовану отвором вниз, а гідроген хлорид - у суху пробірку, розташовану отвором догори; б) одним із заходів долікарської допомоги ураженому парою амоніаку є інгаляція слабким розчином лимонної або оцтової кислоти; в) коли людину вкусила мурашка, слід прикласти до місця укусу ватку, змочену водою, до якої добавлено трохи нашатирного спирту.
4. Перетворіть розповідні речення рубрики ПРО ГОЛОВНЕ на питальні. Чи можете ви відповісти на ці запитання без допомоги підручника?Які ваші відповіді.
5. Уявіть, що вам доручено написати до шкільної газети інформаційну замітку про практичне значення бінарних сполук неметалічних елементів з Гідрогеном. Випробуйте себе в ролі журналіста чи журналістки й зробіть це.

















 Строение и химические свойства кислот
Строение и химические свойства кислот Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Electrolysis
Electrolysis Массовая доля вещества в растворе
Массовая доля вещества в растворе Химический состав нефти
Химический состав нефти Склад і властивості нафти
Склад і властивості нафти Алкины. Гомологический ряд
Алкины. Гомологический ряд Эксплуатационные материалы
Эксплуатационные материалы Алкины
Алкины Каучук. Немного из истории
Каучук. Немного из истории Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння
Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння Лекция по химии
Лекция по химии Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Нанопористые материалы
Нанопористые материалы Зерттеу әдістері
Зерттеу әдістері Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14 Химические реакции. Реакции разложения
Химические реакции. Реакции разложения Круговорот воды в природе
Круговорот воды в природе Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Обмен нуклеопротеинов
Обмен нуклеопротеинов Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Азотная кислота
Азотная кислота Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Углепластики
Углепластики