Содержание
- 2. 1. Визначення матеріального балансу Матеріальний баланс реакції горіння – рівність між кількістю речовин, що вступають у
- 3. Горюча суміш, склад якої відповідає рівнянню реакції горіння, називається стехіометричною. Стехіометричний коефіцієнт β показує скільки молей
- 4. 2. Витрата повітря на горіння Під час горіння розрізняють питому та повну, теоретичну та дійсну кількість
- 5. Різниця між дійсною кількістю повітря для горіння і теоретично необхідною називається надлишком повітря. Δnп = nп
- 6. кінетичне горіння α = 1 - суміш горючої речовини з повітрям є стехіометричною. α α >
- 7. дифузійне горіння При дифузійному горінні кисень повітря повністю не витрачається. Полум’яне горіння припиняється за зменшення вмісту
- 8. 3. Продукти горіння. Дим та його властивості. Продукти горіння – це газоподібні, тверді та рідкі речовини,
- 9. Дим - дисперсна система, що складається з твердих і рідких часток (дисперсної фази), завислих у газовому
- 10. 4. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ
- 11. 4.1. Горіння ГОРЮЧОГО ГАЗУ індивідуального складу 1 кмоль газу за даних Р і Т займає об’єм
- 12. Якщо ГР і повітря знаходяться за однакових умов, то VµГР = Vµ п. питомі об’єми повітря
- 14. 4.2 Горюча речовина інд. складу у РІДКОМУ АБО ТВЕРДОМУ агрегатному стані 1 кмоль ГР важить μ
- 16. 4.3. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ СУМІШІ ГАЗІВ ВИЗНАЧЕННЯ ОБ’ЄМУ ПОВІТРЯ: питомий теоретичний об’єм: vоп
- 17. Визначення об’єму продуктів згоряння суміші газів Питомий теоретичний об’єм: vопг сум =Σ vопг i·ri , м3/м3
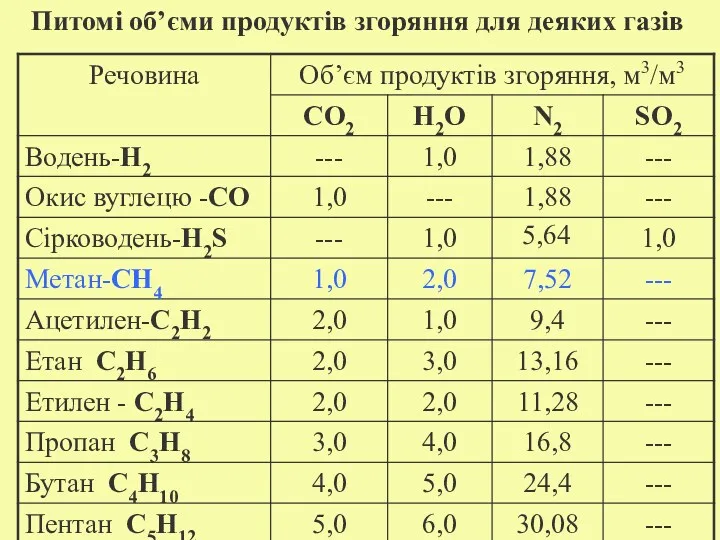
- 18. Питомі об’єми продуктів згоряння для деяких газів
- 19. 4.4. РОЗРАХУНОК ОБ’ЄМУ ПОВІТРЯ ТА ПРОДУКТІВ ЗГОРЯННЯ ПРИ ГОРІННІ СКЛАДНИХ РЕЧОВИН В КОНДЕНСОВАНОМУ СТАНІ Визначення об’єму
- 20. питомі об’єми повітря для водню і сульфуру voп (Н) = 4,76·0,5·Vμ /2, м3/ кг voп (S)
- 21. Визначення об’єму продуктів горіння питомий теоретичний об’єм С + О2 + 3,76N2 = СО2 + 3,76N2
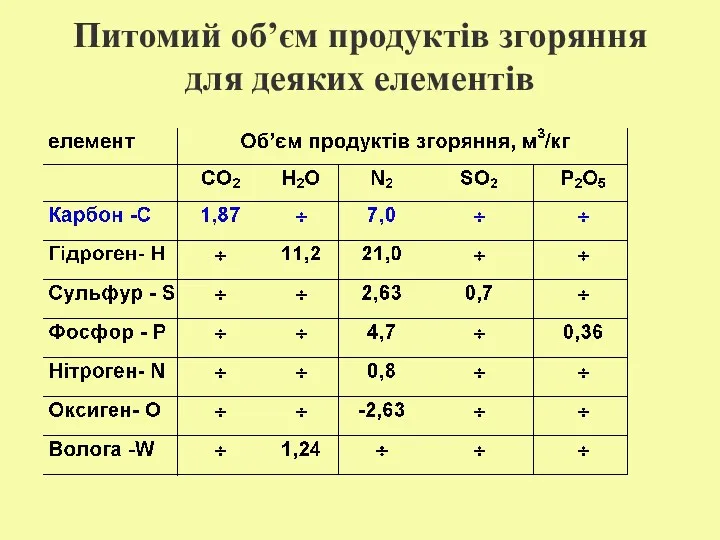
- 22. Питомий об’єм продуктів згоряння для деяких елементів
- 24. Скачать презентацию



















 Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Каталитические превращения углеводородов и других компонентов нефти
Каталитические превращения углеводородов и других компонентов нефти Растворы ВМС
Растворы ВМС Резина. Свойства резины
Резина. Свойства резины Кристаллические решетки. (8 класс)
Кристаллические решетки. (8 класс) Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури
Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури Соли. Названия солей
Соли. Названия солей Соединения щелочных металлов
Соединения щелочных металлов Дисперсные системы и растворы
Дисперсные системы и растворы Витаминные препараты
Витаминные препараты Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Разбор сложных заданий ЕГЭ по химии
Разбор сложных заданий ЕГЭ по химии Химическое образование в современной средней (полной) общеобразовательной школе
Химическое образование в современной средней (полной) общеобразовательной школе Химический элемент хлор
Химический элемент хлор Получение кислот
Получение кислот Электрохимические накопители энергии
Электрохимические накопители энергии Хімічні властивості кислот
Хімічні властивості кислот Aditivii alimentari: inofensivi sau poluanţi
Aditivii alimentari: inofensivi sau poluanţi Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Топливо. Виды топлива
Топливо. Виды топлива Третья группа, главная подгруппа. 9 класс
Третья группа, главная подгруппа. 9 класс Получение и химические свойства оснований
Получение и химические свойства оснований Соли. 11 класс
Соли. 11 класс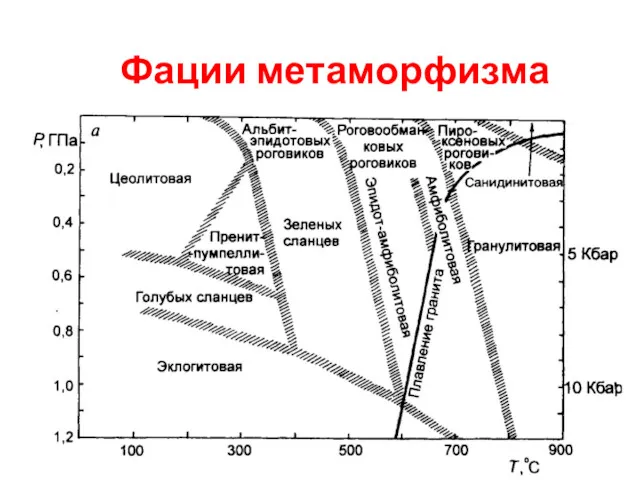 Фации метаморфизма
Фации метаморфизма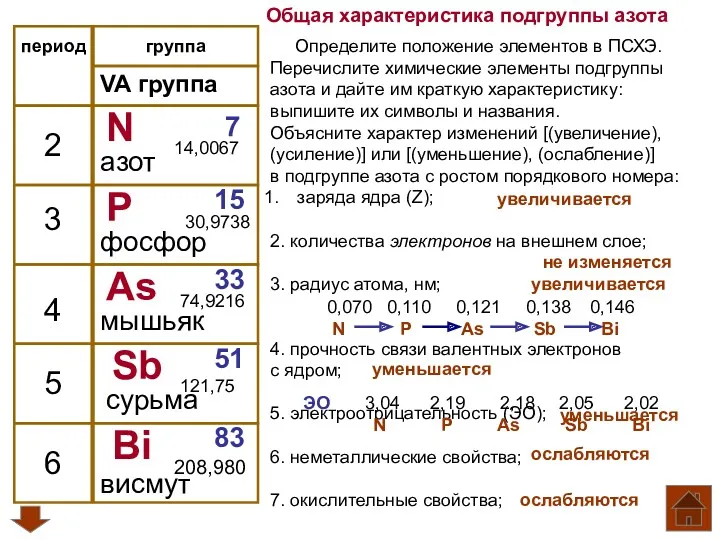 Общая характеристика подгруппы азота
Общая характеристика подгруппы азота Инертные газы
Инертные газы Интеллектуальная игра Химический пентагон
Интеллектуальная игра Химический пентагон