Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе презентация
Содержание
- 3. План. Проблема. Историческая справка. Химический элемент. Простое вещество. Химические свойства. Применение. Круговорот азота.
- 4. Проблема. «Безжизненный» Элемент жизни
- 5. Историческая справка. В 1772 году выделен из воздуха Даниэлем Резерфордом. Не поддерживал горение, дыхание. В 1787
- 6. Химический элемент. Природные изотопы: 14N(99 ,6%) 15N(0 ,04%) Входит в состав: NaNO3 натриевой(чилийской) селитры, Белков и
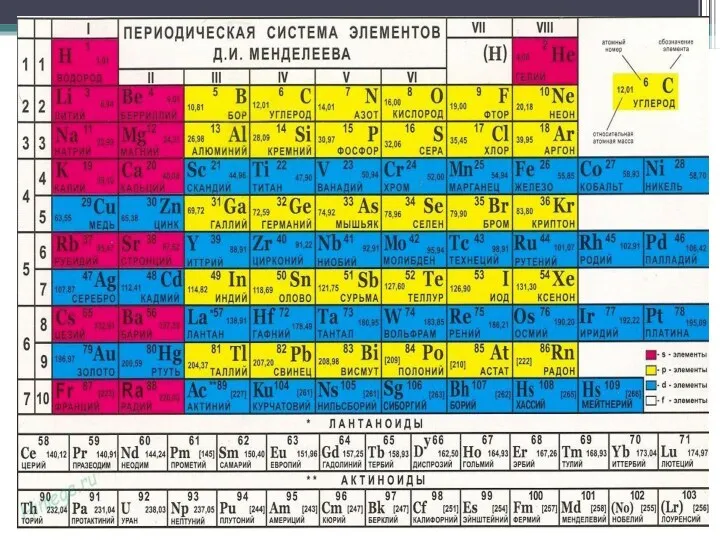
- 7. Азот. Порядковый номер 7. 2 период 5 группа, главная подгруппа.
- 8. Строение азота Символ: N Строение атома и молекулы азота: Элемент II периода группы VA. Заряд ядра
- 9. Нахождение в природе. В природе существуют два стабильных изотопа азота: с массовым числом 14 (99,635%) и
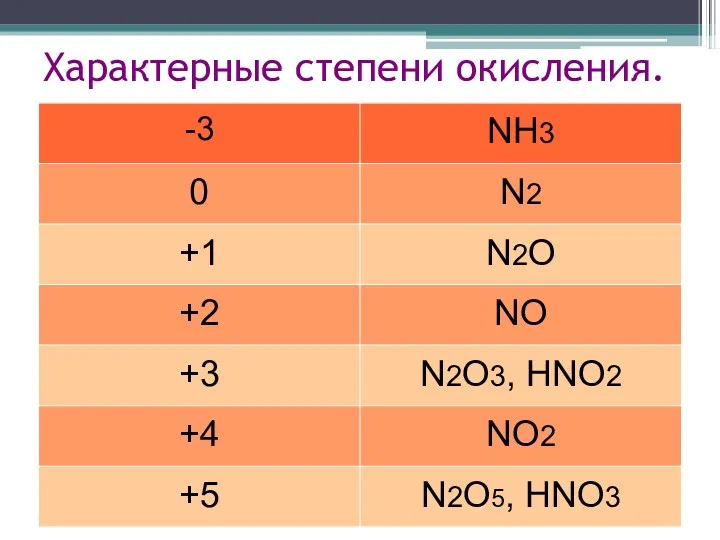
- 10. Характерные степени окисления.
- 11. Простое вещество. Азот-газ, без цвета, без запаха, легче воздуха, плохо растворим в воде. t(с.)=-195,8; t(зам.)=-210. Входит
- 12. Физические свойства азота. При обычных условиях газ, без цвета, запаха, вкуса. Плотность по воздуху: Dвоздух(N2) =
- 13. Химические свойства азота. Очень инертен. Вступает в химические реакции в жестких условиях. 1) При обычных условиях
- 14. Химические свойства. Восстановительные. O2 +N2 2NO оксид азота Окислительные. 6Li +N2 =2Li3N нитрид 3H2 +N2 2NH3
- 15. Применение. Для охлаждения. Для создания инертной среды. Получение удобрений.
- 16. Применение азота.
- 18. 1. Число электронов в атоме азота 1) 7 3) 9 2) 14 4) 12 2. Число
- 19. 4. Степень окисления азота в соединениях N2O5, NH3 соответственно равна 1) +2 и -3 3) +5
- 20. 6 Верны ли следующие суждения о свойствах азота? А. Азот бесцветный газ без вкуса и запаха.
- 22. Скачать презентацию

















 Геохимия природных процессов
Геохимия природных процессов Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Алканы
Алканы Способы раскисления и модифицирования стали
Способы раскисления и модифицирования стали Ионоселективные электроды
Ионоселективные электроды План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Полисахариды. Крахмал
Полисахариды. Крахмал Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Начала органической химии
Начала органической химии Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические и физические свойства кремния
Химические и физические свойства кремния Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Минералы. Свойства минералов
Минералы. Свойства минералов Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас)
Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас) Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Способы выражения концентрации растворов
Способы выражения концентрации растворов Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Алкадиены (диены)
Алкадиены (диены) Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки