Содержание
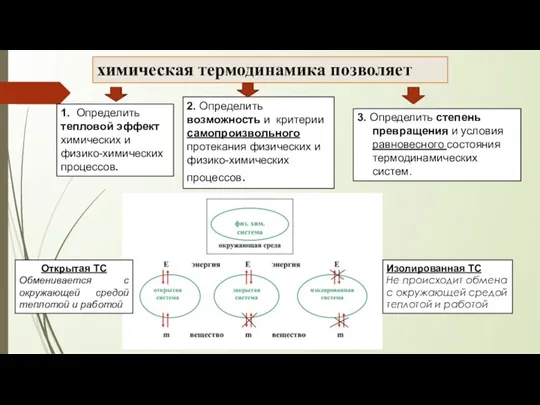
- 2. 3. Определить степень превращения и условия равновесного состояния термодинамических систем. химическая термодинамика позволяет 1. Определить тепловой
- 3. Основные понятия – функции, зависящие от промежуточных значений. (ТС) – отдельное тело или группа тел, состоящих
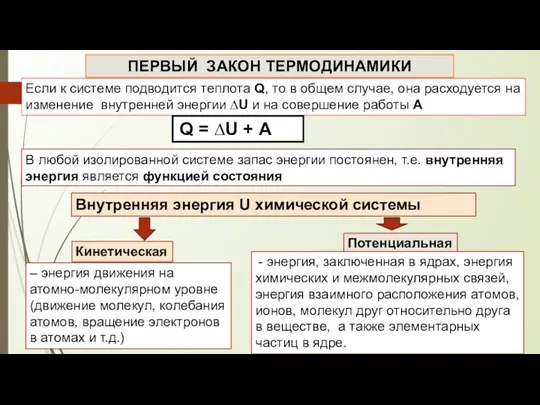
- 4. Если к системе подводится теплота Q, то в общем случае, она расходуется на изменение внутренней энергии
- 5. Применение первого закона термодинамики ( Q = ∆U + А) к различным процессам. 1. Изохорные процессы.
- 6. 3. Изобарные процессы. р =const, ∆р=0, QР = U2 – U1 + р(V2 – V1)= U2
- 7. Энтальпия H являетя энергетическим фактором и отражает изменение энергии взаимодействия между молекулами и стремление системы к
- 8. Энтальпия образования простых веществ и катиона водорода в водном растворе принята равной нулю Стандартная энтальпия образования
- 9. Тепловые эффекты некоторых процессов фазовых переходов – от единиц до десятков кДж/моль растворения – десятки кДж/моль
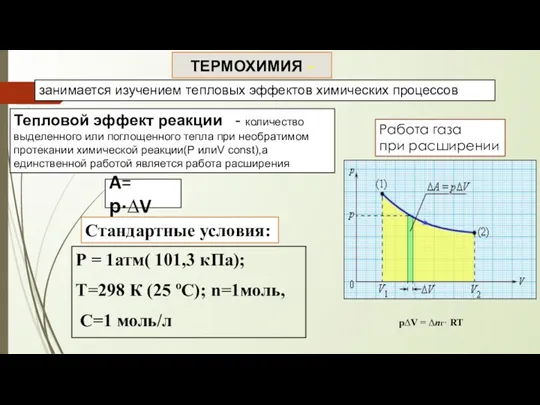
- 10. ТЕРМОХИМИЯ - Тепловой эффект реакции - количество выделенного или поглощенного тепла при необратимом протекании химической реакции(Р
- 11. Термохимические (термодинамические) уравнения – уравнения химических реакций с указанием агрегатных состояний реагентов и теплового эффекта реакции
- 12. Законы термохимии Закон Лавуазье-Лапласса(1780 г.) Закон Гесса (1840 г.) Следствия из закона Гесса В основе термохимических
- 13. Тепловой эффект реакции равен разности сумм энтальпий образования продуктов и исходных веществ реакций с учетом их
- 14. Вычисление энтальпии образования вещества ΔHобр-? UO2 3 U(тв)+4O2 → U3O8(тв), ΔH01= -3575 кДж 3UO2(тв)+ O2(г) →
- 15. Вычисление энергии связи Энергия связи - это доля энтальпии реакции диссоциации 1 моля газообразного вещества на
- 16. Решение Первое уравнение записываем в обратном направлении и меняем знак энтальпии на противоположный Суммируем три уравнения
- 17. Изменение энтальпии ΔH системы не может служить единственным критерием самопроизвольного осуществления химической реакции, т.к. многие эндотермические
- 18. Энтропия S [Дж/(моль · К)] - мера статистического беспорядка в замкнутой термодинамической системе. R = 8,31
- 19. постулат Планка(третий закон термодирамики): энтропия идеального кристаллического тела при абсолютном нуле равна нулю S =0, поскольку
- 20. Чем большеW, тем больше S Твердое вещество Жидкость Газ Max S Min S 2KClO3 (тв)→ 2KCl(тв)
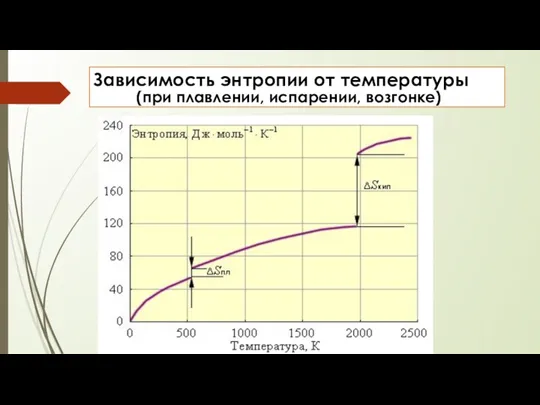
- 21. Зависимость энтропии от температуры (при плавлении, испарении, возгонке)
- 22. агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию
- 23. Зависимость значения энтропии от агрегатного состояния молекулы образуют упорядоченные структуры во всем объеме кристалла 1 –
- 24. Зависимость значения энтропии от массы вещества Связь энтропии с числом частиц
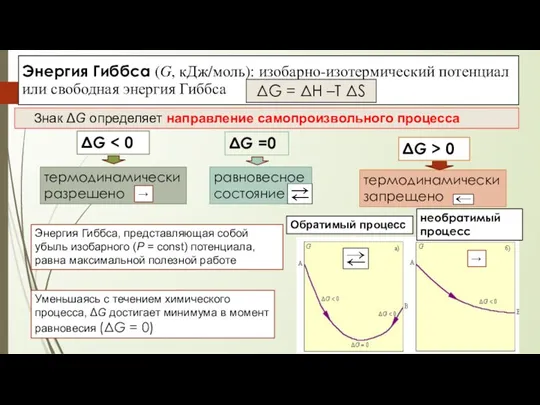
- 25. Энергия Гиббса G Суммарное влияние одновременного стремления системы перейти в состояние с наименьшей энергией (выделить теплоту,
- 26. Энергия Гиббса, представляющая собой убыль изобарного (P = const) потенциала, равна максимальной полезной работе Уменьшаясь с
- 27. При комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии ΔH
- 28. Стандартная энергия Гиббса образования вещества ΔG0обр.,298 (кДж/моль) Н2O (г) H2S(г) H2Se(г) ΔG0 обр, 298 - 228,45
- 29. Расчет свободной энергии Гиббса в химических реакциях (∆Gор-ции) ∆Gообр. - стандартная из справочника 1способ: ∆Gореакции =
- 30. фазовые переходы и реакции термического разложения Разложение будет наблюдаться при температурах, равных и больше чем температура,
- 31. Пример вычисления температуры протекания реакции С(граф)+H2O(г)=CO(г)+ H2(г) ΔH0реакции=∑٧jΔH0j- ∑٧iΔH0i=-113+242=129 кДж; ΔSреакции= ∑٧jS0j- ∑٧iS0i=196,6+129,7-(5,9+188,7)==131,7 Дж/град*моль ΔG=129000-131,7T T=1000
- 35. Скачать презентацию













![Энтропия S [Дж/(моль · К)] - мера статистического беспорядка в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/611736/slide-17.jpg)













 Правила роботи на уроці
Правила роботи на уроці Взрывоопасные грузы
Взрывоопасные грузы Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Обмен нуклеотидов
Обмен нуклеотидов Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Классификация химических реакций по тепловому эффекту
Классификация химических реакций по тепловому эффекту Кислоты, их классификация и свойства. 8 класс
Кислоты, их классификация и свойства. 8 класс Химиялық жарыс кеші
Химиялық жарыс кеші Основные виды и понятия курса органической химии в старшей школе
Основные виды и понятия курса органической химии в старшей школе Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Классификация химических реакций
Классификация химических реакций Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Производство полимеров
Производство полимеров Химические свойства альдегидов
Химические свойства альдегидов Алкины. Характеристика тройной связи
Алкины. Характеристика тройной связи Биохимия
Биохимия Галогены. 9 класс
Галогены. 9 класс Производство синтетической нефти
Производство синтетической нефти Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Сложные эфиры. Жиры
Сложные эфиры. Жиры Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Способы выражения состава растворов
Способы выражения состава растворов Кислородсодержащие соединения. Тема 1: спирты
Кислородсодержащие соединения. Тема 1: спирты Амины. Номенклатура аминов
Амины. Номенклатура аминов