Содержание
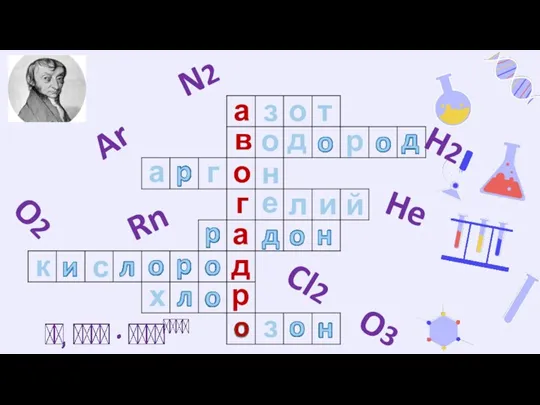
- 2. Шаблоны презентаций с сайта presentation-creation.ru з а о т в о о д р а г
- 3. Тема урока: «Закон Авогадро. Молярный объем газов»
- 4. Цель: изучение закона Авогадро, формирование умения вести расчеты по химическим формулам, Шаблоны презентаций с сайта presentation-creation.ru
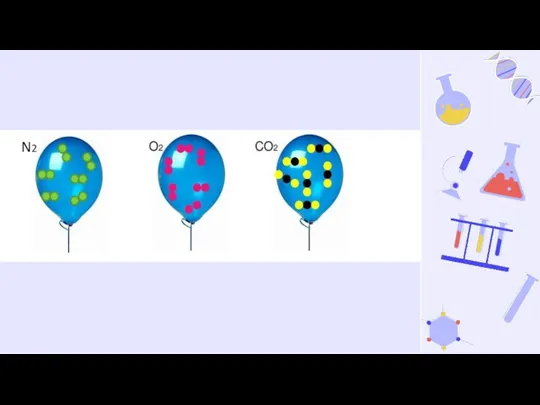
- 5. «В … объемах … газов при одинаковых условиях (температуре и давлении) содержится … число молекул» Шаблоны
- 6. N2
- 7. «В … объемах … газов при одинаковых условиях (температуре и давлении) содержится … число молекул» одинаковых
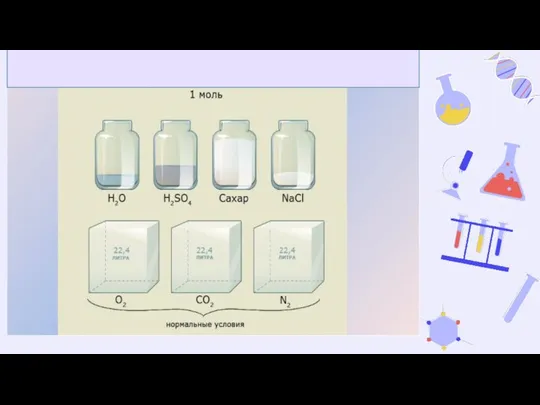
- 9. Одинаковый объём равен 22,4 л. Такой объём называется молярным объёмом и обозначается Vm Молярный объём Vm
- 10. Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества: n = V/Vm = N/Na =
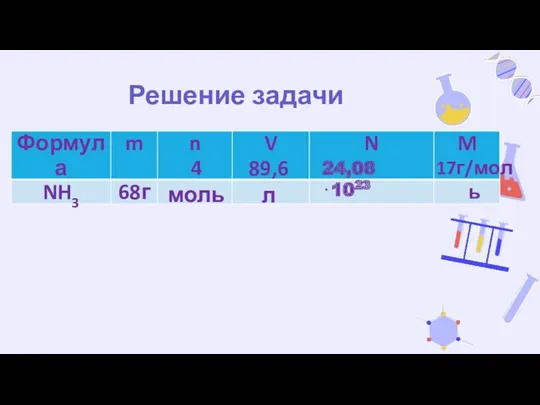
- 11. Решение задачи 4 моль 89,6 л 24,08⋅1023 17г/моль
- 12. -Что нового изучили? -Какова была цель урока? Достигли ли её? -Какие возникали сложности при решении задач?
- 13. Зеленая колба – понял и могу объянить другому. Сиреневая колба – понял объяснить не могу, могу
- 15. Скачать презентацию








 Острая сердечная недостаточность
Острая сердечная недостаточность Honig, wir töten Kinder
Honig, wir töten Kinder Ремонт вала привода ткацкого станка
Ремонт вала привода ткацкого станка Изъятие земельного участка, который не используется по целевому назначению
Изъятие земельного участка, который не используется по целевому назначению Война во Вьетнаме 1 ноября 1957 - 30 апреля 1975
Война во Вьетнаме 1 ноября 1957 - 30 апреля 1975 Готичний стиль. Розвиток культури в епоху Середньовіччя
Готичний стиль. Розвиток культури в епоху Середньовіччя Презентация Кушнурская школа в годы Великой Отечественной войны
Презентация Кушнурская школа в годы Великой Отечественной войны Эффективность деятельности кадровой службы организации
Эффективность деятельности кадровой службы организации Альтернативная гражданская служба
Альтернативная гражданская служба Как появляются бабочки
Как появляются бабочки Новогодняя почта
Новогодняя почта Question words
Question words Формирование ритмико - мелодико - интонационной основы языка у детей с ТНР
Формирование ритмико - мелодико - интонационной основы языка у детей с ТНР Когнитивный подход А.Бека в психологической коррекции
Когнитивный подход А.Бека в психологической коррекции Презентация Вредно ли сладкое для зубов?
Презентация Вредно ли сладкое для зубов? В гостях у пряника
В гостях у пряника Prezentatsia_bez_nazvania
Prezentatsia_bez_nazvania MS Excel: основы работы
MS Excel: основы работы Теоретические основы реструктуризации
Теоретические основы реструктуризации Grade can we speak to rik morell
Grade can we speak to rik morell календарный план на один день ФГОС
календарный план на один день ФГОС История возникновения проблемы фирменного стиля
История возникновения проблемы фирменного стиля Вирощування ВРХ
Вирощування ВРХ Тема урока: Механическое движение. Материальная точка. Система отсчета. Координаты
Тема урока: Механическое движение. Материальная точка. Система отсчета. Координаты Сказание о Кише. Джек Лондон
Сказание о Кише. Джек Лондон Шаблоны для презентаций - 2
Шаблоны для презентаций - 2 Техника сварки под флюсом соединений угловых швов
Техника сварки под флюсом соединений угловых швов кроссворд по русскому языку
кроссворд по русскому языку