Содержание
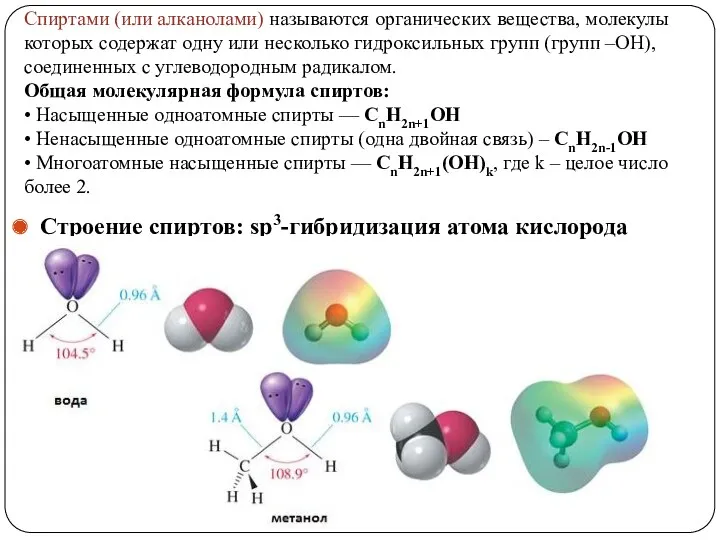
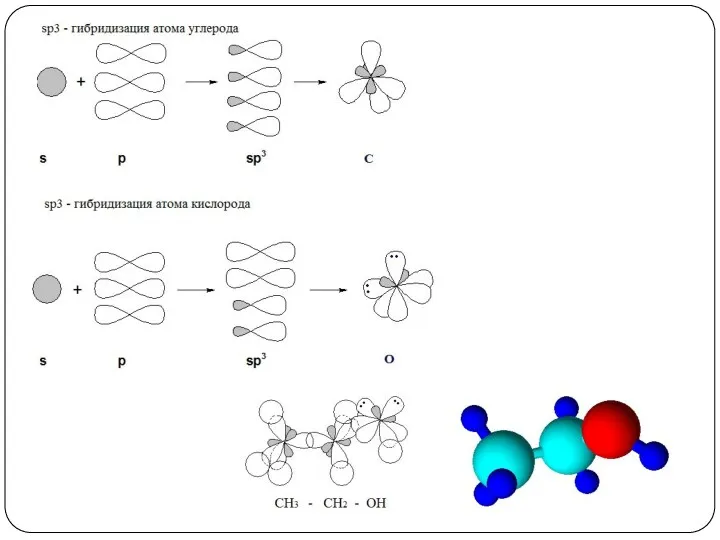
- 2. Спиртами (или алканолами) называются органических вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп –ОН),
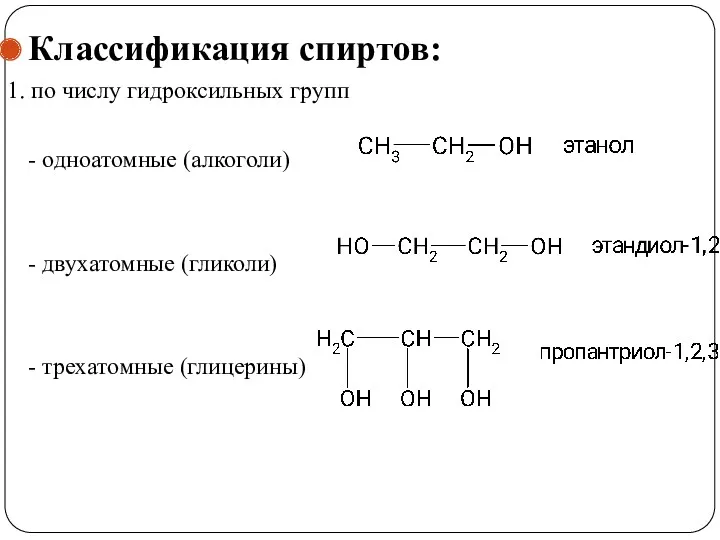
- 4. Классификация спиртов: 1. по числу гидроксильных групп - одноатомные (алкоголи) - двухатомные (гликоли) - трехатомные (глицерины)
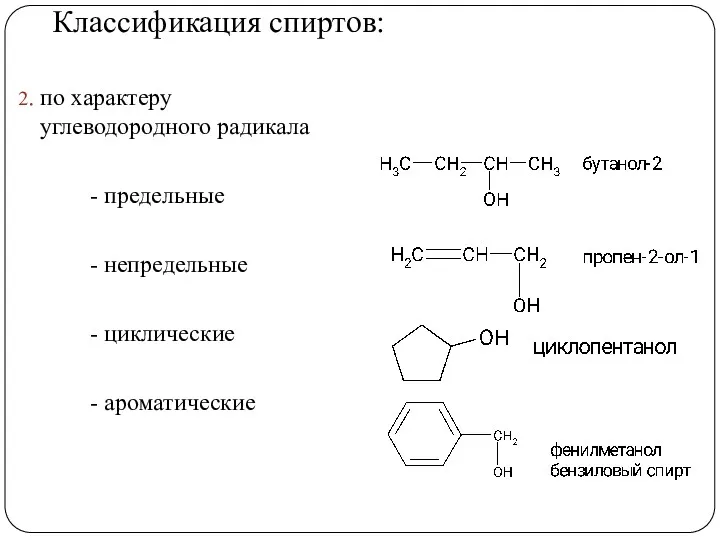
- 5. Классификация спиртов: 2. по характеру углеводородного радикала - предельные - непредельные - циклические - ароматические
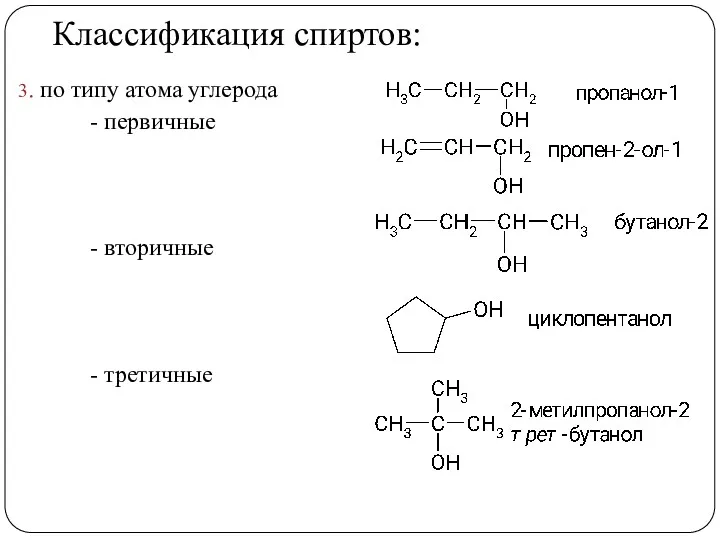
- 6. Классификация спиртов: 3. по типу атома углерода - первичные - вторичные - третичные
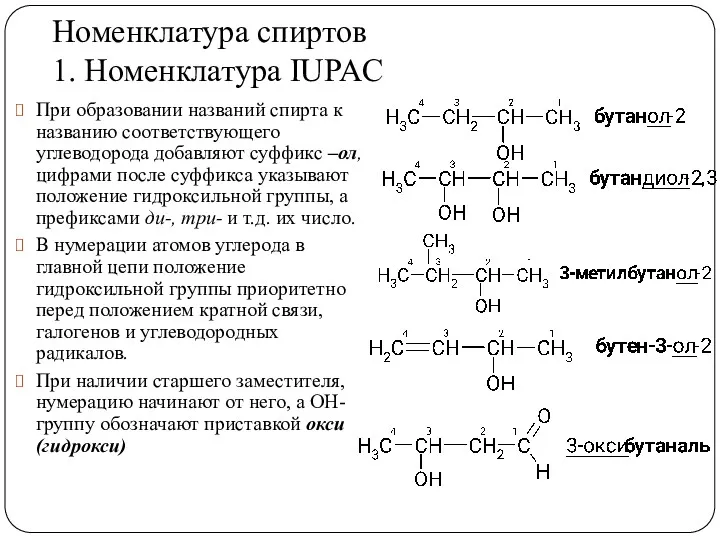
- 7. Номенклатура спиртов 1. Номенклатура IUPAC При образовании названий спирта к названию соответствующего углеводорода добавляют суффикс –ол,
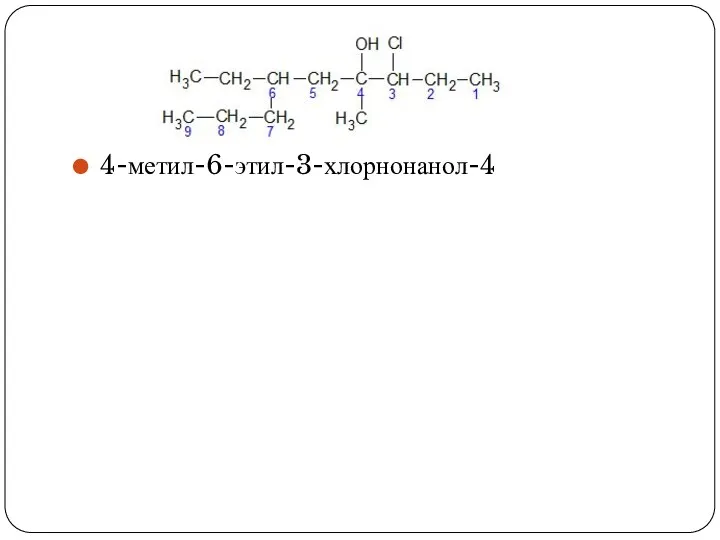
- 8. 4-метил-6-этил-3-хлорнонанол-4
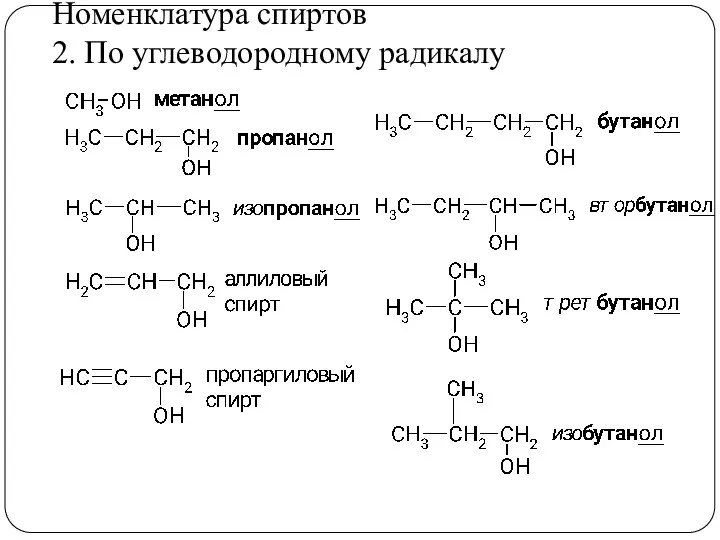
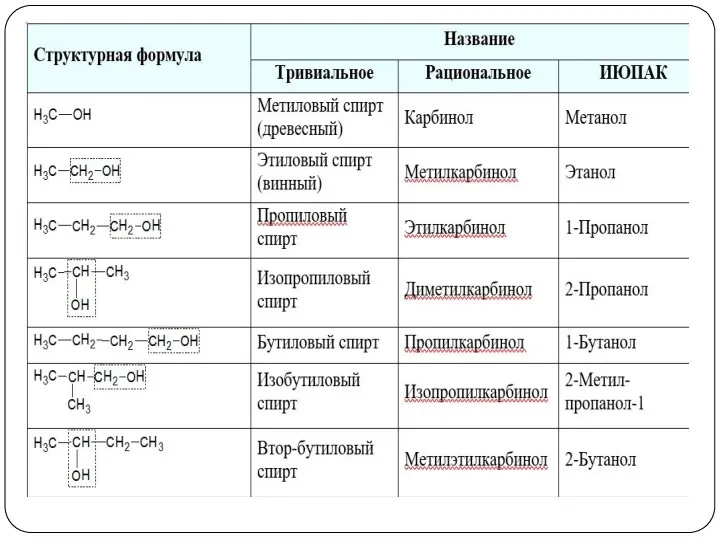
- 9. Номенклатура спиртов 2. По углеводородному радикалу
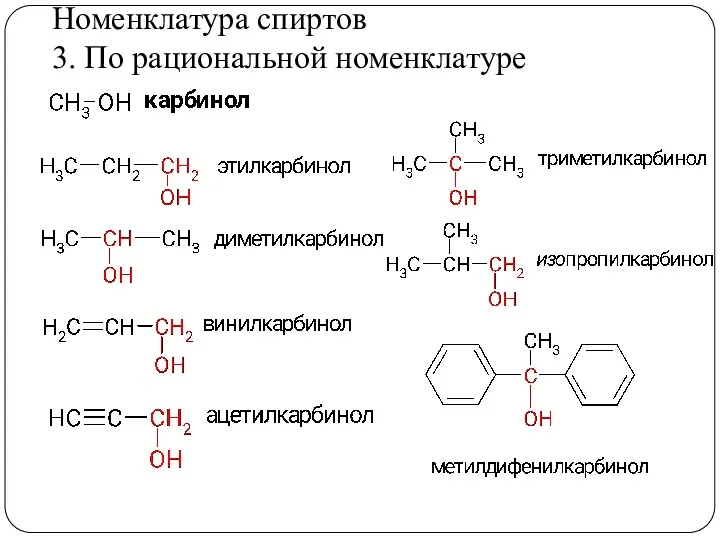
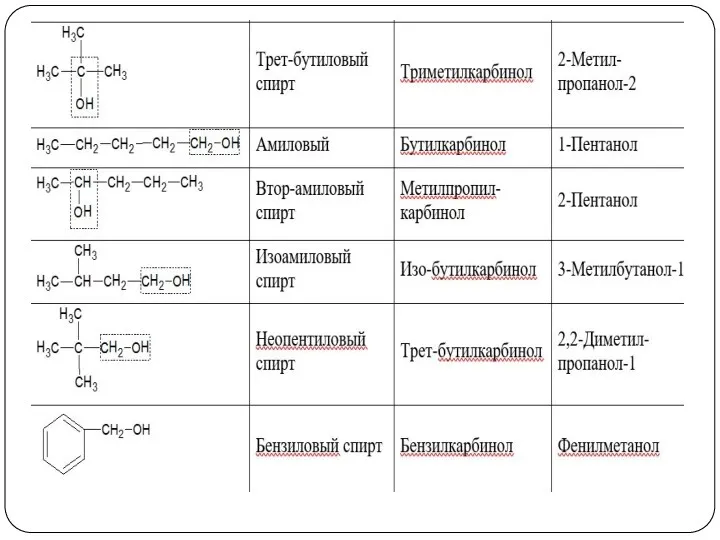
- 10. Номенклатура спиртов 3. По рациональной номенклатуре
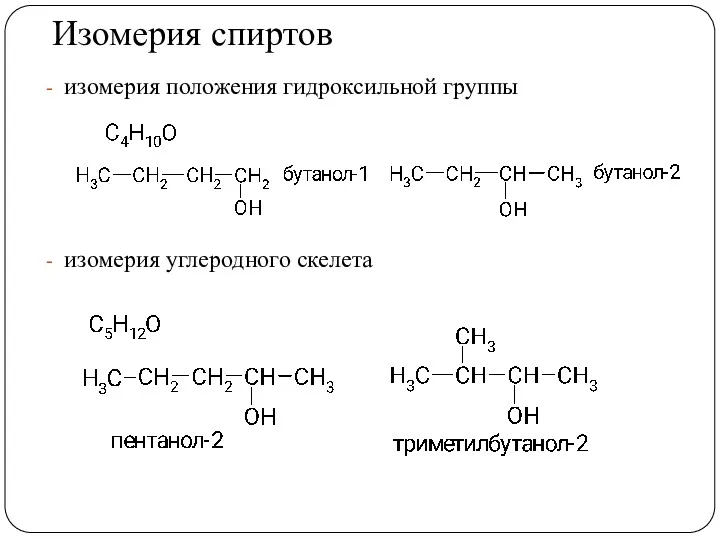
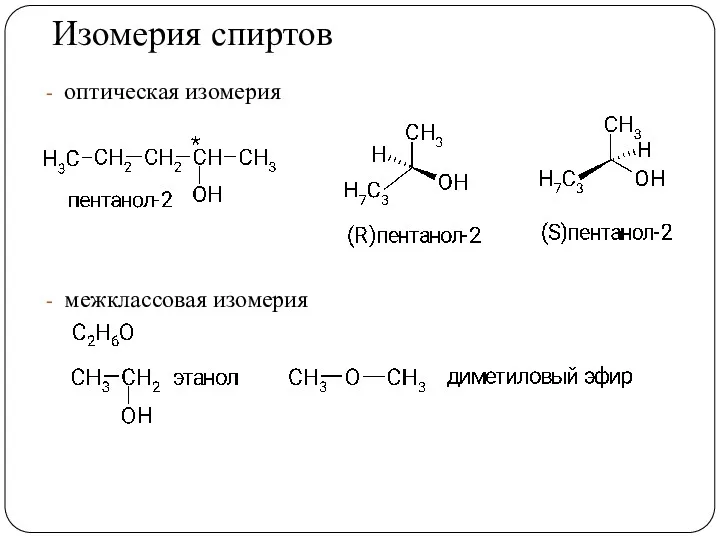
- 13. Изомерия спиртов изомерия положения гидроксильной группы изомерия углеродного скелета
- 14. Изомерия спиртов оптическая изомерия межклассовая изомерия
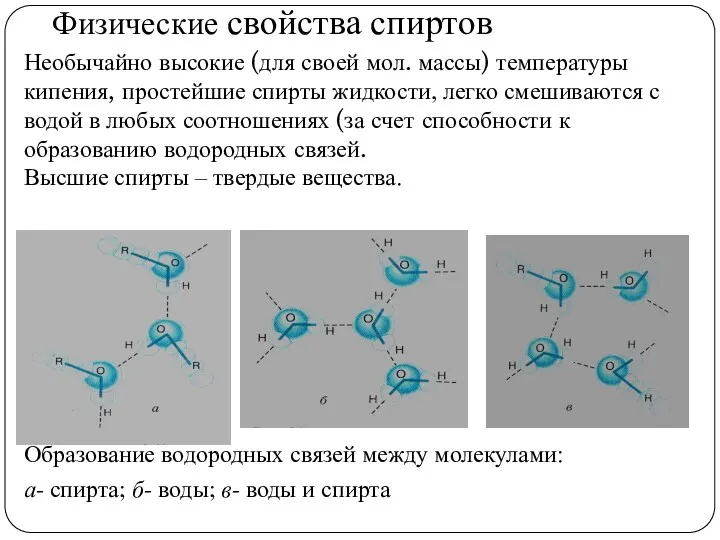
- 15. Физические свойства спиртов Необычайно высокие (для своей мол. массы) температуры кипения, простейшие спирты жидкости, легко смешиваются
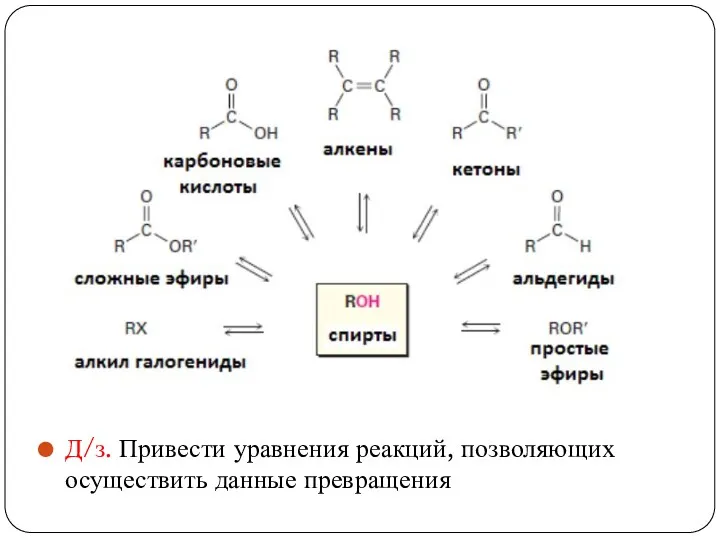
- 16. Д/з. Привести уравнения реакций, позволяющих осуществить данные превращения
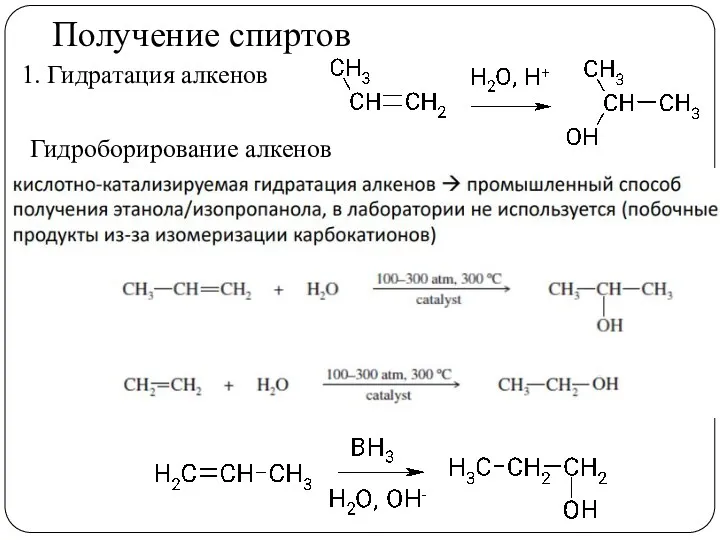
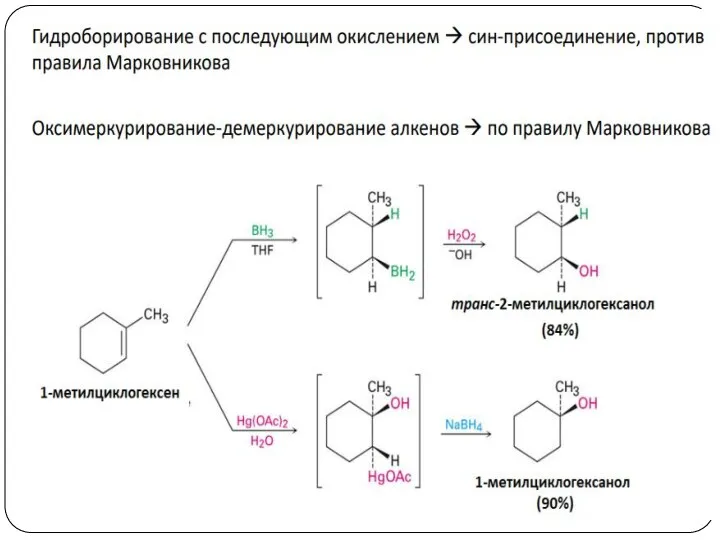
- 17. Получение спиртов 1. Гидратация алкенов Гидроборирование алкенов
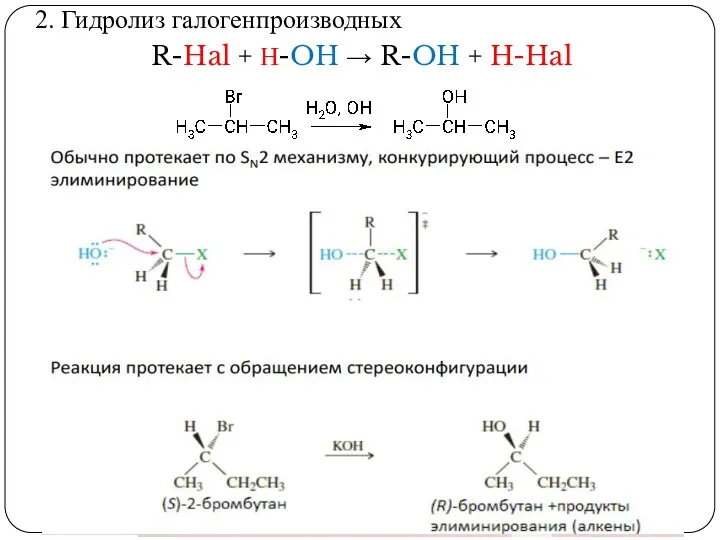
- 19. 2. Гидролиз галогенпроизводных R-Hal + Н-OH → R-OH + H-Hal
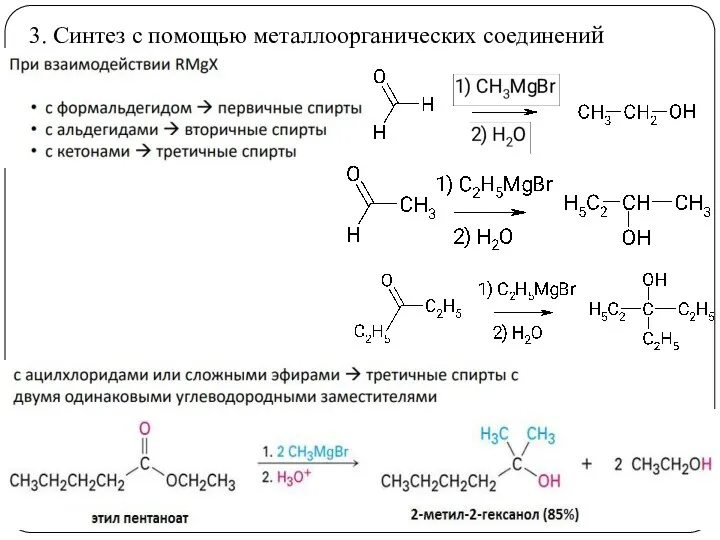
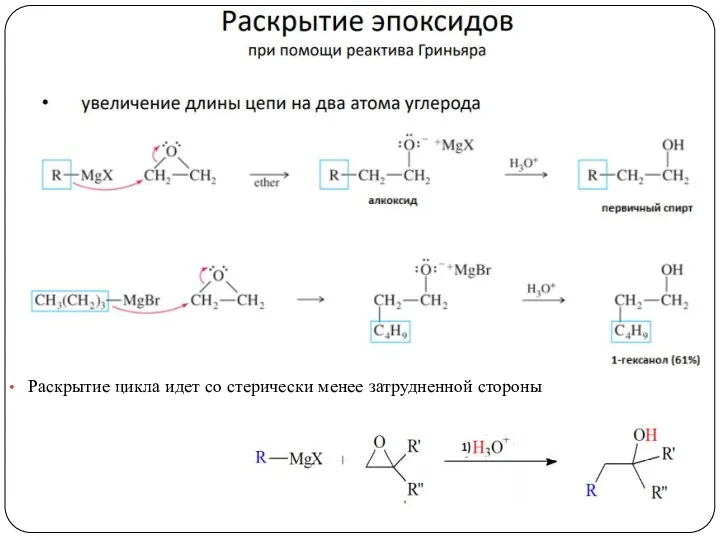
- 20. 3. Синтез с помощью металлоорганических соединений
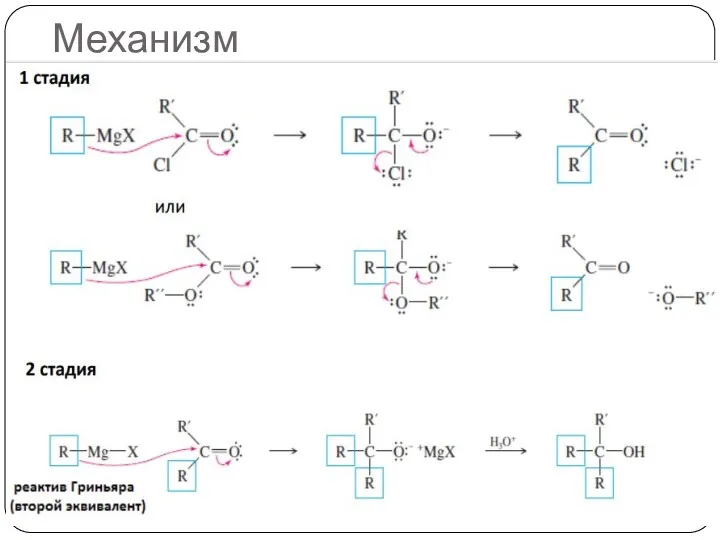
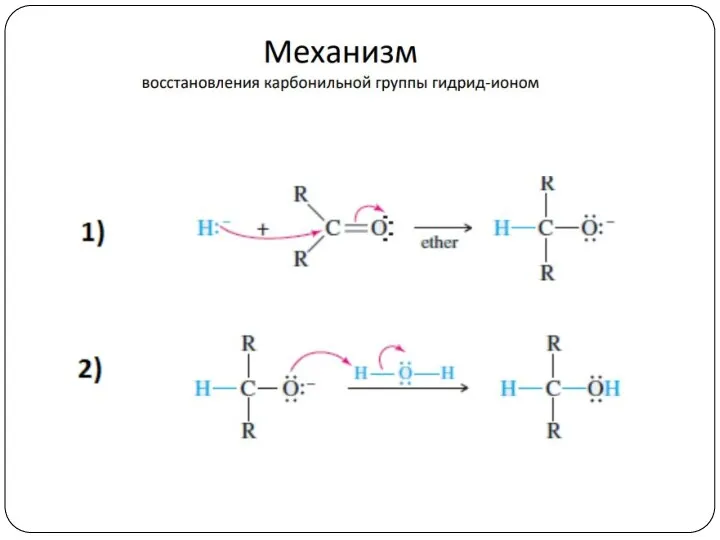
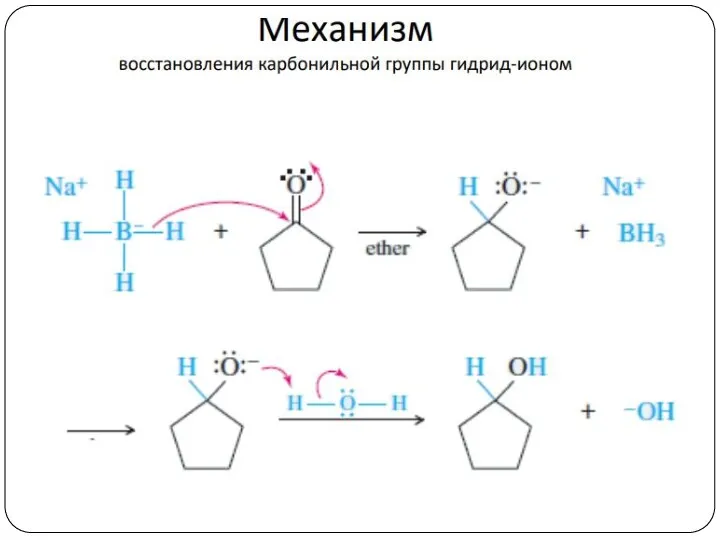
- 21. Механизм
- 22. Раскрытие цикла идет со стерически менее затрудненной стороны
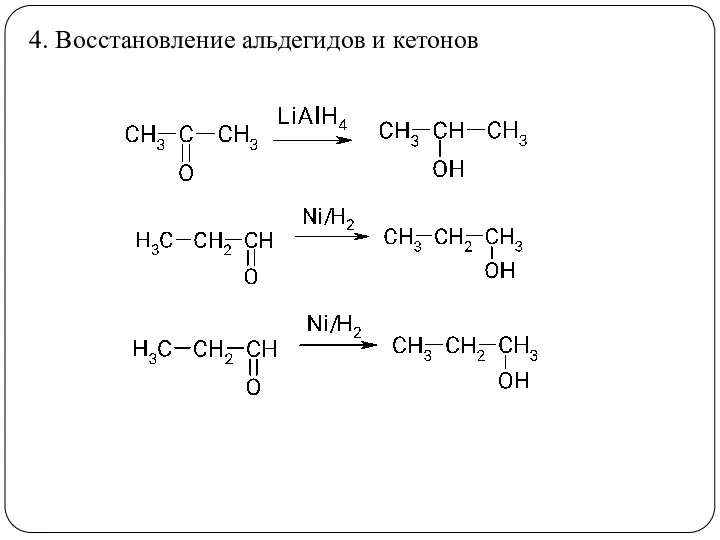
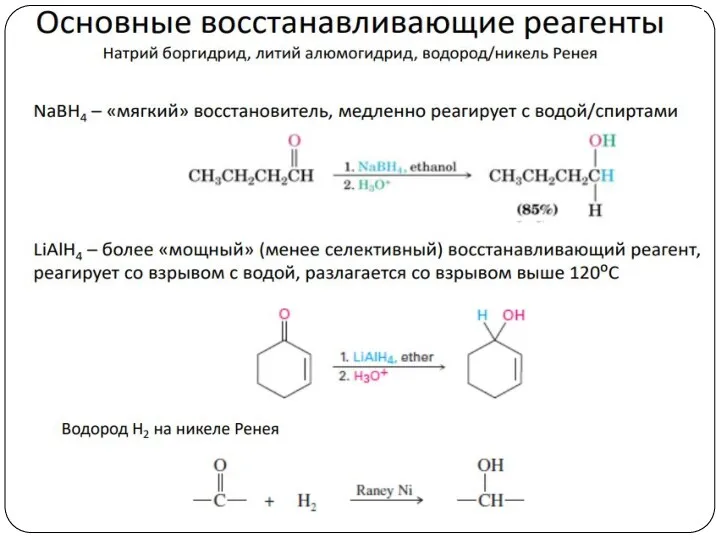
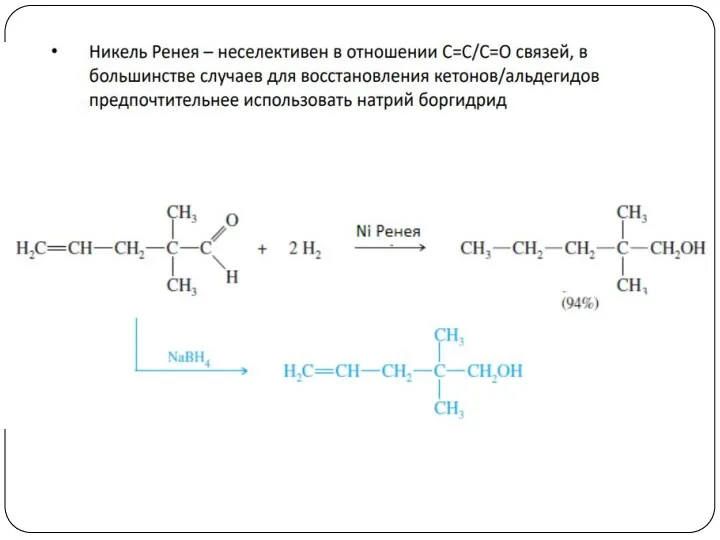
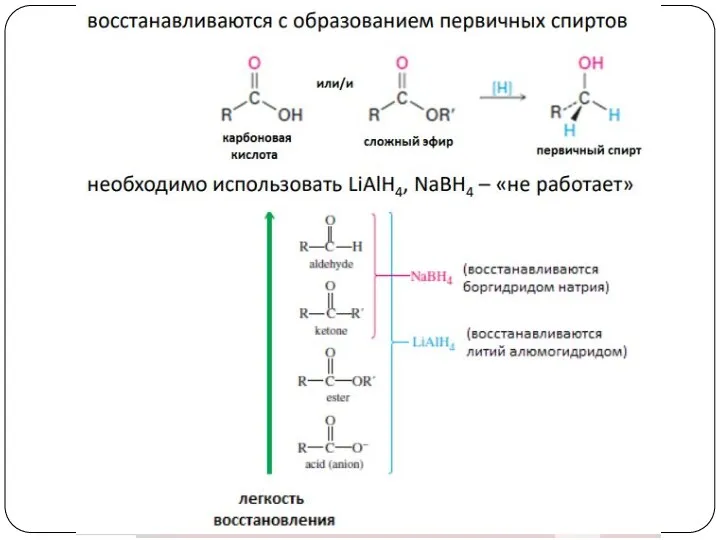
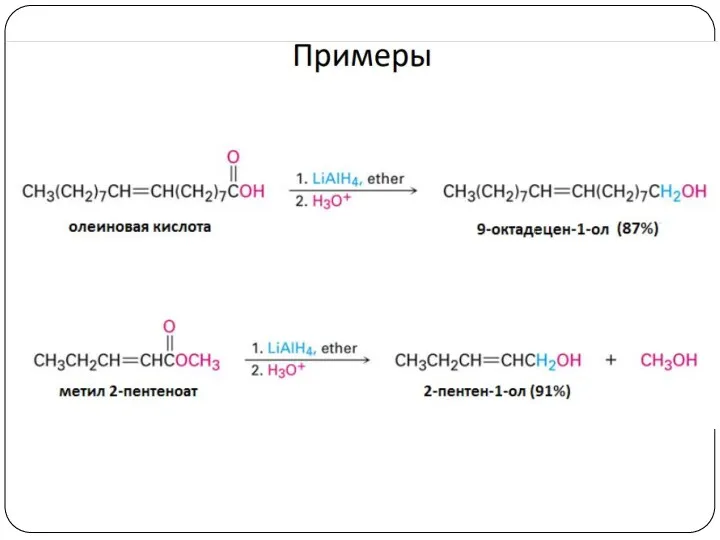
- 23. 4. Восстановление альдегидов и кетонов
- 30. Специфические методы: Дрожжевое брожение сахаров (глюкозы, фруктозы, мальтозы и после предварительного гидролиза сахарозы) приводит к образованию
- 31. Химические свойства спиртов Кислотные свойства – определяются возможностью отщепления протона, что зависит от строения углеводородного радикала.
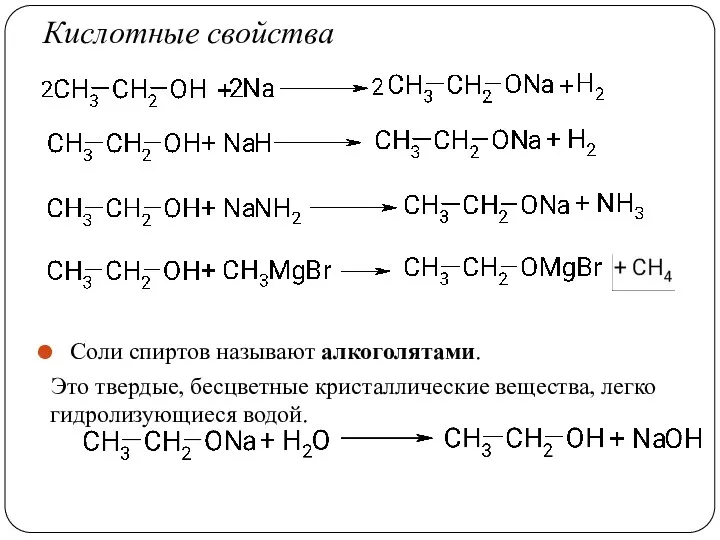
- 32. Кислотные свойства Соли спиртов называют алкоголятами. Это твердые, бесцветные кристаллические вещества, легко гидролизующиеся водой.
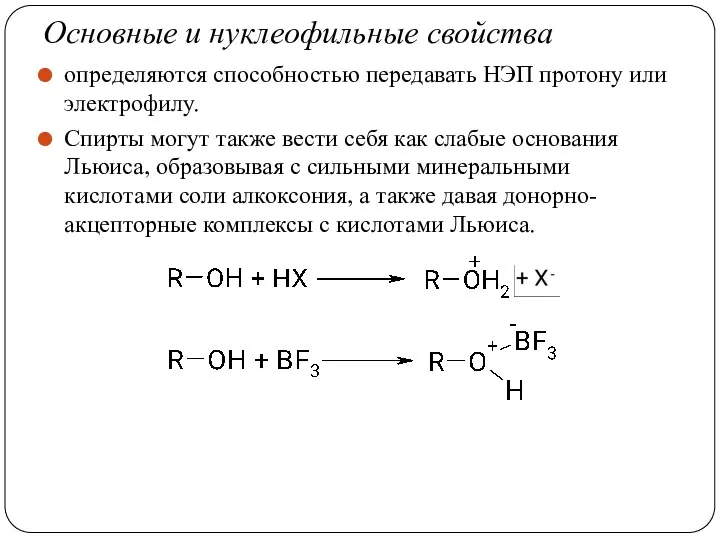
- 33. Основные и нуклеофильные свойства определяются способностью передавать НЭП протону или электрофилу. Спирты могут также вести себя
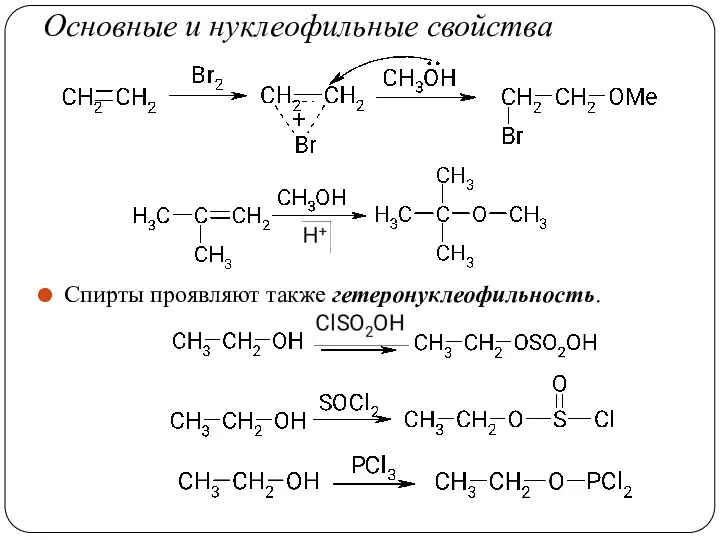
- 34. Основные и нуклеофильные свойства Спирты проявляют также гетеронуклеофильность.
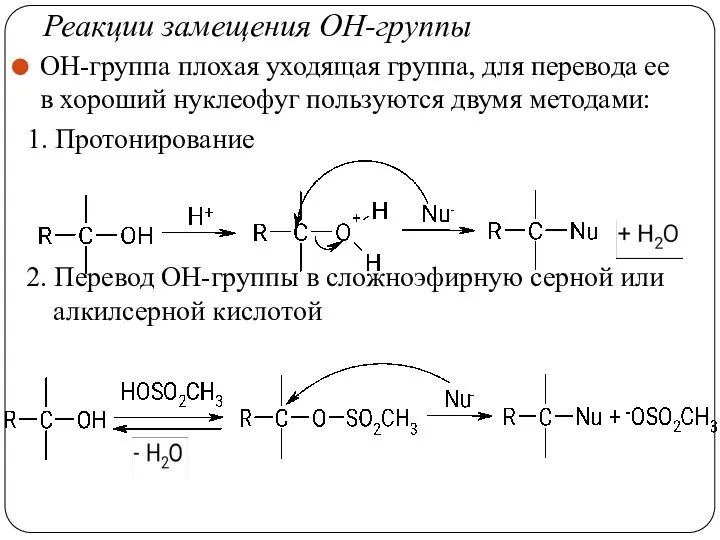
- 35. Реакции замещения ОН-группы ОН-группа плохая уходящая группа, для перевода ее в хороший нуклеофуг пользуются двумя методами:
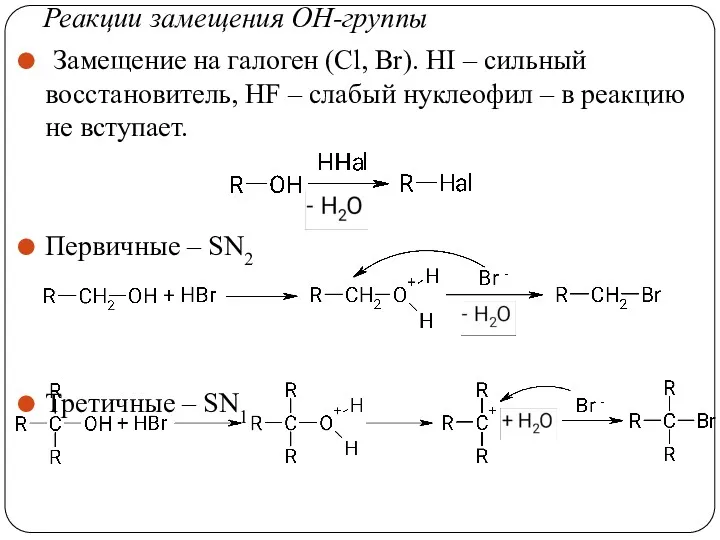
- 36. Реакции замещения ОН-группы Замещение на галоген (Сl, Br). HI – сильный восстановитель, HF – слабый нуклеофил
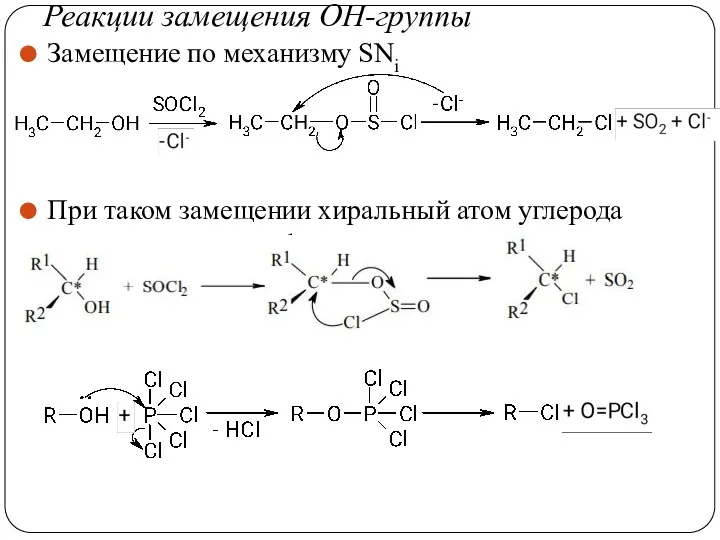
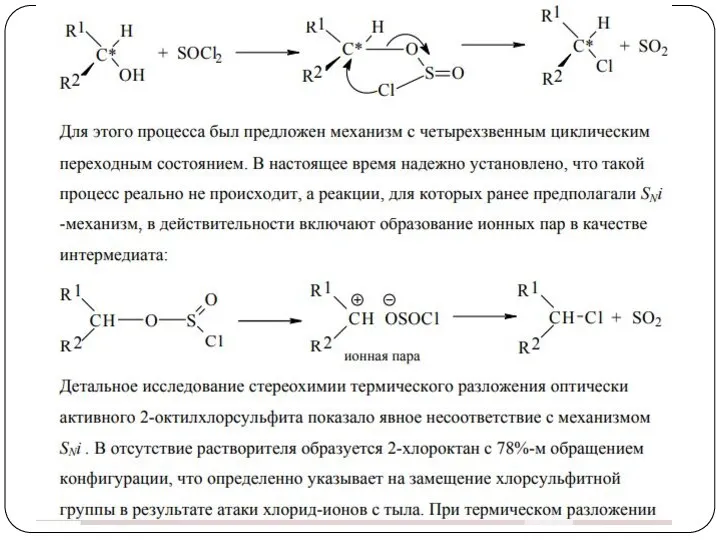
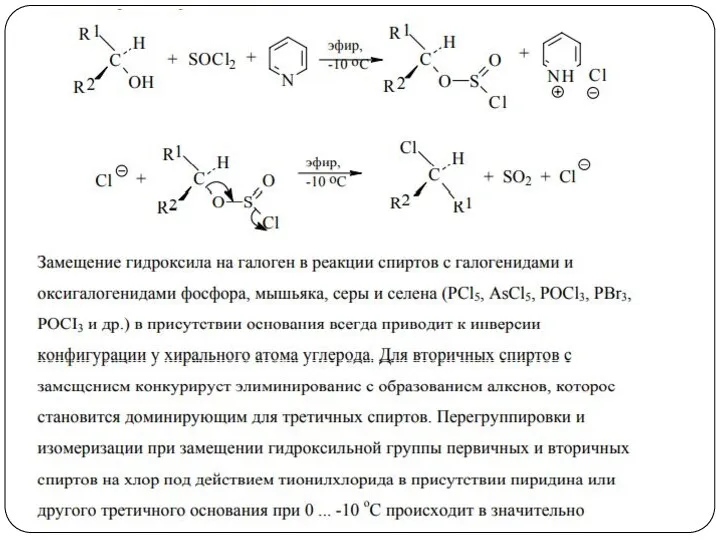
- 37. Реакции замещения ОН-группы Замещение по механизму SNi При таком замещении хиральный атом углерода сохраняет свою конфигурацию.
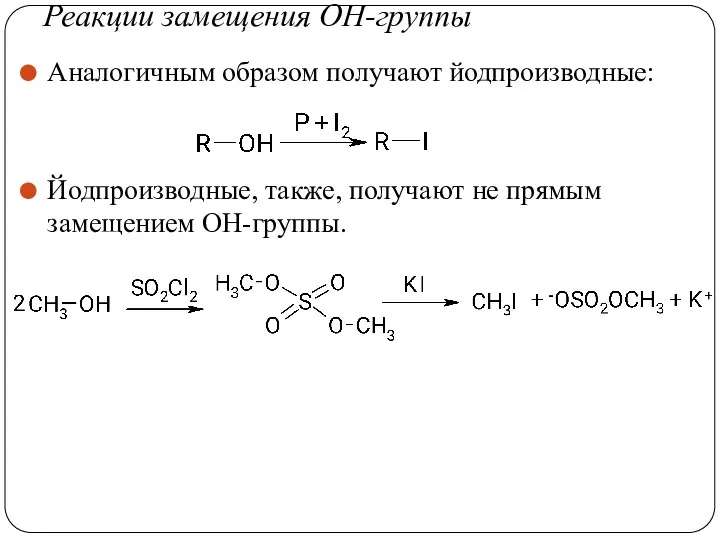
- 40. Реакции замещения ОН-группы Аналогичным образом получают йодпроизводные: Йодпроизводные, также, получают не прямым замещением ОН-группы.
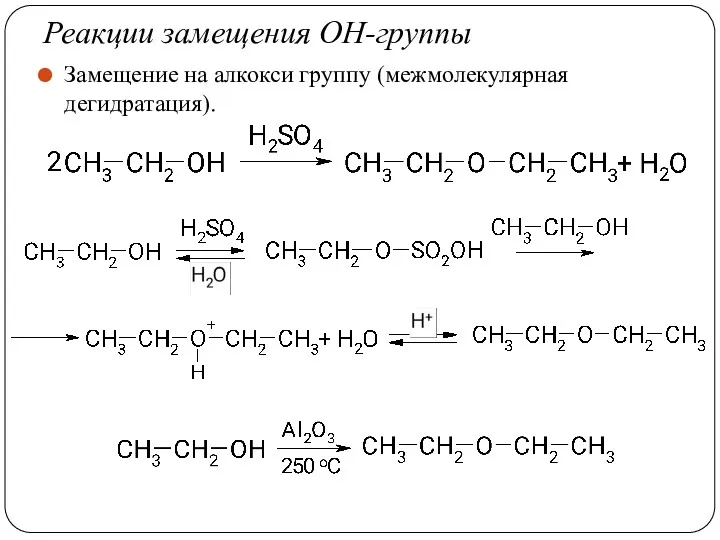
- 41. Реакции замещения ОН-группы Замещение на алкокси группу (межмолекулярная дегидратация).
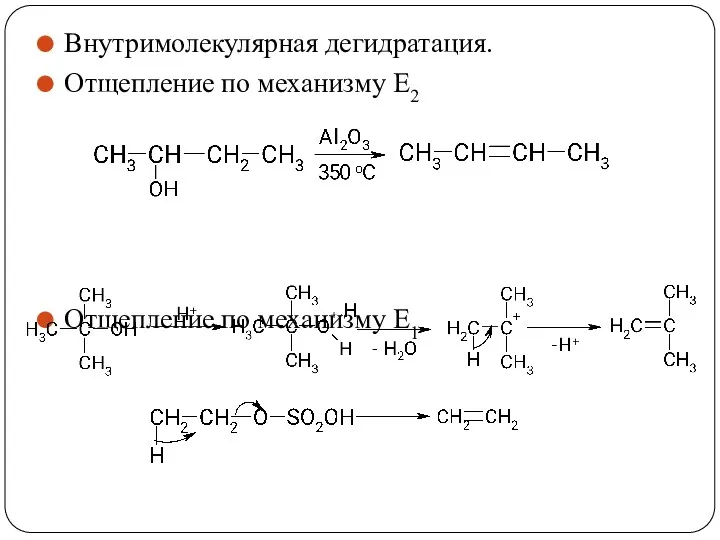
- 42. Внутримолекулярная дегидратация. Отщепление по механизму Е2 Отщепление по механизму Е1
- 43. Окисление и дегидрирование спиртов Окисление первичных спиртов проводят при температуре ниже температуры кипения спирта, но выше
- 44. Нахождение в природе Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако
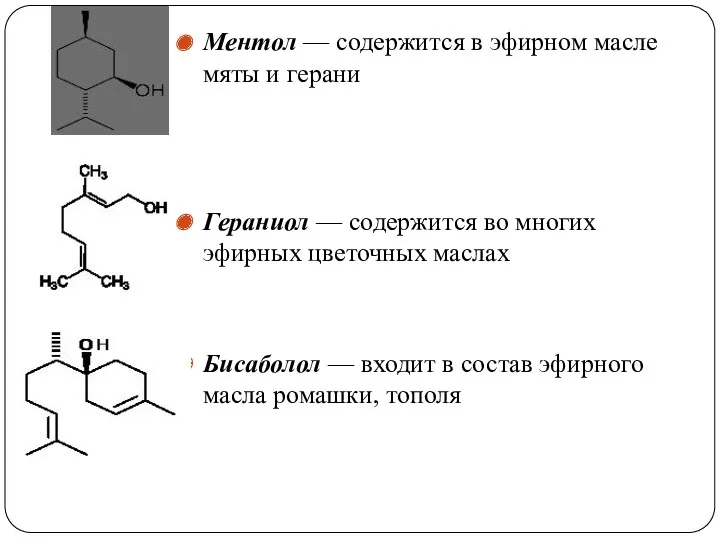
- 45. Ментол — содержится в эфирном масле мяты и герани Гераниол — содержится во многих эфирных цветочных
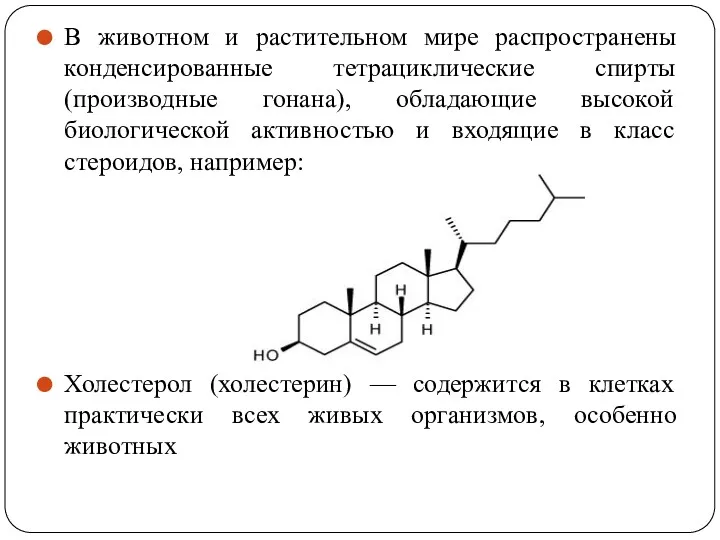
- 46. В животном и растительном мире распространены конденсированные тетрациклические спирты (производные гонана), обладающие высокой биологической активностью и
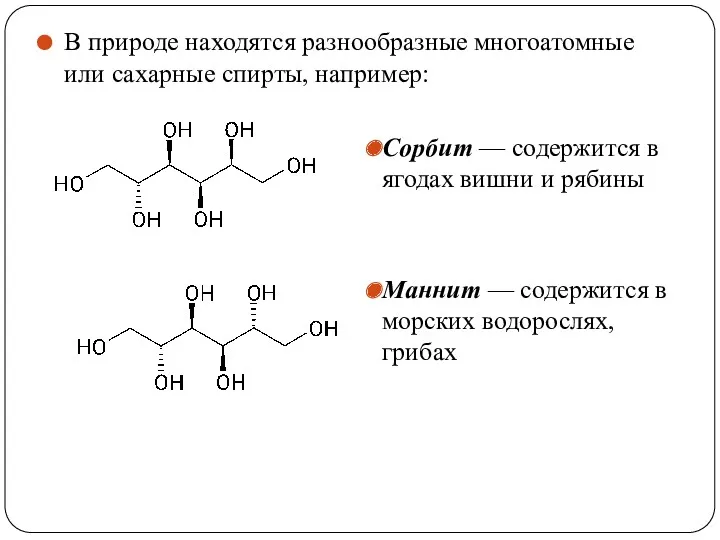
- 47. В природе находятся разнообразные многоатомные или сахарные спирты, например: Сорбит — содержится в ягодах вишни и
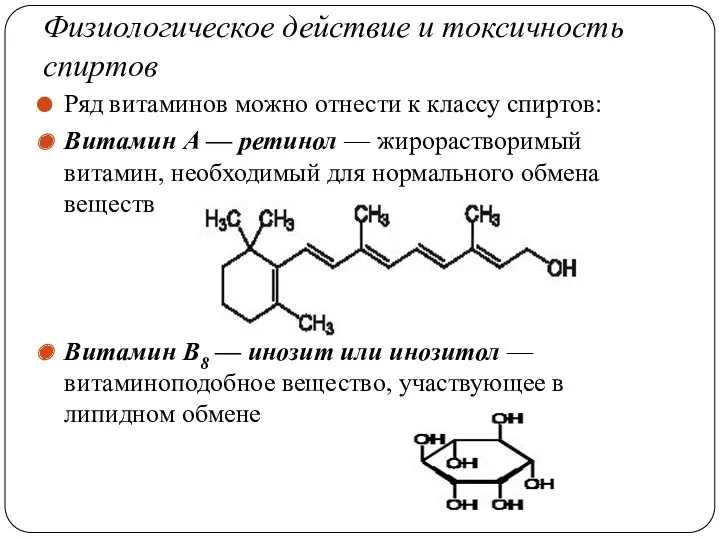
- 48. Физиологическое действие и токсичность спиртов Ряд витаминов можно отнести к классу спиртов: Витамин А — ретинол
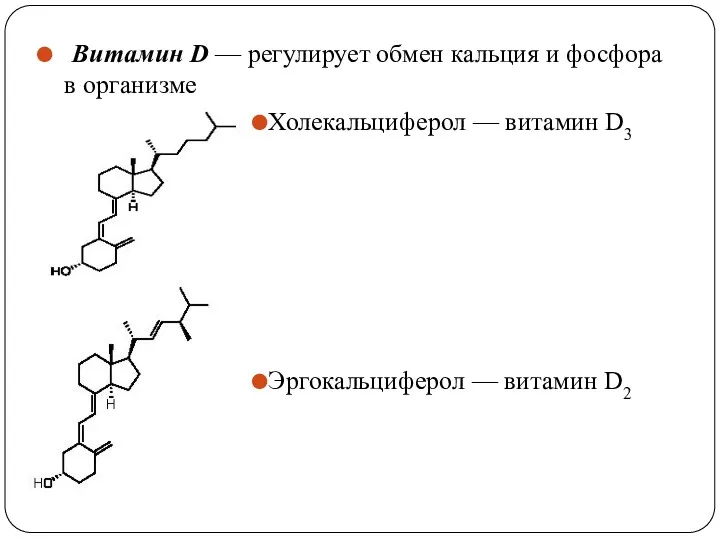
- 49. Витамин D — регулирует обмен кальция и фосфора в организме Холекальциферол — витамин D3 Эргокальциферол —
- 50. Одноатомные предельные спирты вводят организм в наркозоподобное или гипнотическое состояние, а также оказывают токсическое действие. Эти
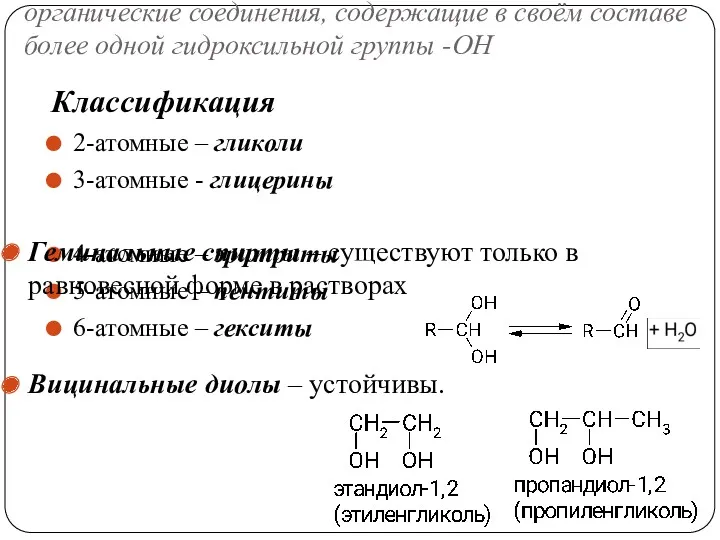
- 51. органические соединения, содержащие в своём составе более одной гидроксильной группы -ОН Классификация 2-атомные – гликоли 3-атомные
- 52. Физические свойства Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. glykys– сладкий),
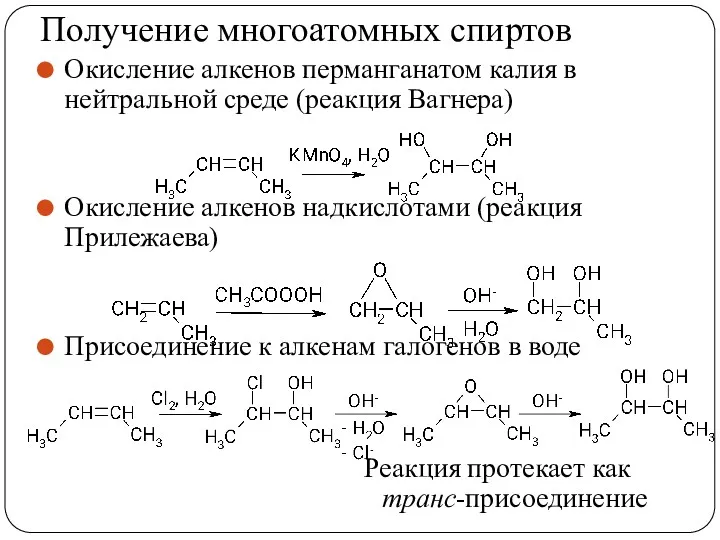
- 53. Получение многоатомных спиртов Окисление алкенов перманганатом калия в нейтральной среде (реакция Вагнера) Окисление алкенов надкислотами (реакция
- 54. Гидролиз вицинальных дигалогенпроизводных Глицерин получают из жиров, а также синтетическим путем из газов крекинга нефти (пропилена),
- 55. Химические свойства Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп,
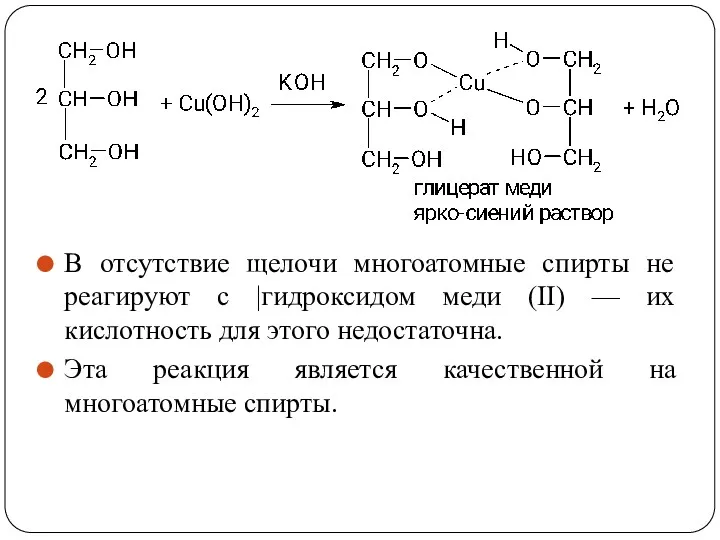
- 56. В отсутствие щелочи многоатомные спирты не реагируют с |гидроксидом меди (II) — их кислотность для этого
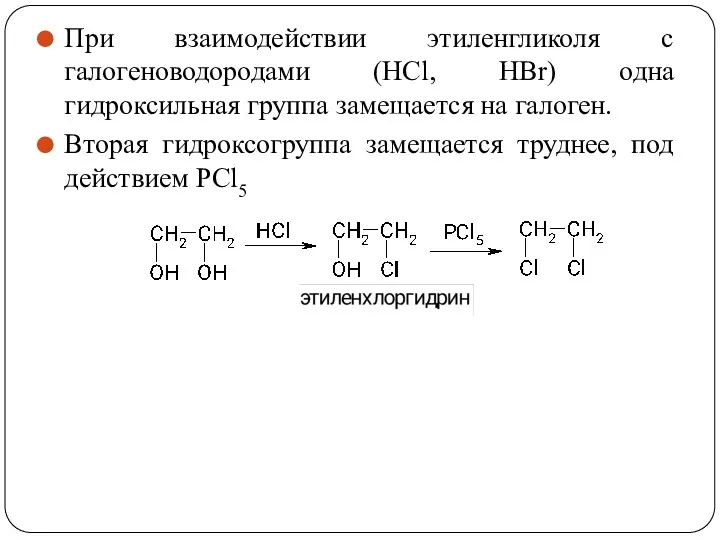
- 57. При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген. Вторая гидроксогруппа замещается
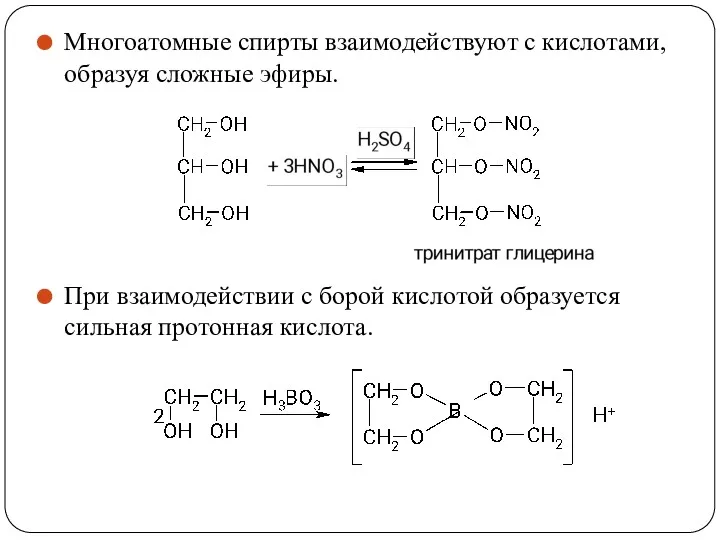
- 58. Многоатомные спирты взаимодействуют с кислотами, образуя сложные эфиры. При взаимодействии с борой кислотой образуется сильная протонная
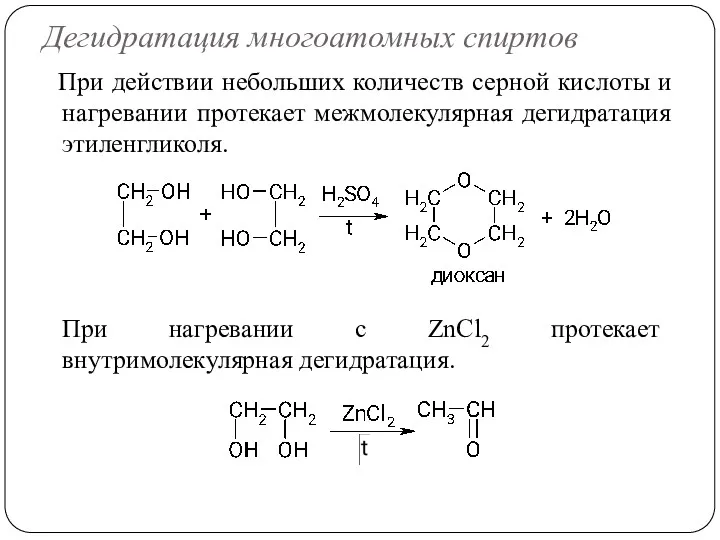
- 59. Дегидратация многоатомных спиртов При действии небольших количеств серной кислоты и нагревании протекает межмолекулярная дегидратация этиленгликоля. При
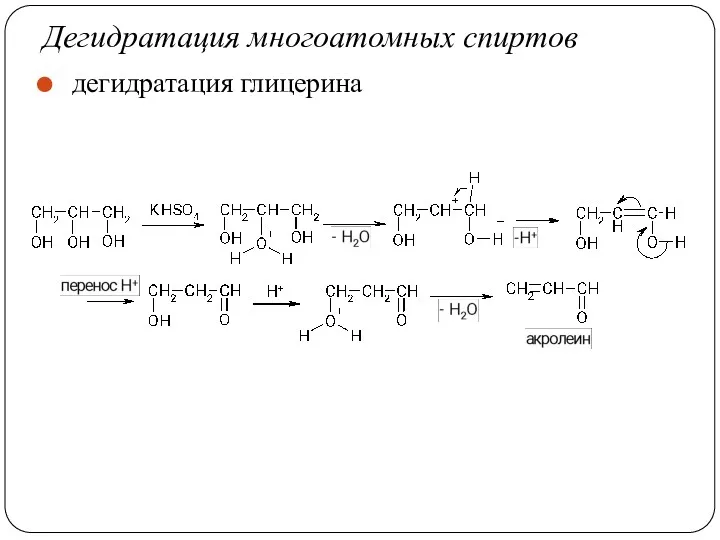
- 60. Дегидратация многоатомных спиртов дегидратация глицерина
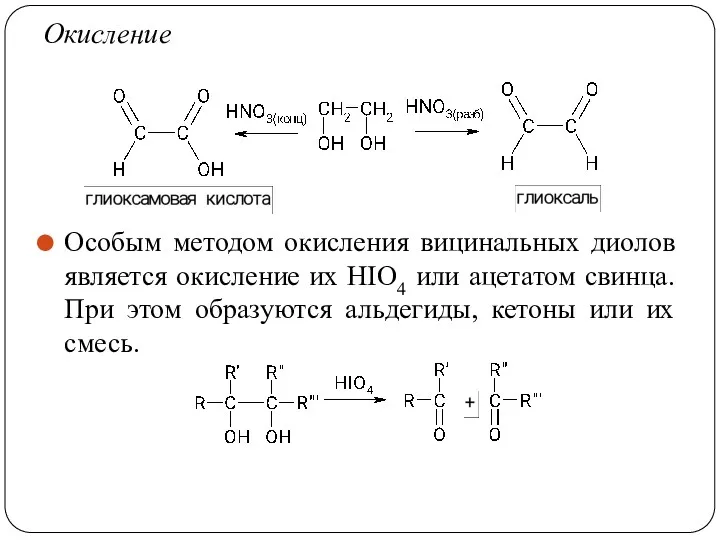
- 61. Окисление Особым методом окисления вицинальных диолов является окисление их HIO4 или ацетатом свинца. При этом образуются
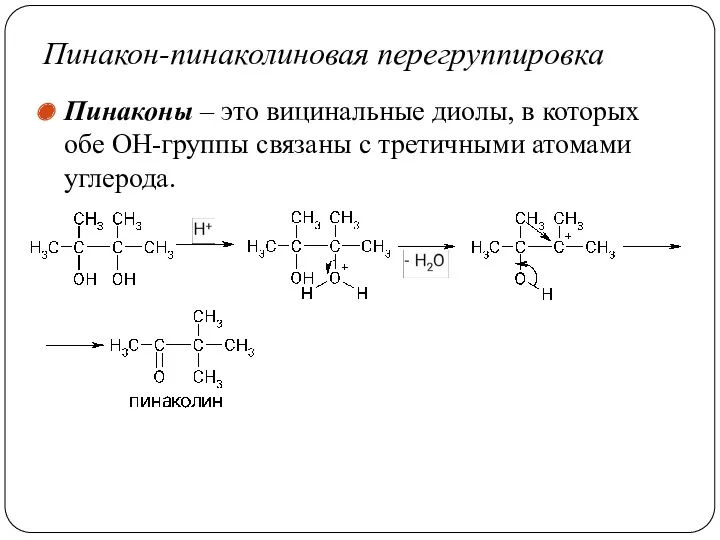
- 62. Пинакон-пинаколиновая перегруппировка Пинаконы – это вицинальные диолы, в которых обе ОН-группы связаны с третичными атомами углерода.
- 64. Скачать презентацию








 Rates of reaction
Rates of reaction Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Ароматические соединения
Ароматические соединения Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Кислоты. Состав, названия и определение кислот
Кислоты. Состав, названия и определение кислот Introduction to Periodic Table
Introduction to Periodic Table Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Етери та естери
Етери та естери Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Азотная кислота
Азотная кислота Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Метал конструкциялық материалдар
Метал конструкциялық материалдар Вуглеводи
Вуглеводи Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ