Содержание
- 2. Класс циклических ненасыщенных углеводородов ряда бензола называется ароматическими углеводородами или аренами Арены классифицируются - в зависимости
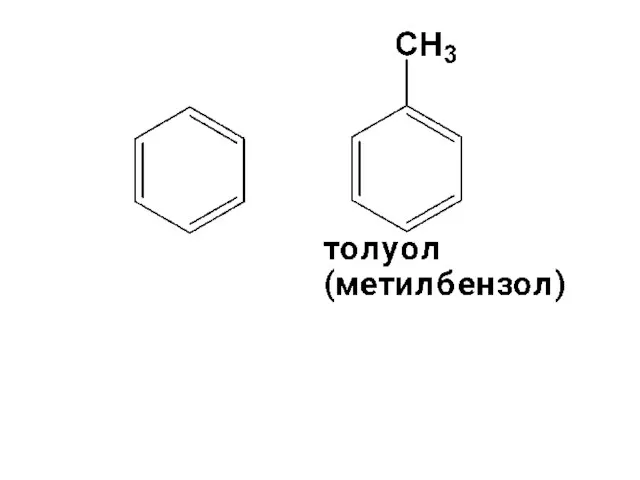
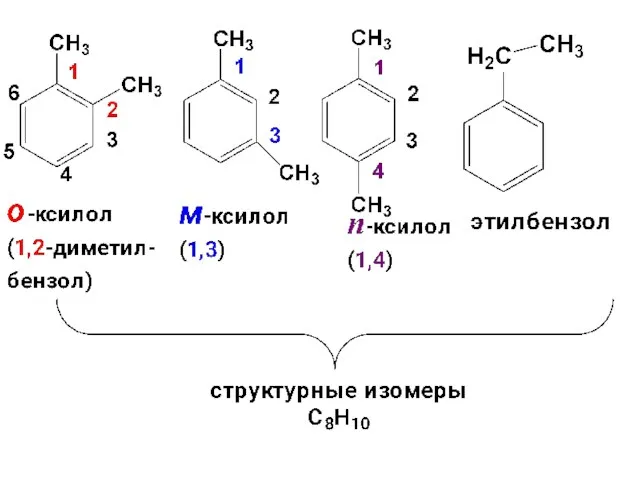
- 3. Простейшие арены – моноциклические арены ряда бензола, т.е. гомологи бензола, которые получаются в результате замещения атомов
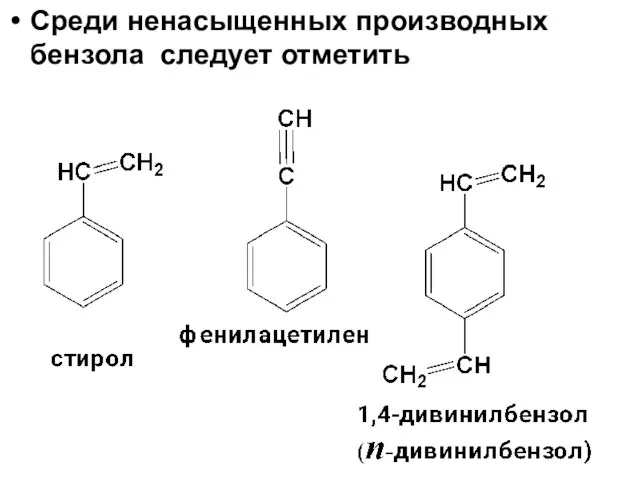
- 8. Среди ненасыщенных производных бензола следует отметить
- 9. Современная номенклатура - требуется использовать для наименования ареногв суффикс ен (бензен, толуен, ксилены и т.д.), как
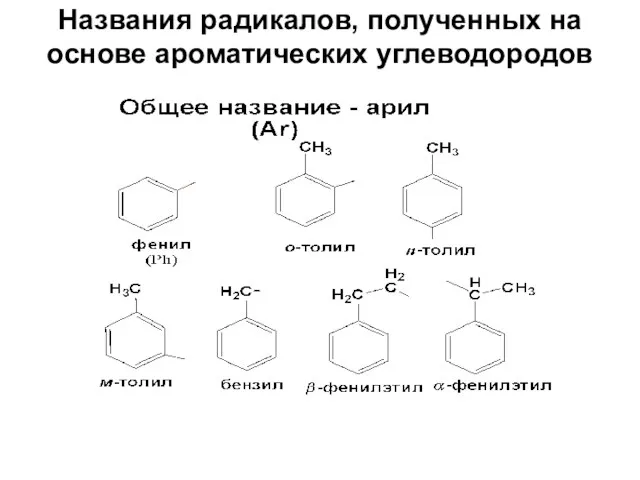
- 10. Названия радикалов, полученных на основе ароматических углеводородов
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Арены представляют собой бесцветные жидкости или кристаллические в-ва, низшие обладают запахом, летучи, нерастворимы в
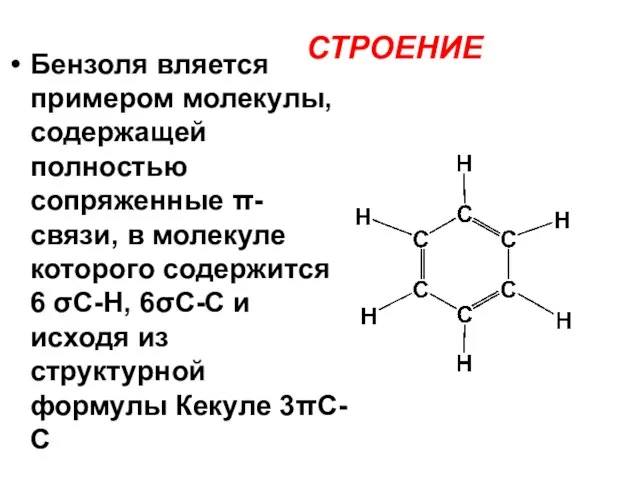
- 12. Бензоля вляется примером молекулы, содержащей полностью сопряженные π-связи, в молекуле которого содержится 6 σС-Н, 6σС-С и
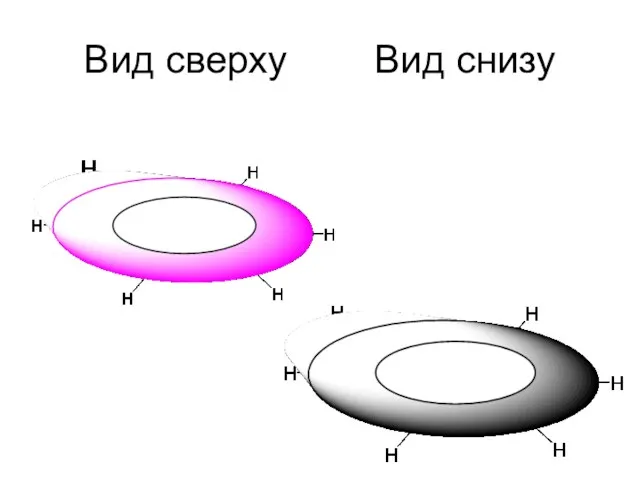
- 14. Вид сверху Вид снизу
- 15. Молекула бензола совершенно симметрична Естаб. =150,1 кДж/моль Для описания систем с делокализованными (сопряженными) системами связей используют
- 17. В молекуле бензола имеет место образование сопряженной системы π-π-типа, которая образуется при чередовании кратных связей в
- 18. БЕНЗОЛ
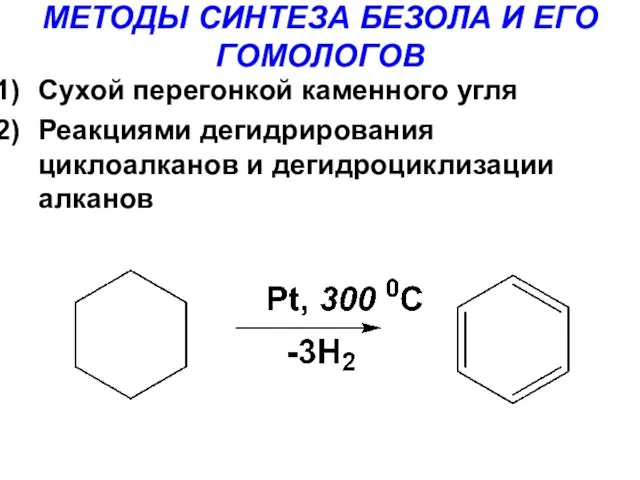
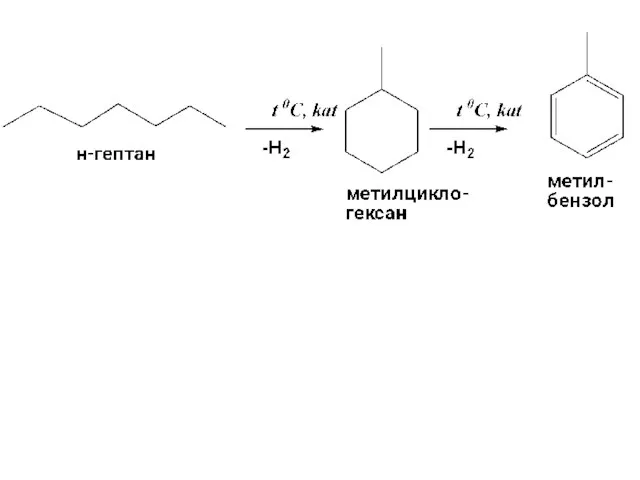
- 19. МЕТОДЫ СИНТЕЗА БЕЗОЛА И ЕГО ГОМОЛОГОВ Сухой перегонкой каменного угля Реакциями дегидрирования циклоалканов и дегидроциклизации алканов
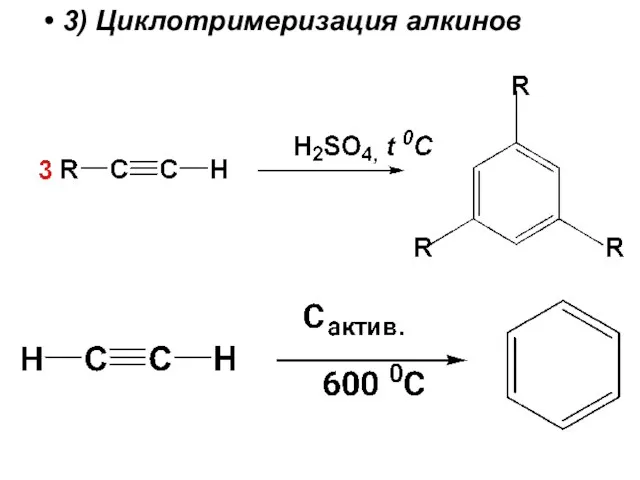
- 21. 3) Циклотримеризация алкинов
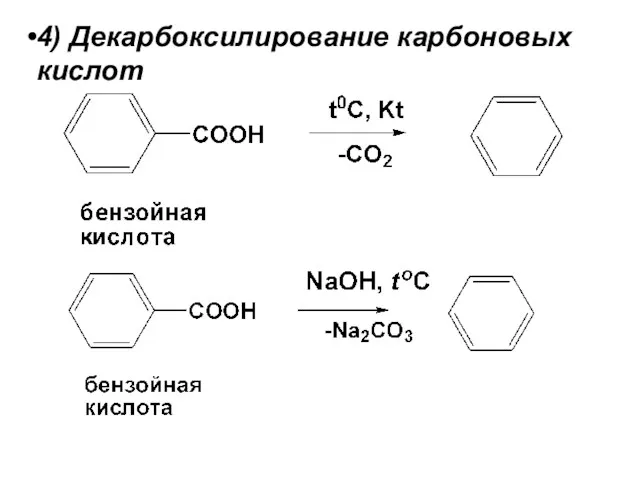
- 22. 4) Декарбоксилирование карбоновых кислот
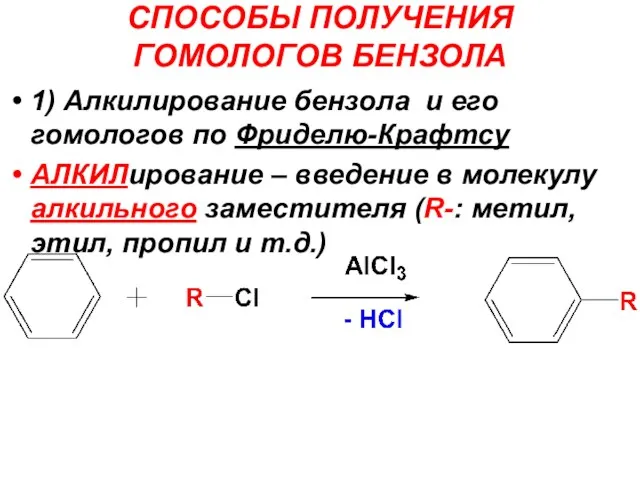
- 23. СПОСОБЫ ПОЛУЧЕНИЯ ГОМОЛОГОВ БЕНЗОЛА 1) Алкилирование бензола и его гомологов по Фриделю-Крафтсу АЛКИЛирование – введение в
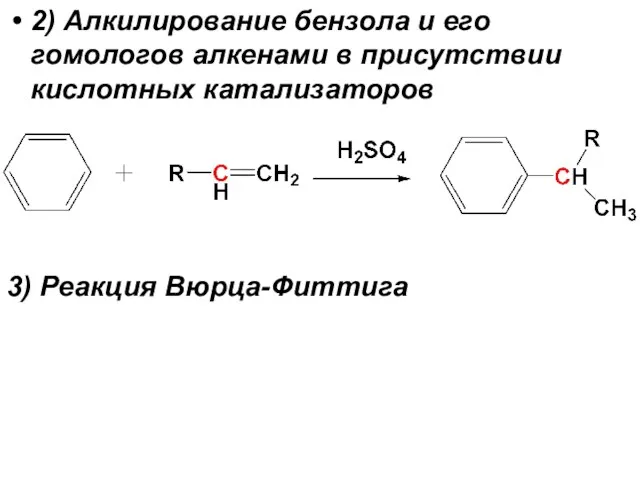
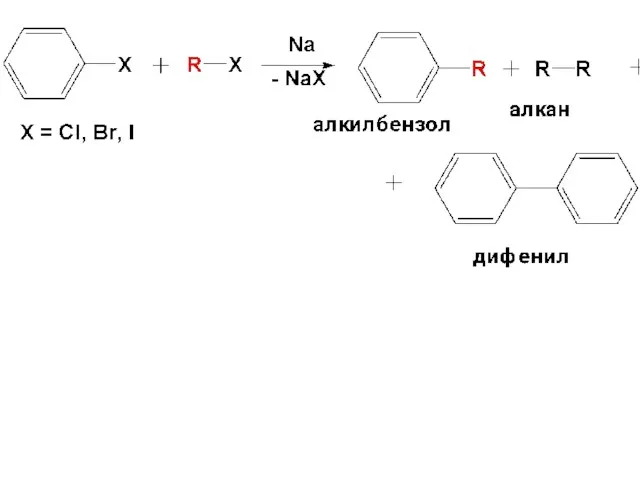
- 24. 2) Алкилирование бензола и его гомологов алкенами в присутствии кислотных катализаторов 3) Реакция Вюрца-Фиттига
- 26. 4) Получение гомологов бензола с использованием реактивов Гриньяра 5) Восстановление алкиларилакетонов по Клеменсену
- 28. Химические свойства 1) Для бензола и его гомологов, несмотря на его ненасыщенность, характерны реакции электрофильного замещения
- 29. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ - SE Относятся реакции нитрования, сульфирования, галогенирования, алкилирования, и ацилирования ароматических соединений. Ниже
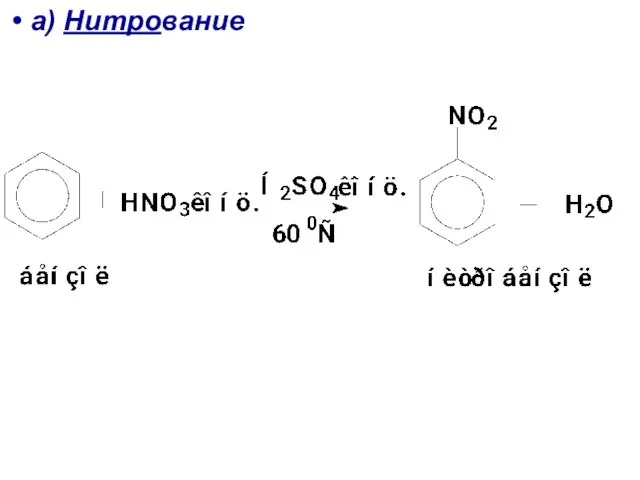
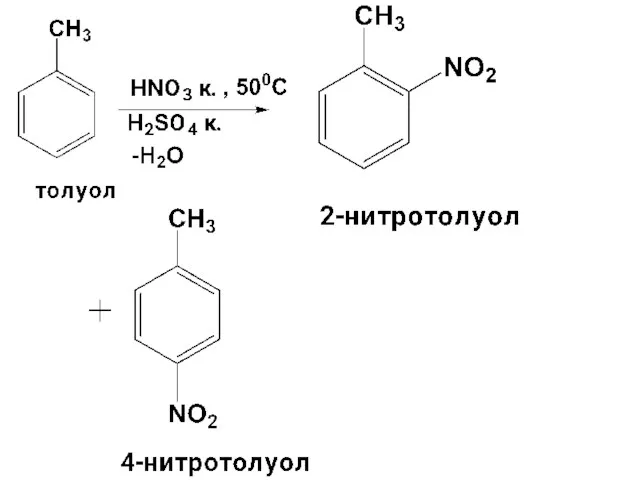
- 30. а) Нитрование
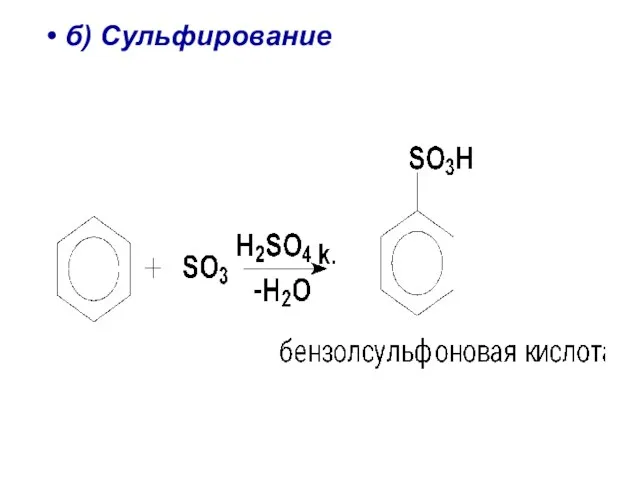
- 31. б) Сульфирование
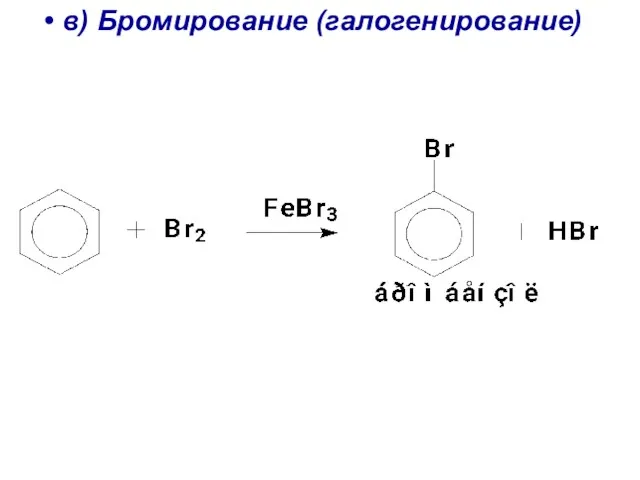
- 32. в) Бромирование (галогенирование)
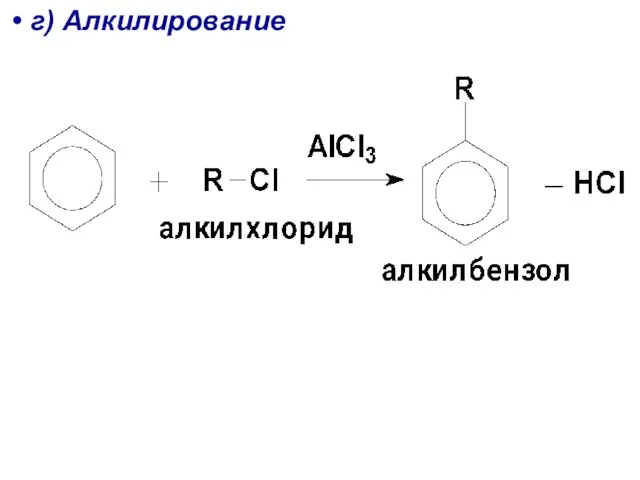
- 33. г) Алкилирование
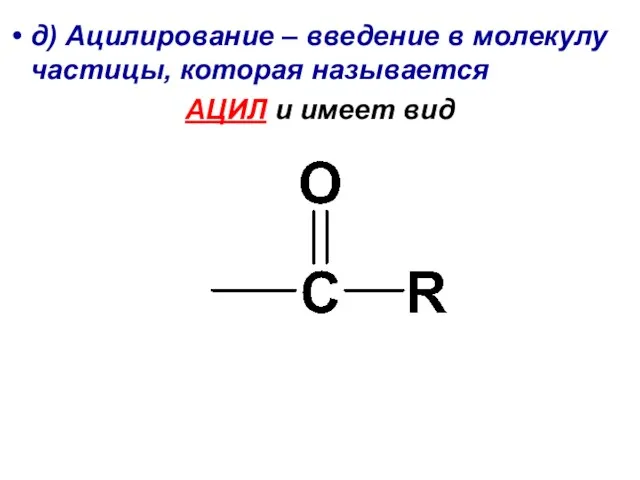
- 34. д) Ацилирование – введение в молекулу частицы, которая называется АЦИЛ и имеет вид
- 36. Электрофильные реагенты ( Е) - частицы, обладающие высоким сродством к электронам. Могут быть как положительно заряженные
- 37. Склонность ароматических соединений к реакциям электрофильного замещения объясняется тем, что эти реакции, в отличие от реакций
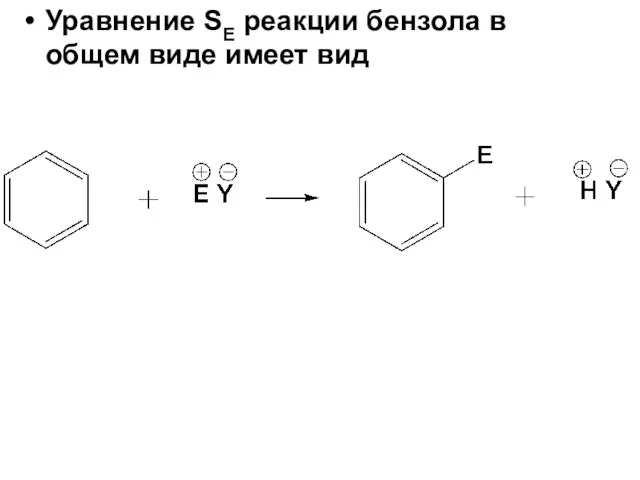
- 38. Уравнение SE реакции бензола в общем виде имеет вид
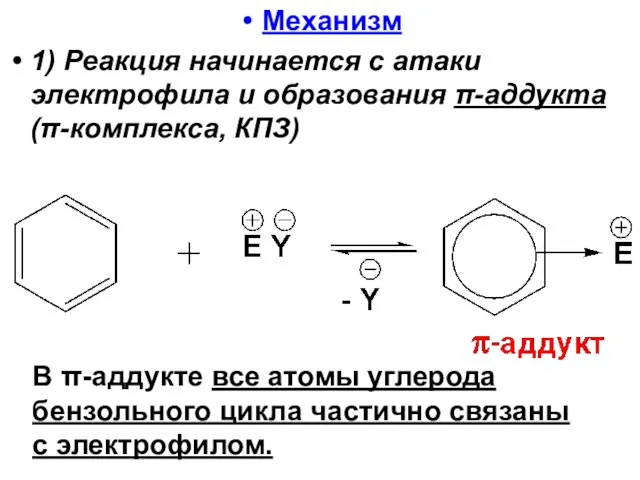
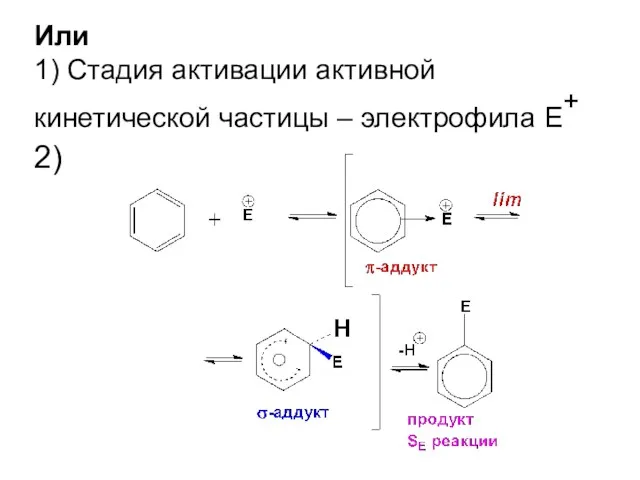
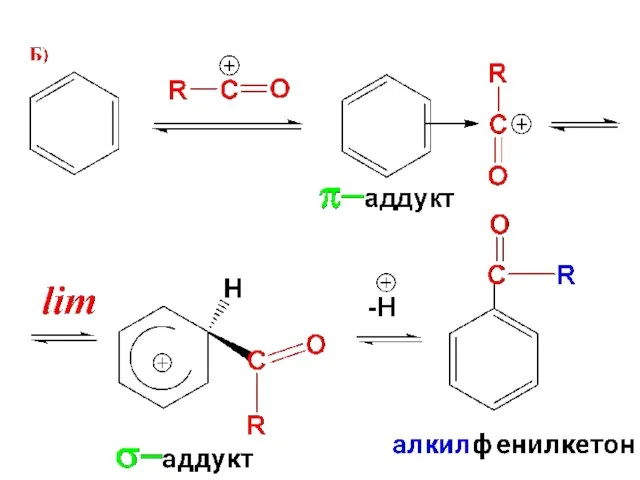
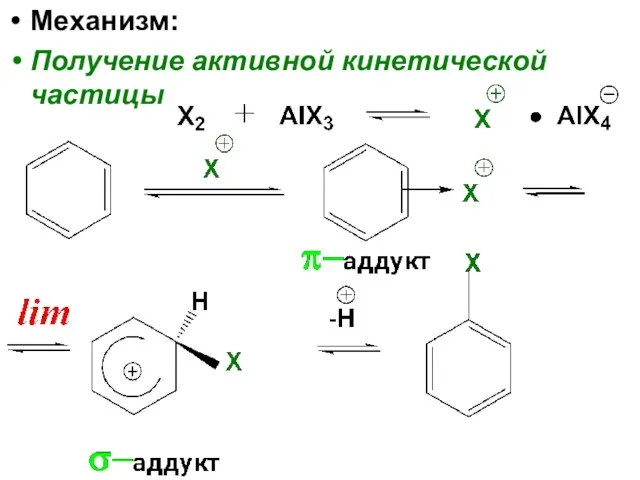
- 39. Механизм 1) Реакция начинается с атаки электрофила и образования π-аддукта (π-комплекса, КПЗ) В π-аддукте все атомы
- 40. 2) π-аддукт, поглощая некоторое количество энергии и преодолевая энергетический барьер, превращается в новую частицу, в которой
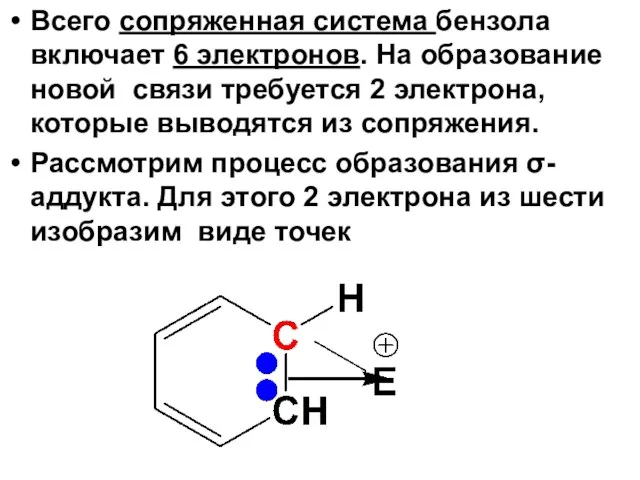
- 41. Всего сопряженная система бензола включает 6 электронов. На образование новой связи требуется 2 электрона, которые выводятся
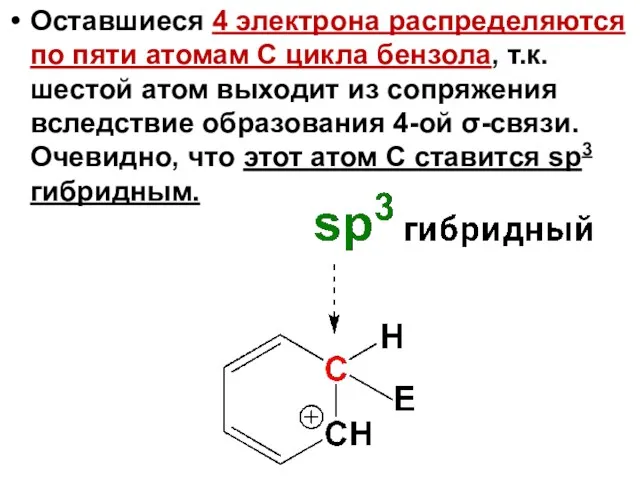
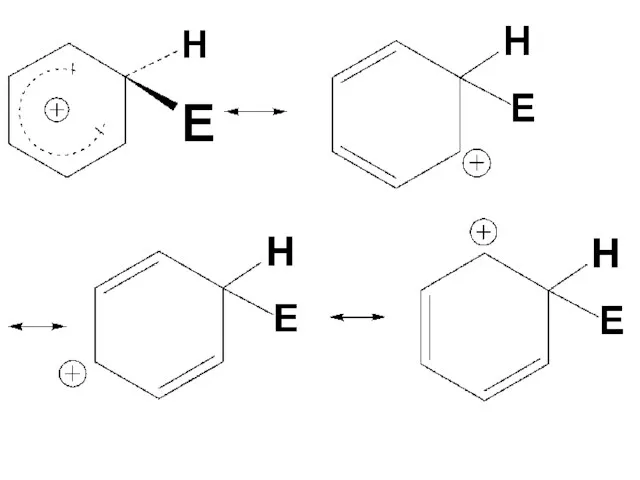
- 42. Оставшиеся 4 электрона распределяются по пяти атомам С цикла бензола, т.к. шестой атом выходит из сопряжения
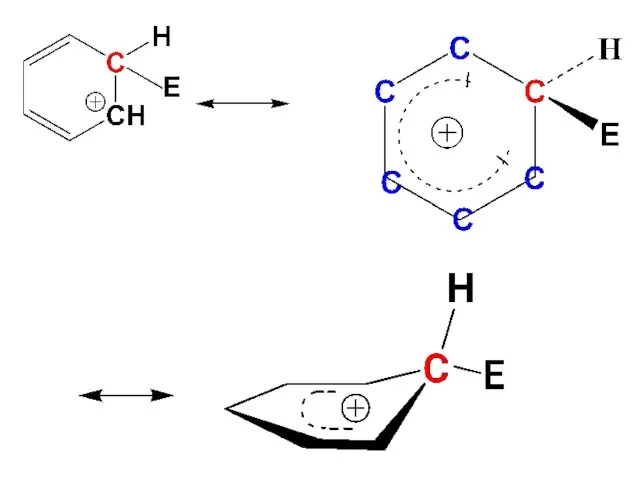
- 44. σ-аддукт является сопряженным карбокатионом, в котором положительный заряд делокализован в системе пяти атомов С, а шестой
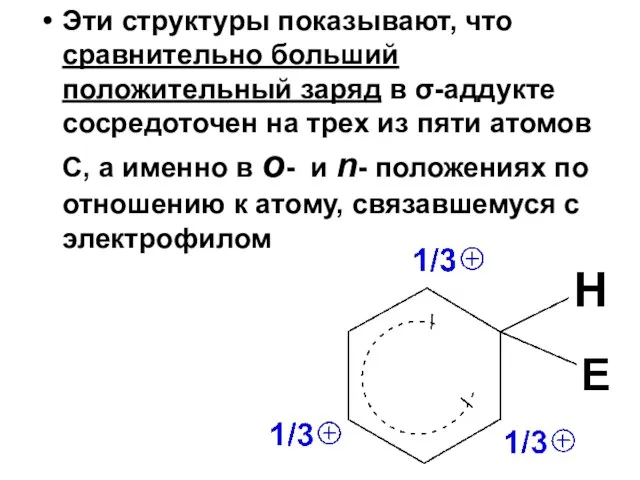
- 46. Эти структуры показывают, что сравнительно больший положительный заряд в σ-аддукте сосредоточен на трех из пяти атомов
- 47. 3) σ-аддукт – частица мало стабильная, т.к. его образование вызывает разрушение 6-π сопряженной системы ароматического кольца
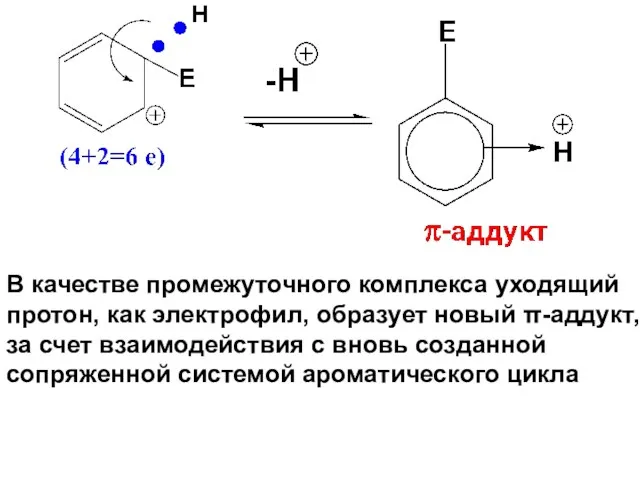
- 48. В качестве промежуточного комплекса уходящий протон, как электрофил, образует новый π-аддукт, за счет взаимодействия с вновь
- 49. Новый π-аддукт путем окончательного отщепления протона превращается в продукт реакции
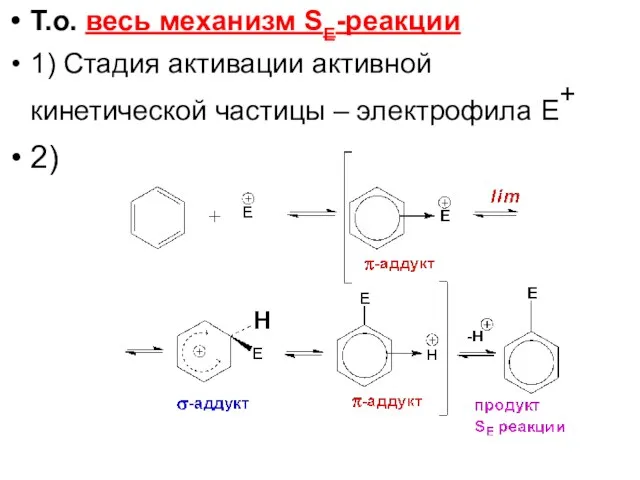
- 50. Т.о. весь механизм SE-реакции 1) Стадия активации активной кинетической частицы – электрофила Е+ 2)
- 51. Или 1) Стадия активации активной кинетической частицы – электрофила Е+ 2)
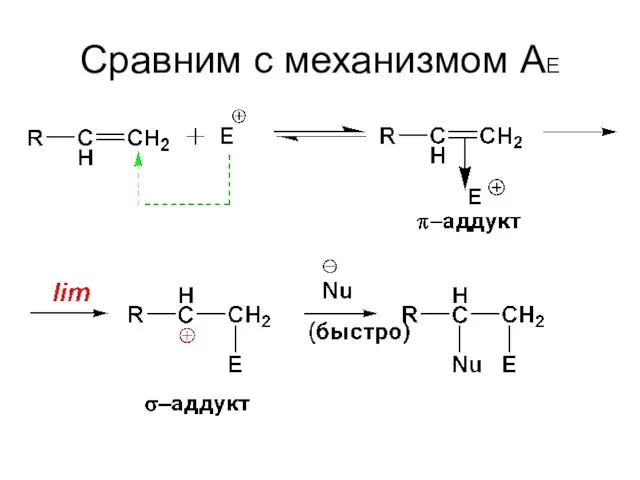
- 52. Сравним с механизмом АЕ
- 53. Следует запомнить, что атакующая частица данной реакции является электрофилом. Уходящая частица ( в данном случае протон
- 54. ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И НАПРАВЛЕНИЕ SE РЕАКЦИЙ ( См. Учебник. С.
- 56. При рассмотрении таких реакций надо решать два важных вопроса: 1) Каково ориентирующее влияние заместителя Х, т.е.
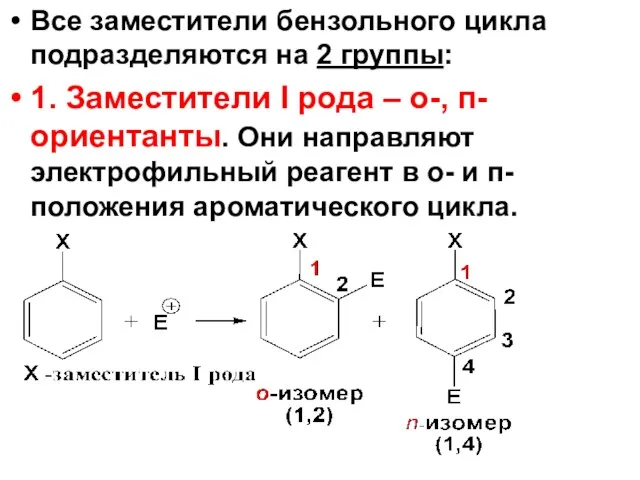
- 57. Все заместители бензольного цикла подразделяются на 2 группы: 1. Заместители I рода – о-, п-ориентанты. Они
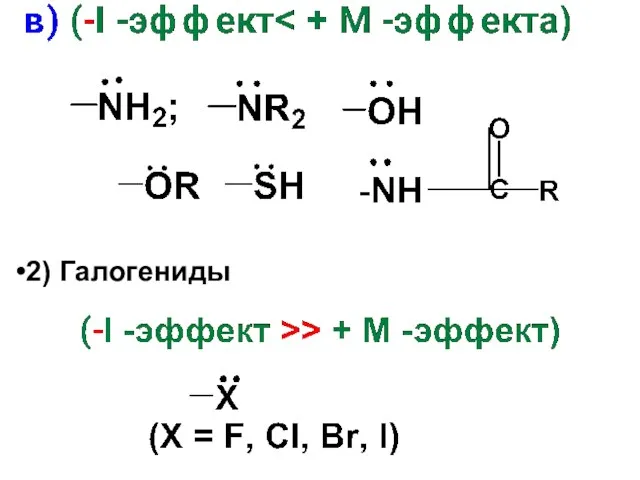
- 58. орто-, пара-Ориентанты (заместители I рода) Относятся все электронодонорные заместители, а также галогениды ЭД-заместители стабилизируют π- и
- 60. 2) Галогениды
- 61. ЭД-заместители повышают электронную плотность в ароматическом цикле, что способствует атаке электрофильной частицы (субстрат активируется). Почему реакция
- 62. 2). ЭД-группы в большей степени стабилизируют σ-аддукты, соответствующие присоединению электрофила также в о- и п-положениях ароматического
- 64. Все заместители а), б) и в) являются активирующими субстрат заместителями, стабилизирующими σ-аддукты. Рассмотрим некоторые SЕ-реакции для
- 67. Следует запомнить, что заместители I рода являются о- и п-ориентантами. Они (кроме галогенов) стабилизируют σ-аддукт, а
- 68. Галогениды, в отличие от всех ориентантов I рода, являются ЭА заместителями. Они не приводят к повышению
- 69. 2. Заместители II рода – м-ориентанты. Они направляют электрофильный реагент в м-положение ароматического кольца.
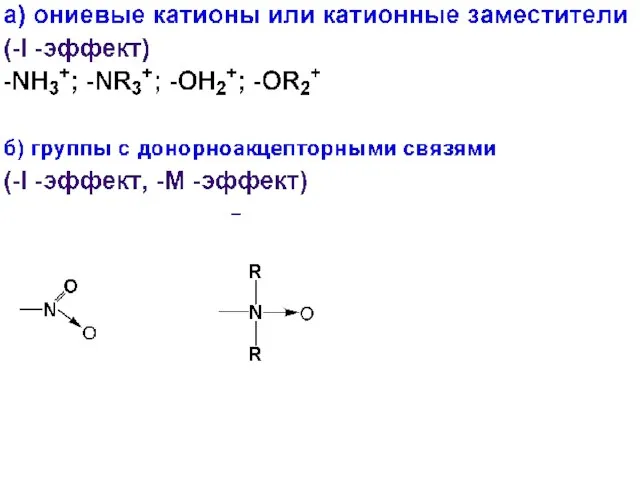
- 70. Относятся все электроноакцепторные заместители (за исключением галогенов) ЭА-заместители дестабилизируют π- и σ-аддукты и затрудняют их образование
- 73. Заместители, принадлежащие к данной группе, обладают сильным «электронооттягивающим» влиянием по отношению к π-сопряженной системе ароматического цикла
- 74. Снижение электронной плотности в ароматическом цикле, также как и повышение в предыдущем случае, происходит неравномерно. Более
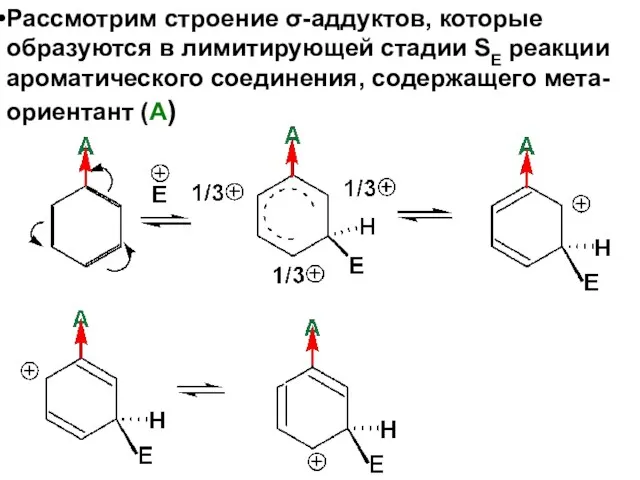
- 75. В м-положениях ароматического цикла имеет место область сравнительно большей электронной плотности. Поэтому Е+ предпочтительно атакует именно
- 76. Рассмотрим строение σ-аддуктов, которые образуются в лимитирующей стадии SE реакции ароматического соединения, содержащего мета-ориентант (А)
- 77. Следует запомнить, что заместители II рода являются м-ориентантами. Они дестабилизируют σ-аддукт, а, следовательно, дезактивируют ароматический цикл
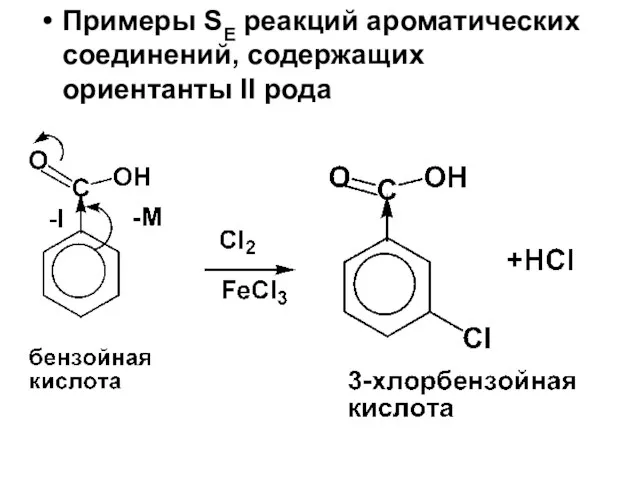
- 78. Примеры SE реакций ароматических соединений, содержащих ориентанты II рода
- 80. Правила ориентации позволяют предсказать преимущественное направление реакции и преобладание того или иного изомера в продуктах реакции.
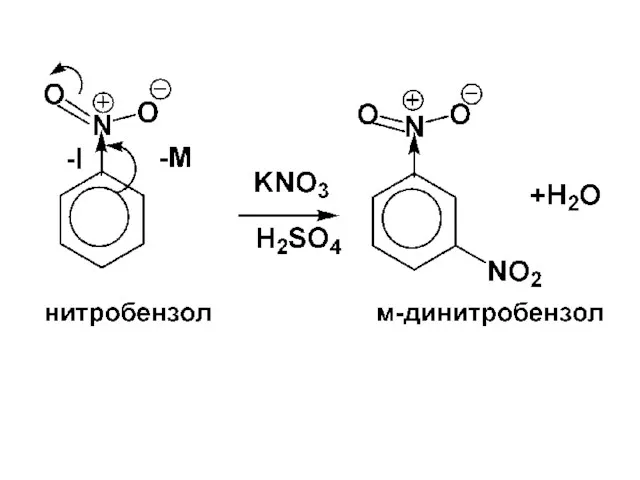
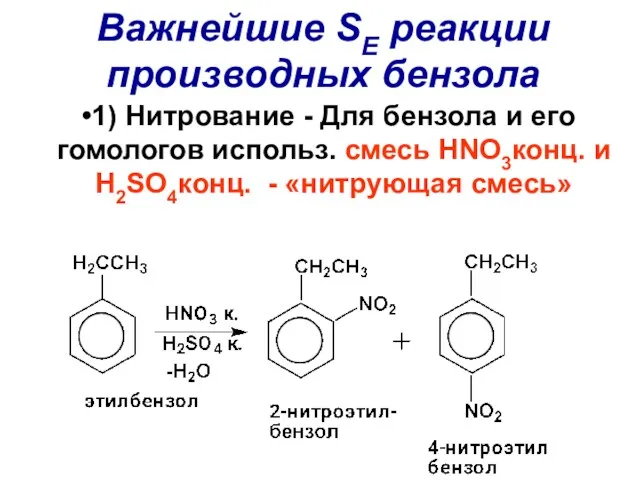
- 81. Важнейшие SE реакции производных бензола 1) Нитрование - Для бензола и его гомологов использ. смесь HNO3конц.
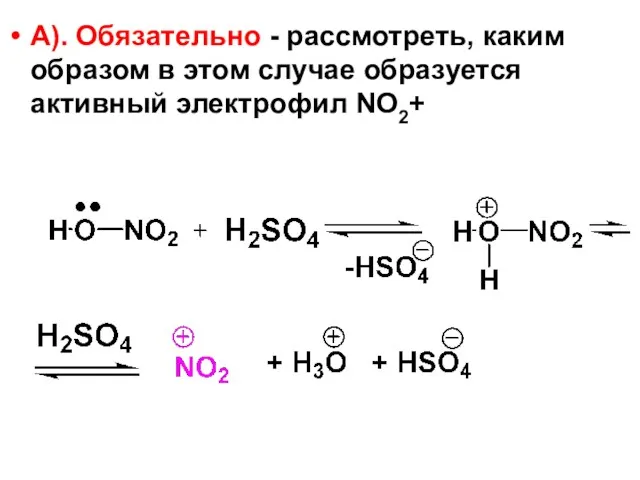
- 82. А). Обязательно - рассмотреть, каким образом в этом случае образуется активный электрофил NO2+
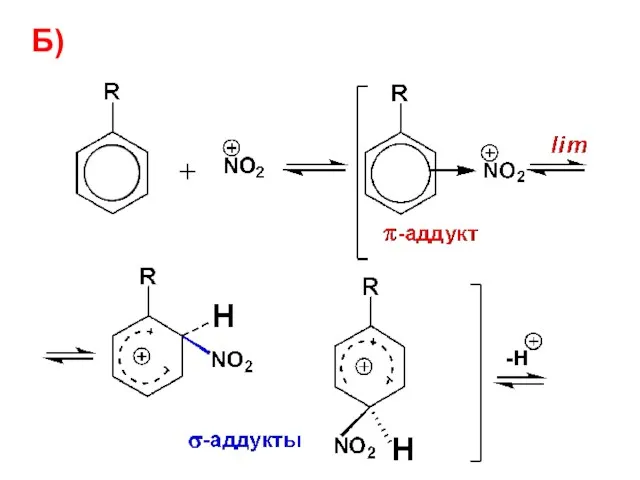
- 83. Б)
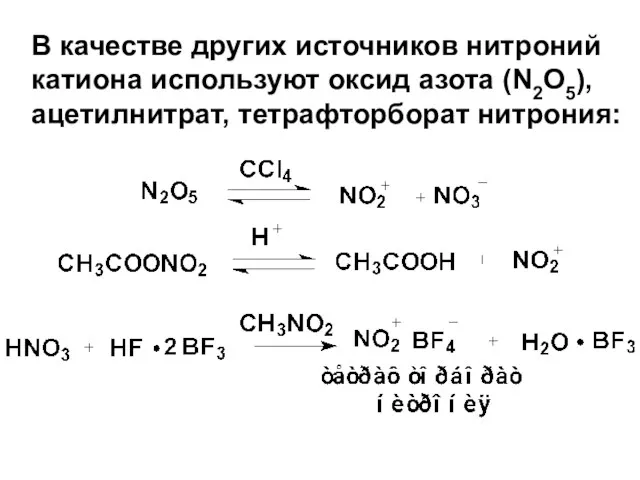
- 85. В качестве других источников нитроний катиона используют оксид азота (N2O5), ацетилнитрат, тетрафторборат нитрония:
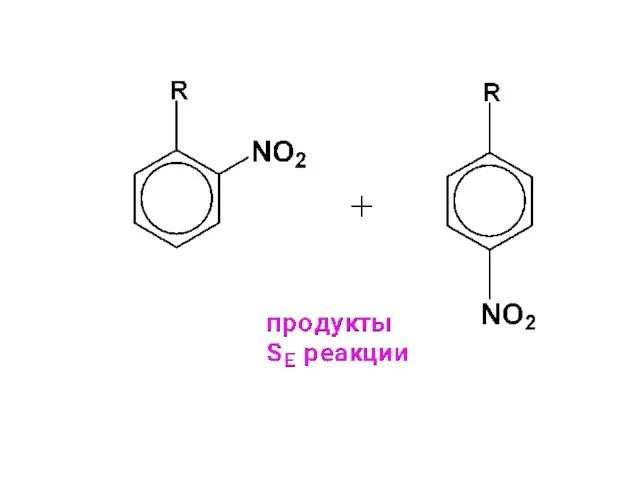
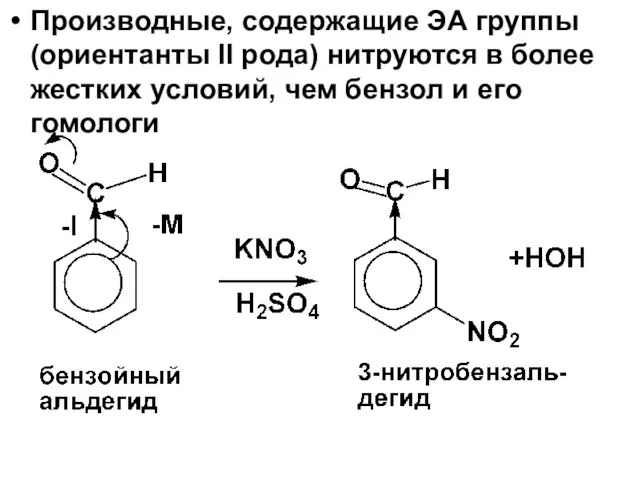
- 86. Производные, содержащие ЭА группы (ориентанты II рода) нитруются в более жестких условий, чем бензол и его
- 87. Введение нитрогруппы в ароматическое кольцо приводит к его сильной дезактивации по отношению к реакциям SE, т.к.
- 88. Ароматические вещества, содержащие ЭД-группы (-ОН, -ОСН3 , -NH2 , и др.) нитруются в более мягких условиях
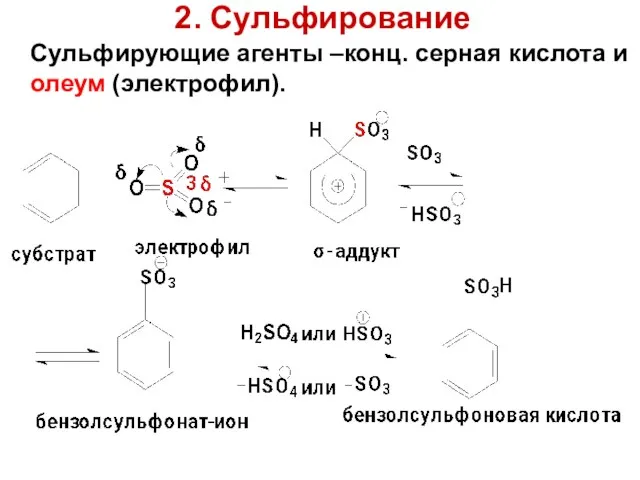
- 89. 2. Сульфирование Сульфирующие агенты –конц. серная кислота и олеум (электрофил).
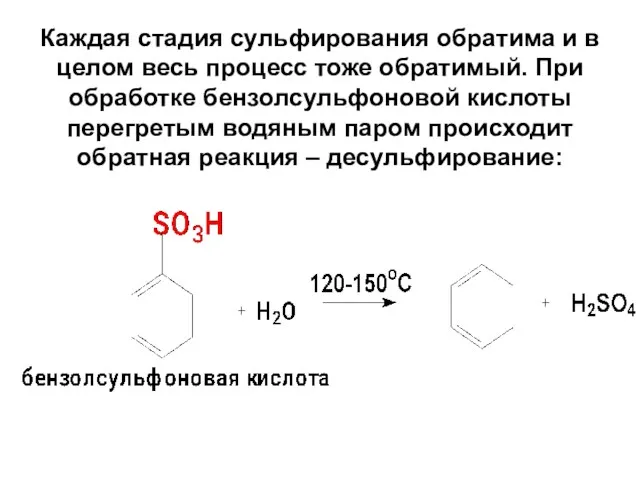
- 90. Каждая стадия сульфирования обратима и в целом весь процесс тоже обратимый. При обработке бензолсульфоновой кислоты перегретым
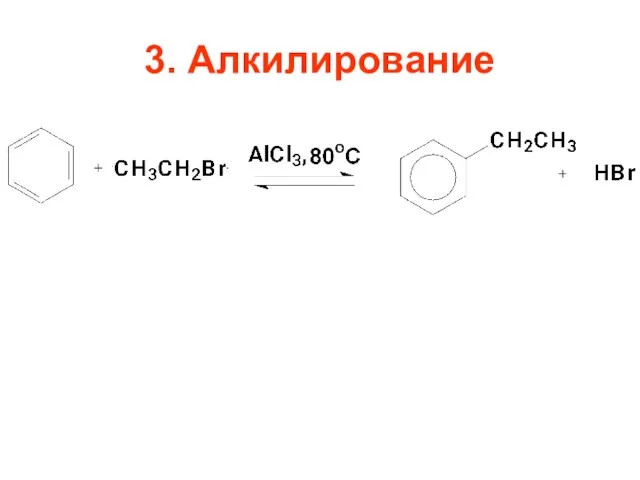
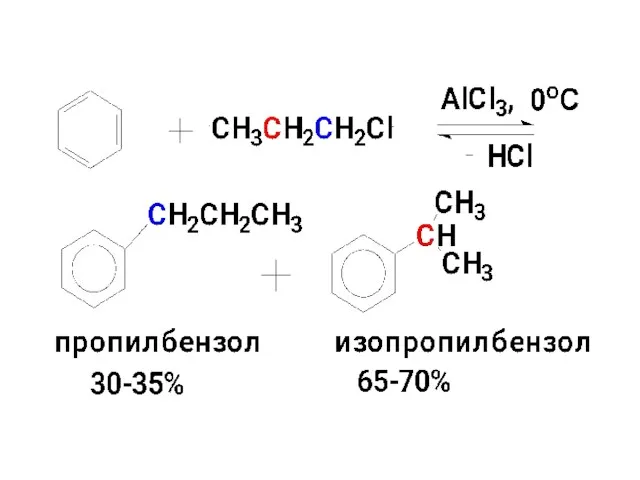
- 91. 3. Алкилирование
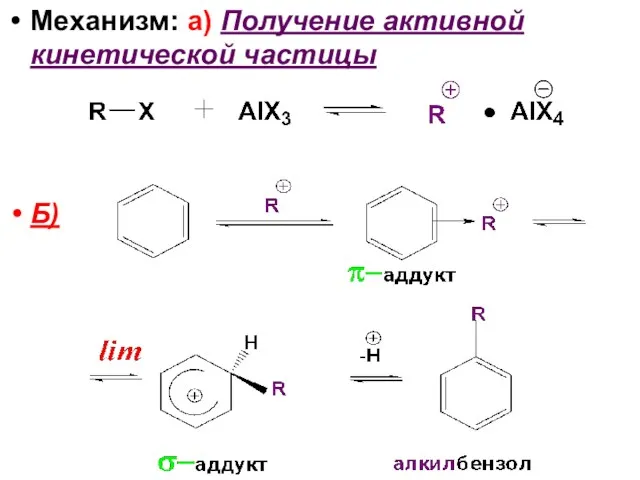
- 93. Механизм: а) Получение активной кинетической частицы Б)
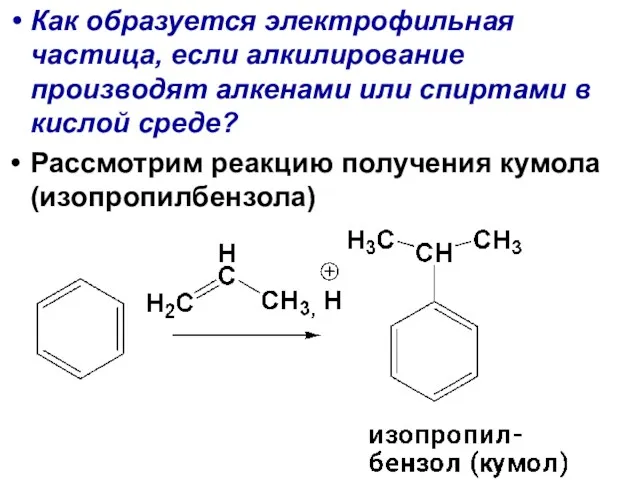
- 94. Как образуется электрофильная частица, если алкилирование производят алкенами или спиртами в кислой среде? Рассмотрим реакцию получения
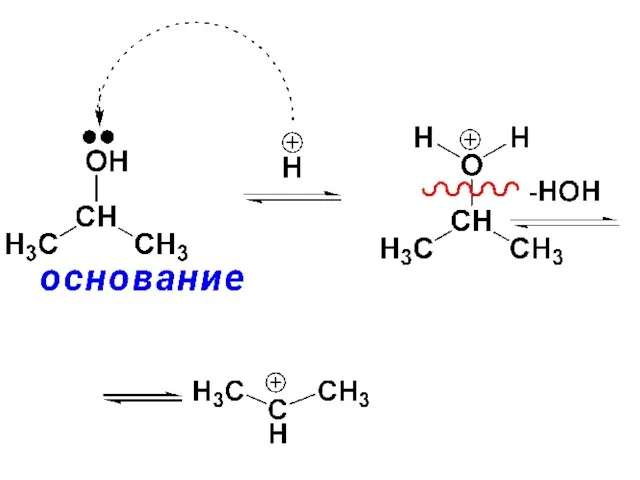
- 95. Если реагентом является спирт, как, например в приведенной ниже реакции
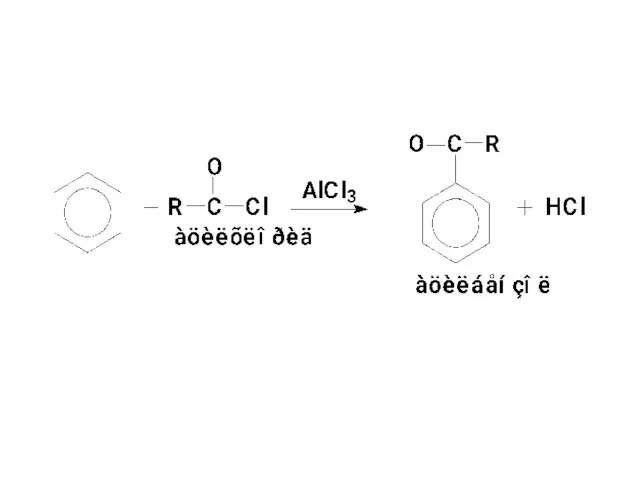
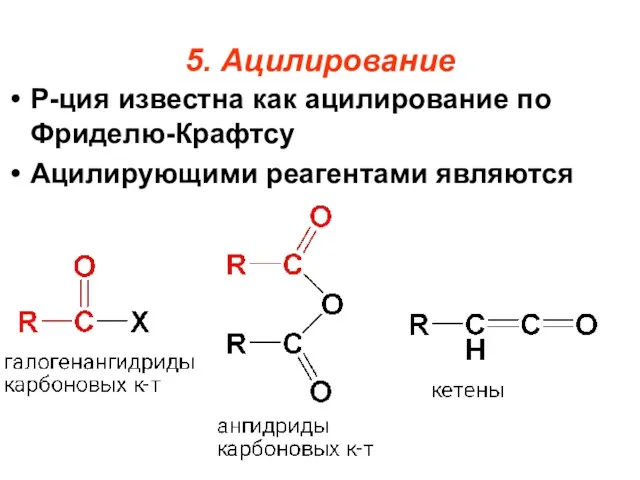
- 97. 5. Ацилирование Р-ция известна как ацилирование по Фриделю-Крафтсу Ацилирующими реагентами являются
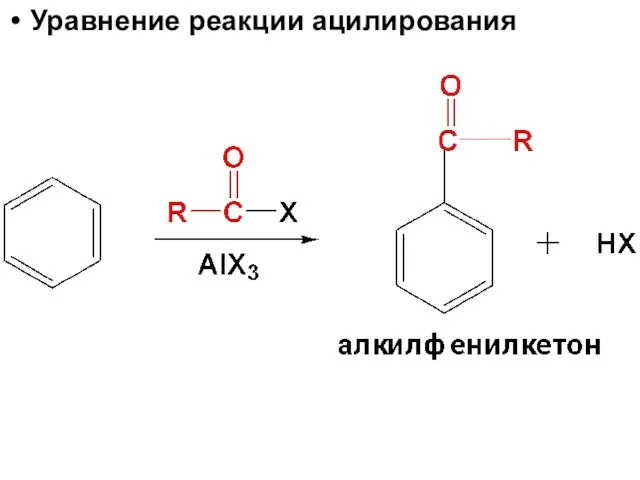
- 98. Уравнение реакции ацилирования
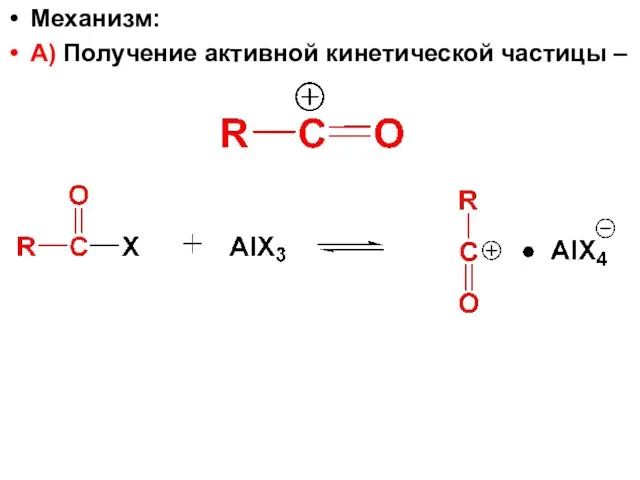
- 99. Механизм: А) Получение активной кинетической частицы –
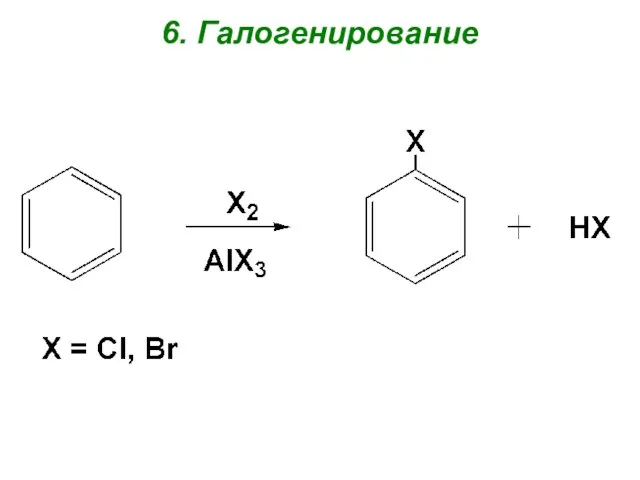
- 101. 6. Галогенирование
- 102. Механизм: Получение активной кинетической частицы
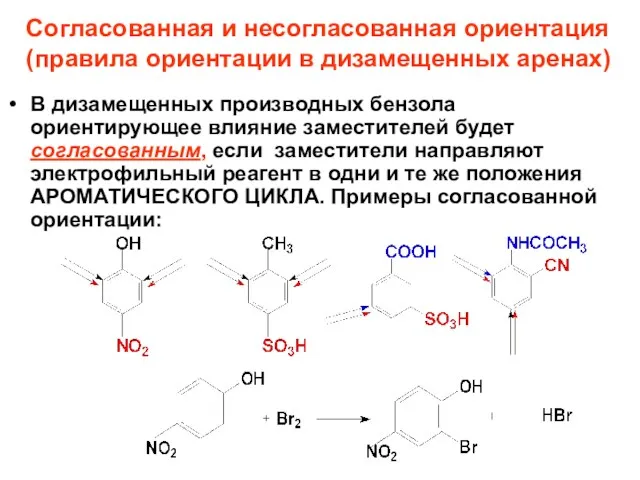
- 103. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни
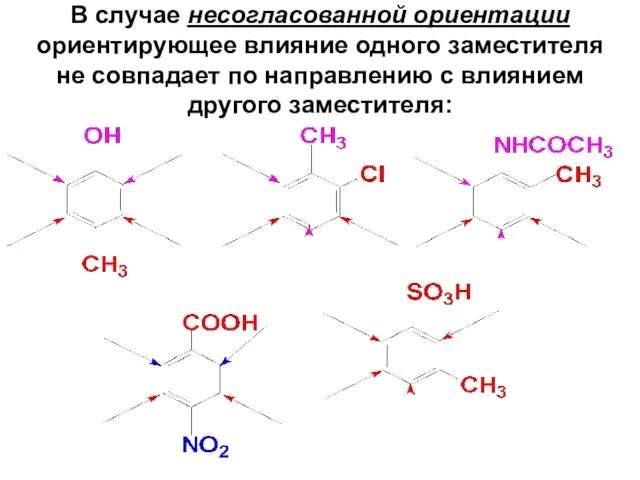
- 104. В случае несогласованной ориентации ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя:
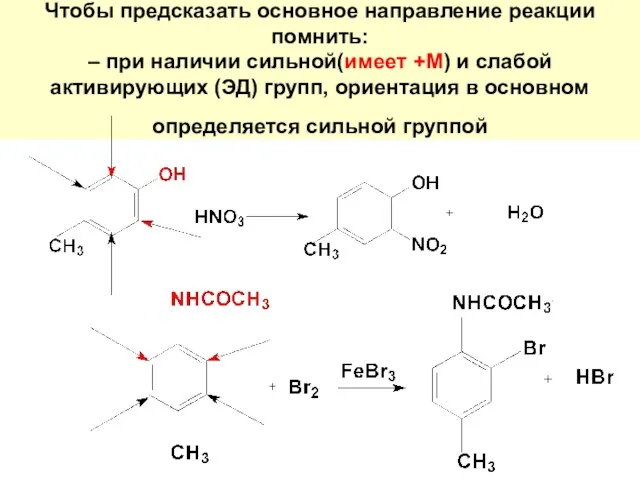
- 105. Чтобы предсказать основное направление реакции помнить: – при наличии сильной(имеет +М) и слабой активирующих (ЭД) групп,
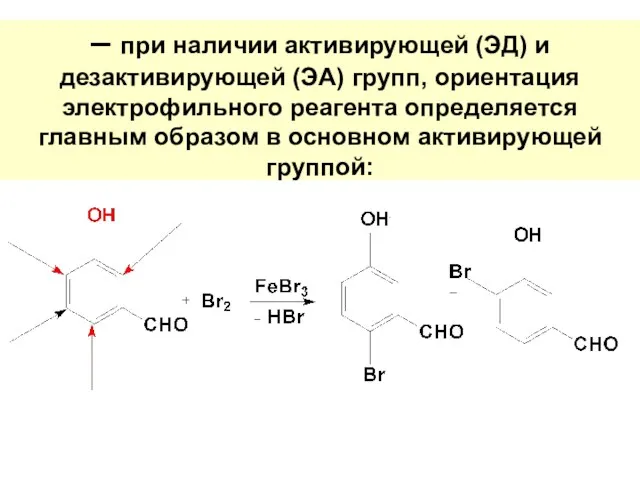
- 106. – при наличии активирующей (ЭД) и дезактивирующей (ЭА) групп, ориентация электрофильного реагента определяется главным образом в
- 107. Атакующий электрофил , как правило, не замещает Н в кольце между двумя заместителями, находящимися в мета-положении
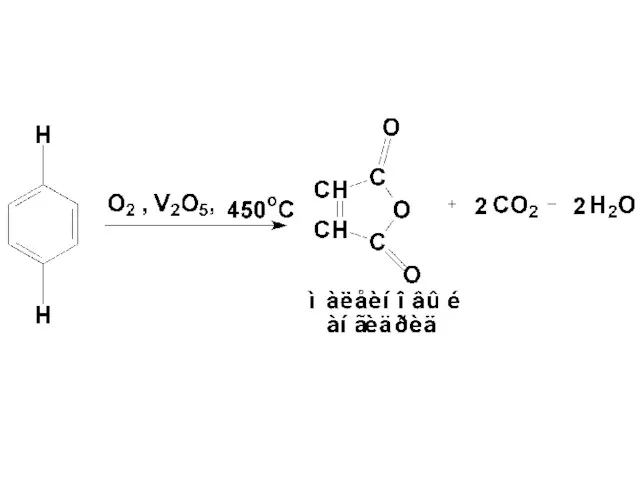
- 108. Реакции бензола с нарушением ароматической системы 1.Окисление По отношению к действию окислителей бензол сходен с алканами.
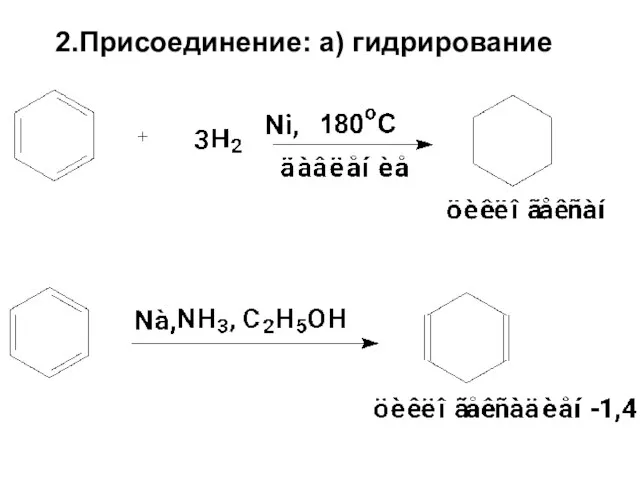
- 110. 2.Присоединение: а) гидрирование
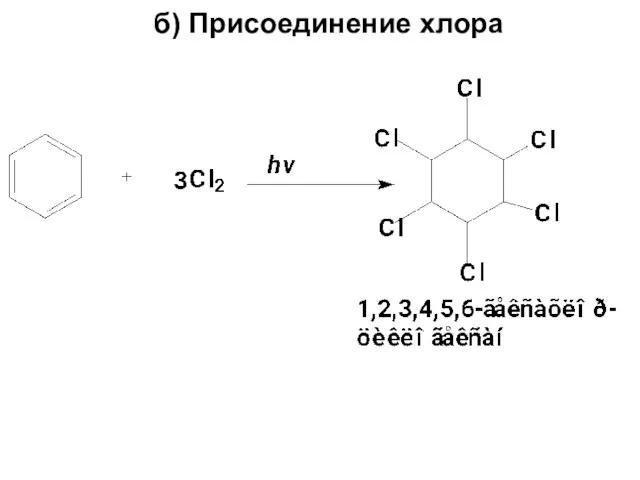
- 111. б) Присоединение хлора
- 112. Гексахлоран использовался ранее в качестве инсектицида. Это сильный пищевой и дыхательный яд (10-12г – смертельная доза
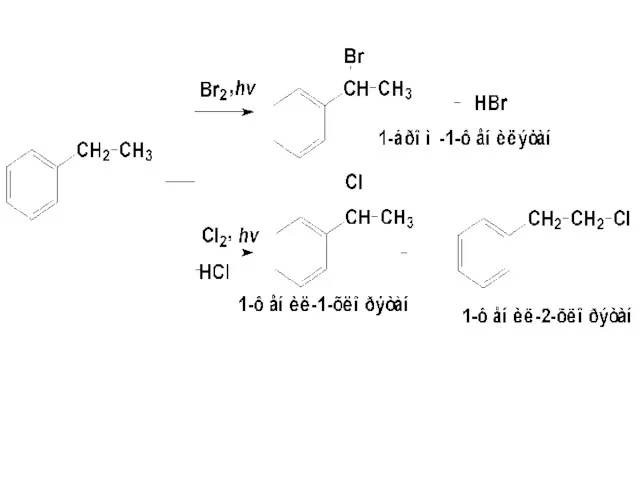
- 113. Реакции боковых цепей в алкилбензолах а) Галогенирование (Учебник стр. 214-215). Алкилбензолы вступают в реакции радикального хлорирования
- 115. В алкилбензолах с более сложной боковой цепью бромирование идет исключительно, а хлорирование предпочтительно с замещением атома
- 117. Скорость замещения бензильного Н в 3,3 выше, чем у третичного атома углерода в алканах из-за более
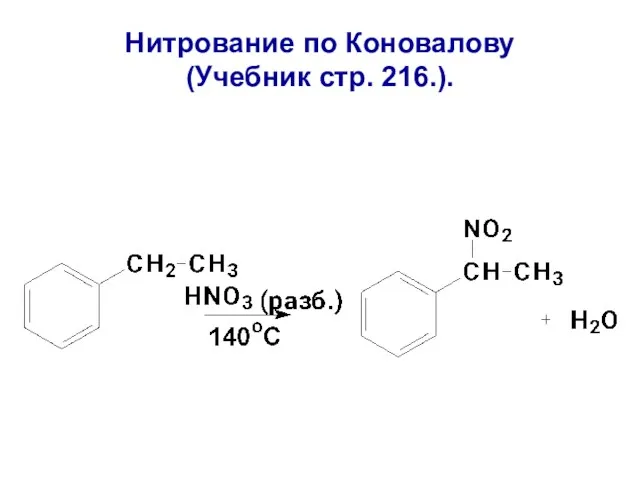
- 118. Нитрование по Коновалову (Учебник стр. 216.).
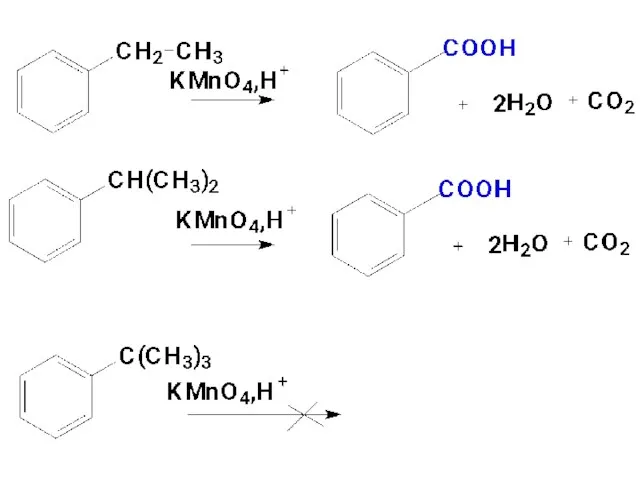
- 119. Алкилбензолы, в которых с бензольным кольцом связана перв- или втор- алкильная группы окисляются ( КМnO4,K2Cr2O7). Независимо
- 122. Скачать презентацию





















































 Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Кинетика химических реакций
Кинетика химических реакций Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Химический элементы в нашей жизни
Химический элементы в нашей жизни Functions of proteins
Functions of proteins Общая характеристика неметаллов
Общая характеристика неметаллов Относительная атомная масса
Относительная атомная масса Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Строение электронных оболочек атомов
Строение электронных оболочек атомов Процесс оксихлорирования
Процесс оксихлорирования Посуда, ее виды и использование
Посуда, ее виды и использование Минералы для ИЗБ
Минералы для ИЗБ Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Синтез нуклеотидов
Синтез нуклеотидов Свойства, состав и применение пластмасс
Свойства, состав и применение пластмасс Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Строение и свойства циклоалканов
Строение и свойства циклоалканов Электронное строение атома
Электронное строение атома Минерализация, иммобилизация, нитрификация және денитрификация процестері
Минерализация, иммобилизация, нитрификация және денитрификация процестері Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Химическая коррозия
Химическая коррозия Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Фосфорлы тыңайытқыштар
Фосфорлы тыңайытқыштар Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения Серная кислота H2SO4
Серная кислота H2SO4