Содержание
- 2. Неметаллические свойства элементов определяются способностью атомов «принимать» электроны, т.е. проявлять при взаимодействии с атомами других элементов
- 3. МЕТАЛЛЫ И НЕМЕТАЛЛЫ В химии принято деление элементов на металлы и неметаллы в зависимости от химических
- 4. Самый сильный окислитель – фтор! Он окисляет даже воду и некоторые благородные газы: 2F2 + 2H2O
- 5. Такая же закономерность в изменении окислительных свойств характерна и для простых веществ соответствующих элементов. Ее можно
- 6. Cl2 + O2 ≠ N2 + O2 = 2NO (только при высокой t) S + O2
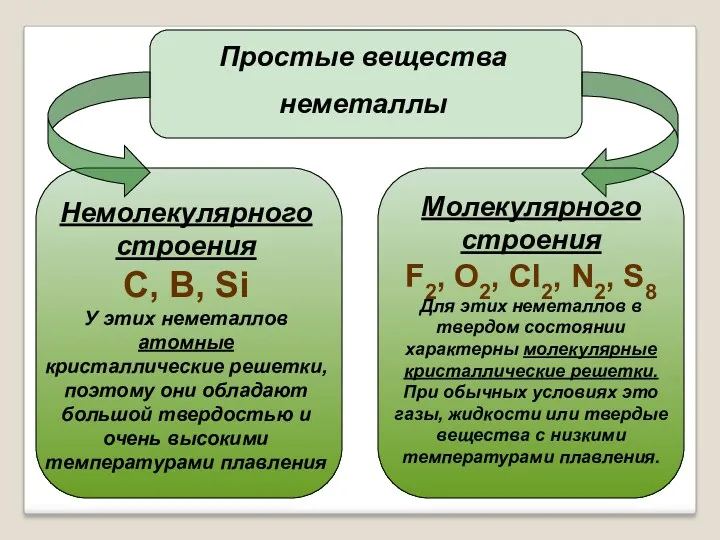
- 7. Простые вещества неметаллы Немолекулярного строения С, В, Si У этих неметаллов атомные кристаллические решетки, поэтому они
- 8. Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же
- 9. Причины аллотропии: Разные типы кристаллических решеток (белый фосфор Р4 – молекулярная, красный фосфор Р – атомная).
- 10. Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и
- 11. Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
- 12. Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде, в жидком состоянии светло-голубой, в
- 13. Способы получения неметаллов Исторически было разработано довольно много способов выделения неметаллов из окружающей среды. • Некоторые
- 14. Химические методы получения неметаллов Как правильно выбрать реагенты для химической реакции? Существуют простые правила - по
- 15. 2. Если неметалл находится в соединении в положительной степени окисления, то для получения простого вещества необходимо
- 16. Электрохимические методы Изменение степени окисления в нужном направлении может быть достигнуто также за счет использования электрического
- 17. Разложение соединений Наконец, некоторые неметаллы образуются при разложении соединений. Для этого в состав исходного вещества одновременно
- 18. Химические свойства неметаллов Неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического
- 19. Взаимодействие с простыми веществами 1. Взаимодействие с металлами: 2Na + Cl2 = 2NaCl, Fe + S
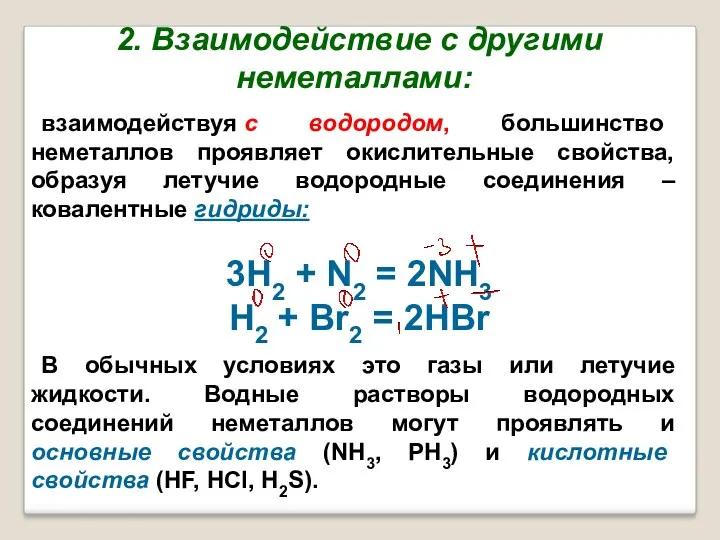
- 20. 2. Взаимодействие с другими неметаллами: взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные
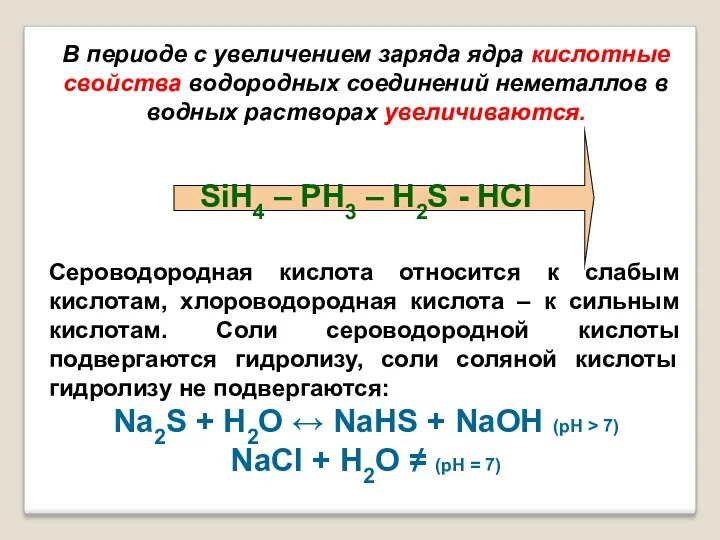
- 21. В периоде с увеличением заряда ядра кислотные свойства водородных соединений неметаллов в водных растворах увеличиваются. SiH4
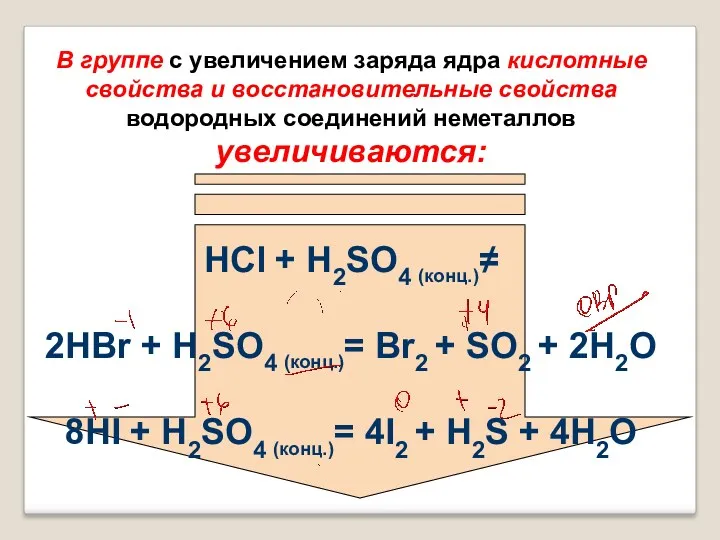
- 22. В группе с увеличением заряда ядра кислотные свойства и восстановительные свойства водородных соединений неметаллов увеличиваются: HCl
- 23. взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные cвойства: S + O2 = SO2
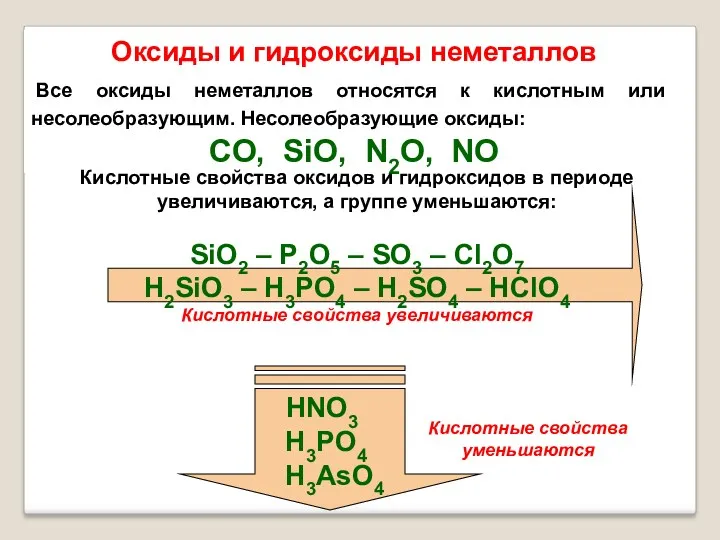
- 24. Оксиды и гидроксиды неметаллов Все оксиды неметаллов относятся к кислотным или несолеобразующим. Несолеобразующие оксиды: CO, SiO,
- 25. Если неметалл может образовывать соединения с разными степенями окисления, то свойства соединений будут зависеть от степени
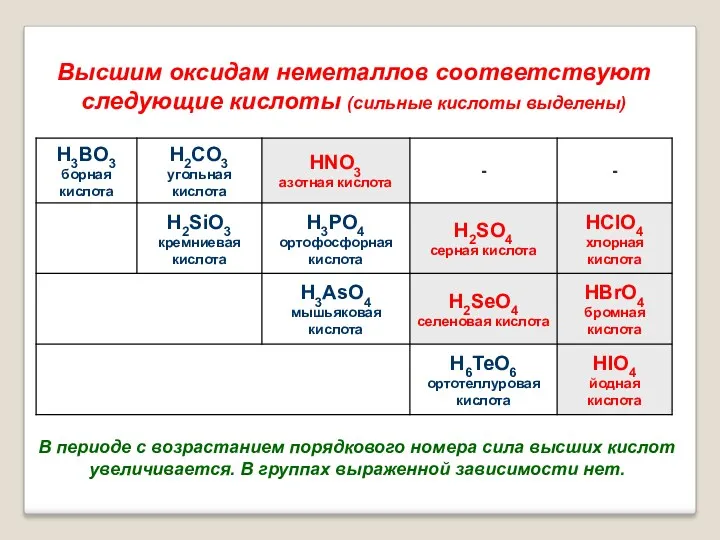
- 26. Высшим оксидам неметаллов соответствуют следующие кислоты (сильные кислоты выделены) В периоде с возрастанием порядкового номера сила
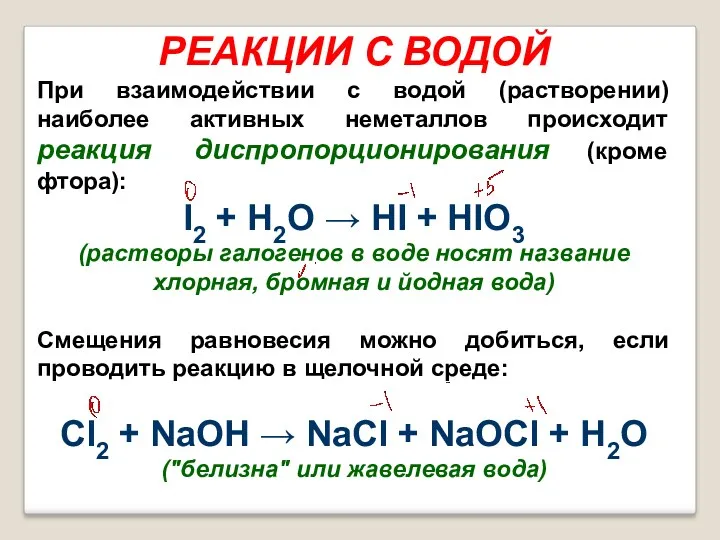
- 27. РЕАКЦИИ С ВОДОЙ При взаимодействии с водой (растворении) наиболее активных неметаллов происходит реакция диспропорционирования (кроме фтора):
- 28. ОСОБЫЕ РЕАКЦИИ С ВОДОЙ • Углерод реагирует с водяным паром только при температуре свыше 900oC: C
- 29. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ Концентрированная серная кислота очень активно взаимодействует с неметаллами, окисляя их до высшей степени
- 30. Азотная кислота как сильный окислитель окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 32. Скачать презентацию






















 Азот в нашей жизни
Азот в нашей жизни Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Получение ткани
Получение ткани Органические и неорганические кислоты
Органические и неорганические кислоты Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Предмет и задачи физической химии
Предмет и задачи физической химии Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Углекислый газ, угольная кислота и её соли
Углекислый газ, угольная кислота и её соли Нефелометрический анализ
Нефелометрический анализ Соли аммония
Соли аммония Природный газ
Природный газ
 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Металлы
Металлы Главная подгруппа IV группы
Главная подгруппа IV группы Свойства воды
Свойства воды Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов Физические свойства минералов
Физические свойства минералов Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Неорганическая химия
Неорганическая химия Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару
Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару