Содержание
- 2. Физические свойства СО2 СО2 – бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха, при обычных
- 3. Химические свойства СО2 СО2 – кислотный оксид. СО2 + 2NaOH = Na2CO3 + H2O СО2 +
- 4. Немного истории Английский химик Дж. Пристли в 1767 году сделал первую бутылку газировки.
- 5. При взаимодействии углекислого газа образуется нестойкое соединение – угольная кислота. Угольная кислота H2CO3 – неустойчивая, в
- 6. Сталактиты и сталагмиты Вода, проникающая в пещеру, растворяет известняк в химической реакции: CaCO3 + H2O +
- 7. При достаточном количестве карбоната кальция в растворе в месте падения капель с конца сталактита на полу
- 8. Сливаясь со временем, сталактит со сталагмитом образуют колонну — сталагнат.
- 9. CaCO3 –мел, мрамор, известняк Na2CO3 – кальцинированная сода NaHCO3 – питьевая сода К2CO3 - поташ
- 11. Скачать презентацию








 Фенол қосылыстары
Фенол қосылыстары Антибиотики как ЛС
Антибиотики как ЛС Металлы и неметаллы
Металлы и неметаллы Основи. Гідроксиди Натрію і Кальцію
Основи. Гідроксиди Натрію і Кальцію Нобелевская премия по химии
Нобелевская премия по химии Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография Органические вещества
Органические вещества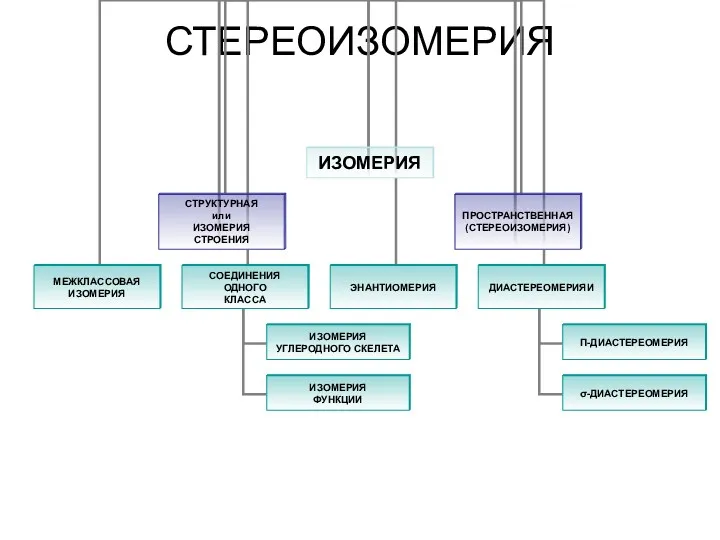 Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды
Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс Құймалар. Механикалық қоспа
Құймалар. Механикалық қоспа История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений
История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Оксид серы(4). Сернистая кислота и её соли
Оксид серы(4). Сернистая кислота и её соли Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Електролітична дисоціація
Електролітична дисоціація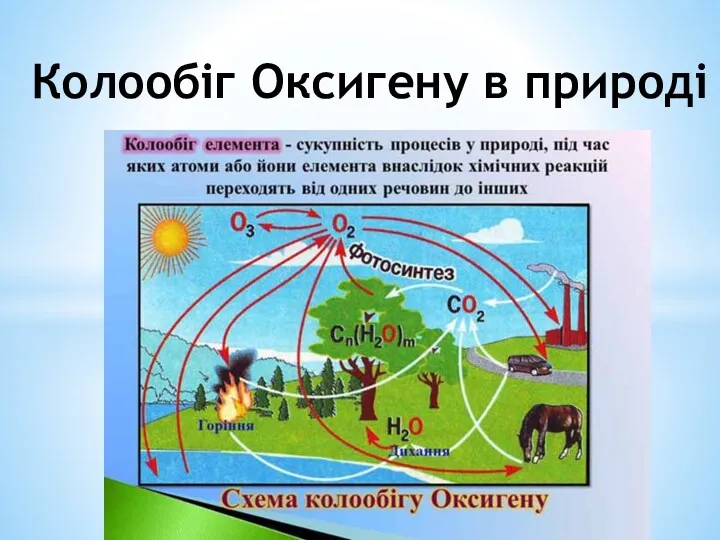 Колообіг оксигену в природі
Колообіг оксигену в природі Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Элемент свинец Рb
Элемент свинец Рb Щелочи
Щелочи Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Вирощування кристалів солей
Вирощування кристалів солей Термопластичные полимеры
Термопластичные полимеры