Содержание
- 2. Электронная оболочка - это совокупность всех электронов атома. Каждый электрон имеет определенный запас энергии, что определяет
- 3. Атомная орбиталь - это часть атомного пространства, в которой вероятность нахождения электрона максимальна. Каждый электрон в
- 4. Энергетический уровень - это совокупность орбиталей, близких по энергии. Количество энергетических уровней у атома совпадает с
- 5. Формы электронных облаков (орбиталей) s-орбиталь имеет сферическую форму и обладает наименьшим запасом энергии, одна такая орбиталь
- 6. Подуровни Энергетический подуровень - это совокупность орбиталей, имеющих одинаковую форму и не отличающихся друг от друга
- 7. Принципы заполнения орбиталей Принцип Паули: на каждой орбитали может находиться не более двух электронов. Правило Хунда:
- 8. Правила определения электронного строения атомов:
- 9. Составление электронной формулы На первом энергетическом уровне: 1 подуровень; 1 орбиталь (s); максимум 2 электрона. На
- 10. Порядок заполнения электронами орбиталей: 1s→ 2s → 2p → 3s → 3p → 4s → 3d
- 11. Составление графической схемы 1 2 3 4
- 13. Скачать презентацию










 Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Экологический мониторинг. Техника пробоотбора и пробоподготовки. Лекция 1
Экологический мониторинг. Техника пробоотбора и пробоподготовки. Лекция 1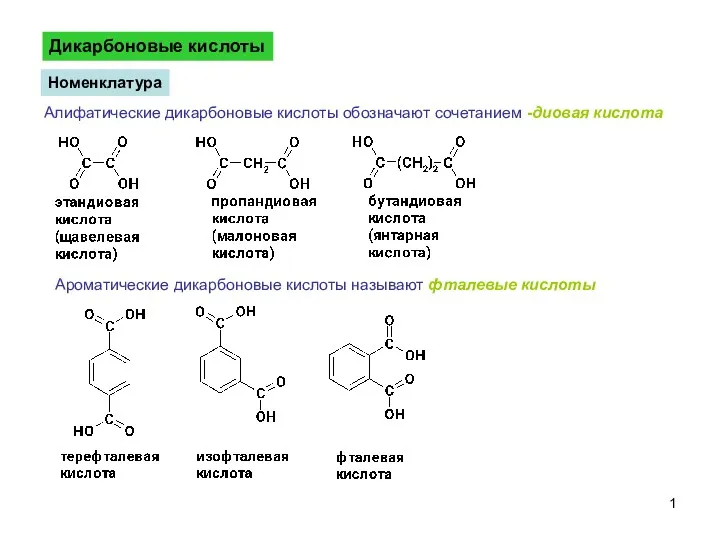 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Химия элементов VIA группы
Химия элементов VIA группы Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы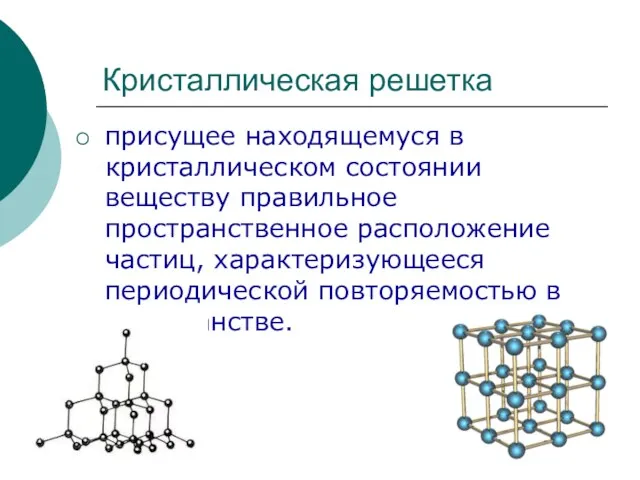 Кристаллическая решетка
Кристаллическая решетка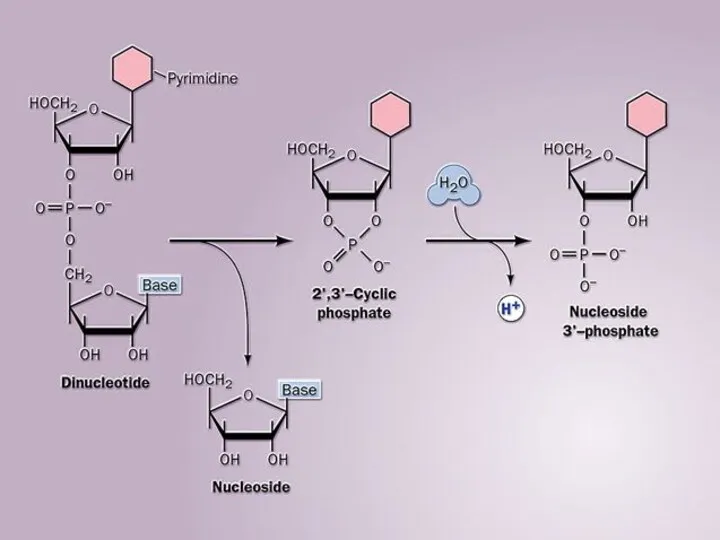 Functions of proteins
Functions of proteins Строение и свойства металлов и сплавов. Тема 1
Строение и свойства металлов и сплавов. Тема 1 Метасоматические горные породы
Метасоматические горные породы Липиды. Составные части липидов
Липиды. Составные части липидов Полудрагоценные камни
Полудрагоценные камни Поняття про неорганічні та органічні речовини
Поняття про неорганічні та органічні речовини Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс) Многоатомные спирты
Многоатомные спирты Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10 Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Катализ. Основные принципы катализа. Активность катализатора
Катализ. Основные принципы катализа. Активность катализатора Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение
Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3 Термодинамика химического равновесия
Термодинамика химического равновесия Продолжение лекции Химическая связь
Продолжение лекции Химическая связь Основания. Значение оснований
Основания. Значение оснований