Содержание
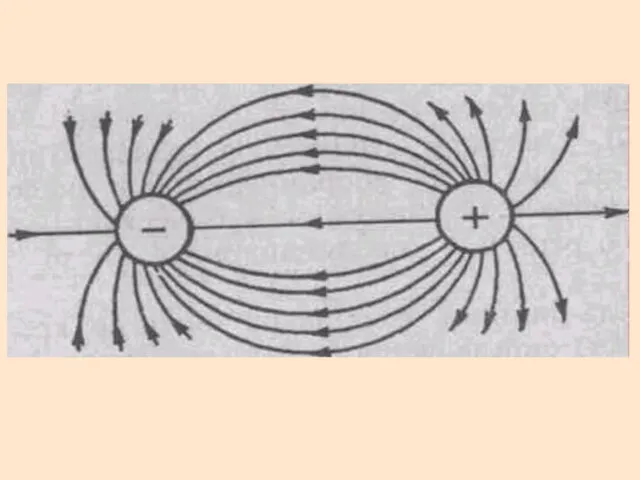
- 2. Дипольный момент – количественная характеристика полярности связи μ = qэфф⋅lдип qэфф– эффект. заряд, lдип – длина
- 3. Дипольный момент – векторная величина, направленная от (+) к (–) Различают дип. моменты хим. связи и
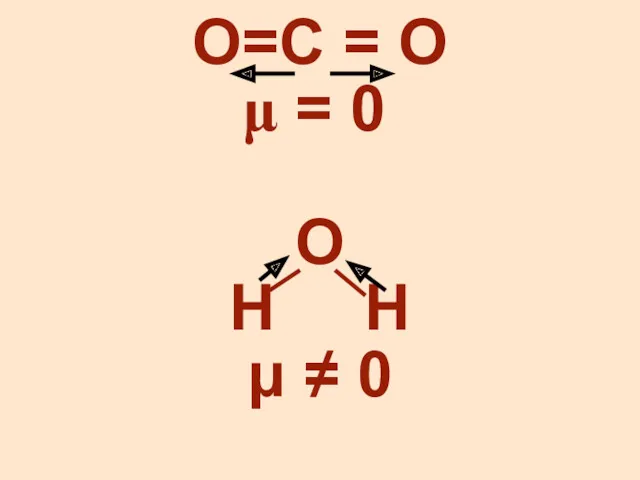
- 4. О=С = О = 0 О Н Н μ ≠ 0
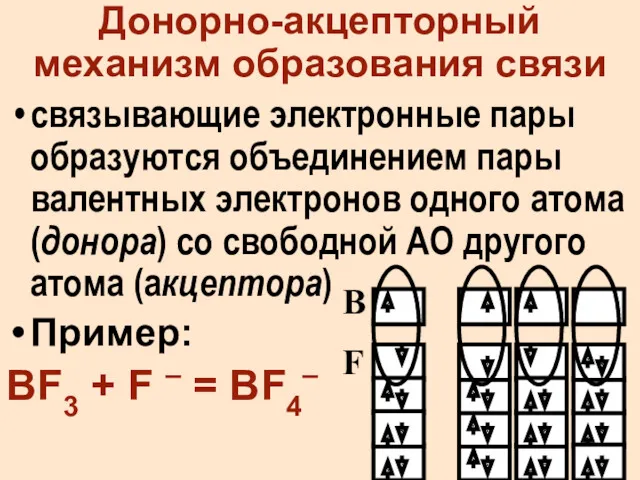
- 5. Донорно-акцепторный механизм образования связи связывающие электронные пары образуются объединением пары валентных электронов одного атома (донора) со
- 6. Кратность хим. связи - число общих электронных пар, реализующих связь между двумя атомами Чем выше кратность
- 7. Гибридизация АО Это математический прием отыскания новых волновых функций, удовлетворяющих условию равнопрочности образуемых связей и уменьшению
- 8. Основные положения гибридизации Гибридизуются только орбитали центрального атома Гибридизуются АО с близкой энергией Число гибридных орбиталей
- 9. Гибридные орбитали более вытянуты в пространстве и обеспечивают более полное перекрывание с соседними атомами Гибридные орбитали
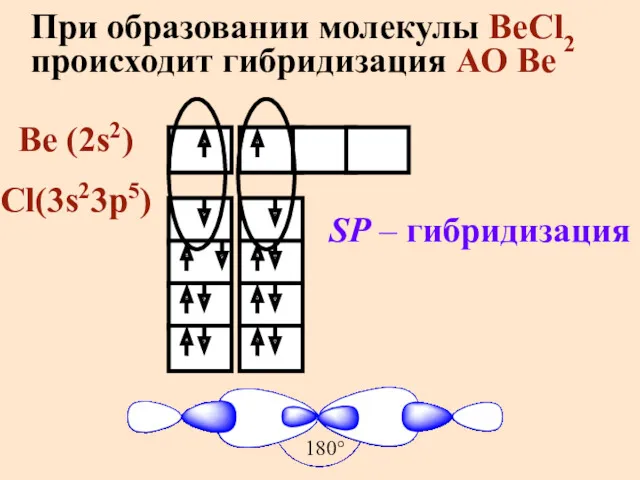
- 10. При образовании молекулы BeCl2 происходит гибридизация АО Be Be (2s2) Cl(3s23p5) SP – гибридизация 180°
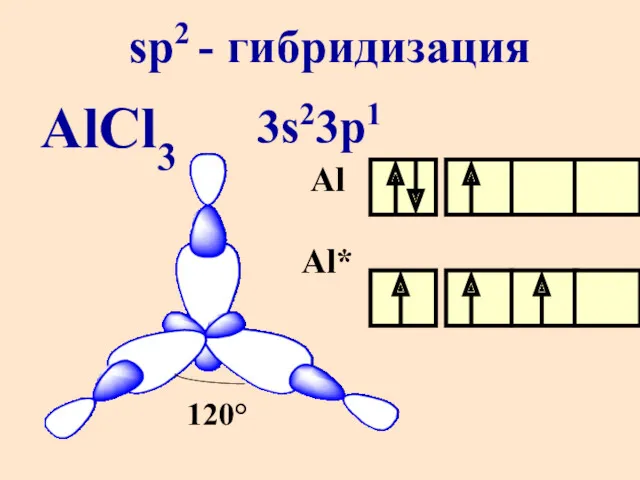
- 11. AlCl3 sp2 - гибридизация 3s23p1 Al Al* 120°
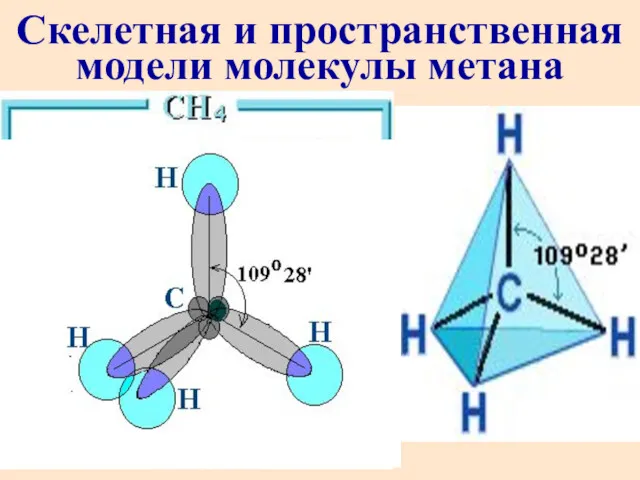
- 12. Скелетная и пространственная модели молекулы метана
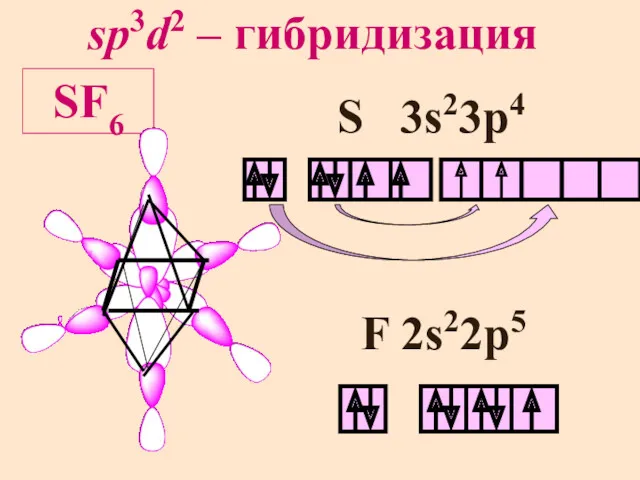
- 13. sp3d2 – гибридизация SF6 S 3s23p4 F 2s22p5
- 14. В гибридизации могут участвовать: Одноэлектронные орбитали Орбитали со спаренными электронами Орбитали без электронов Геометрия молекул и
- 15. Орбитали, участвующие в образовании хим. связи наз-ся связывающими Орбитали, не участвующие в образовании хим. связи наз-ся
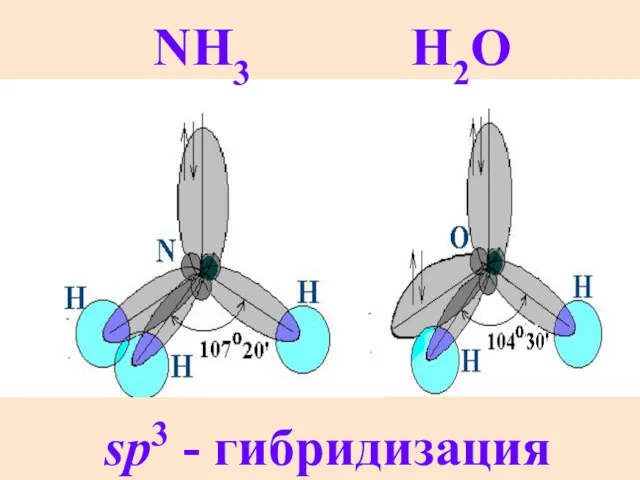
- 16. NH3 H2O sp3 - гибридизация
- 17. Метод ОЭПВО (метод Гиллеспи) (отталкивание электронных пар валентной оболочки) Объясняет геометрическое строение молекул с различными орбиталями:
- 18. Основные положения метода МО В образовании хим.св. могут участвовать как пара, так и один электрон Состояние
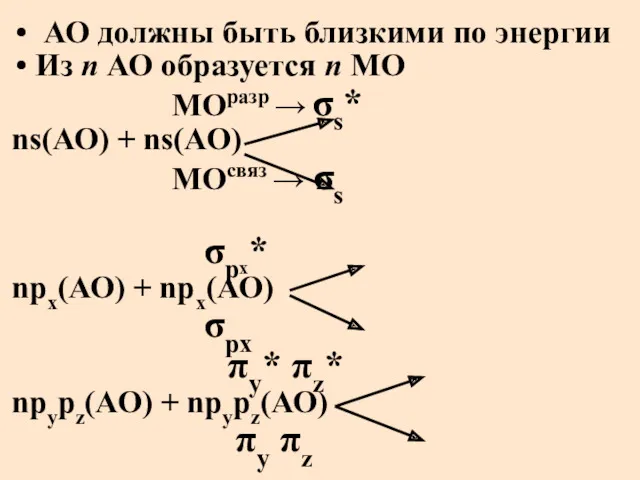
- 19. АО должны быть близкими по энергии Из n АО образуется n МО МОразр → σs* ns(АО)
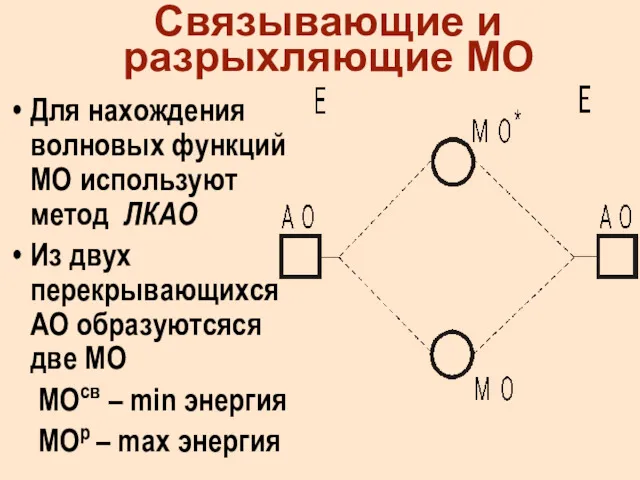
- 20. Связывающие и разрыхляющие МО Для нахождения волновых функций МО используют метод ЛКАО Из двух перекрывающихся АО
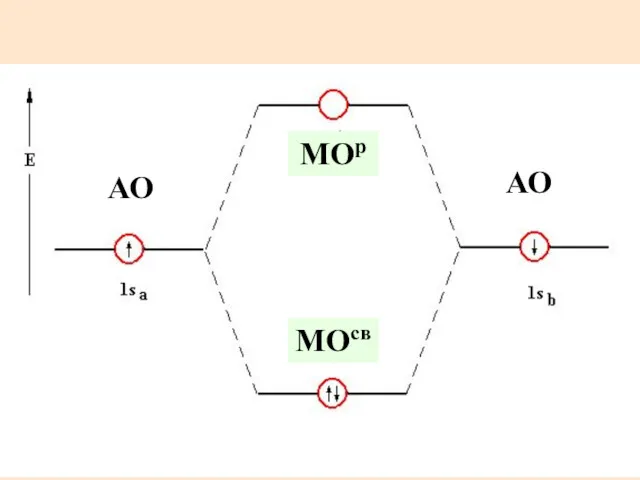
- 21. Распределение электронов по МО в Н2 МОр МОсв АО АО
- 22. Энергетическая диаграмма позволяет определить: Магнитные свойства вещества Порядок (кратность) связи в молекуле Порядок связи = Увеличивается
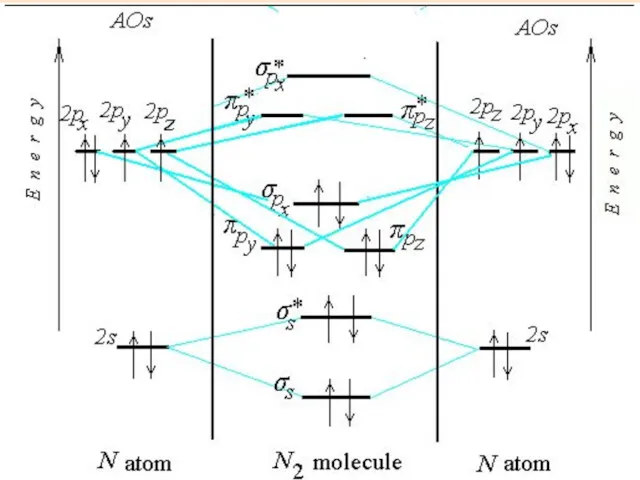
- 23. Изоэлектронные частицы N2, CO, NO+ имеют одинаковый набор МО, их одинаковую энергетическую последовательность, заселенность электронами и
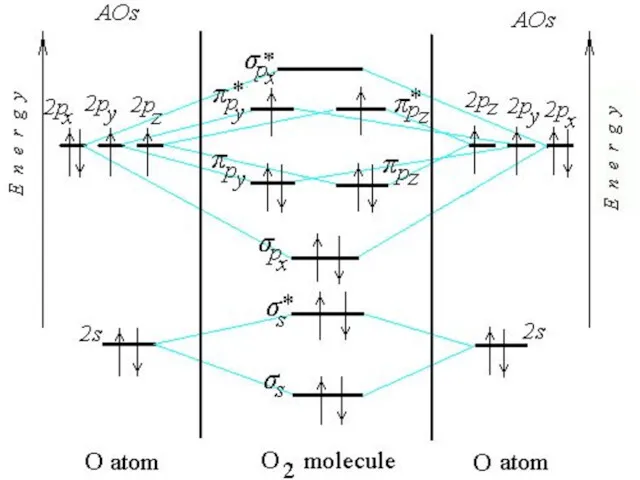
- 24. O2
- 25. N2 N2
- 26. Электронная формула молекулы O2 (KK)σs2σs*2σpx2 πy2πz2πy*1πz*1 Обозначение (KK) относится к внутренним электронам в O2 N2 (KK)σs2σs*2σpx2πy2πz2
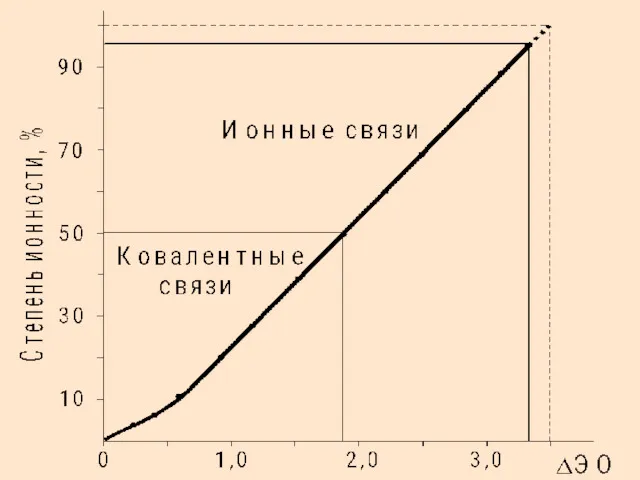
- 27. Ионная связь Это предельный случай полярной ковалентной связи, когда степень ионности > 50% или ΔЭО >
- 28. Ионная связь Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов Ионные соединения состоят из огромного
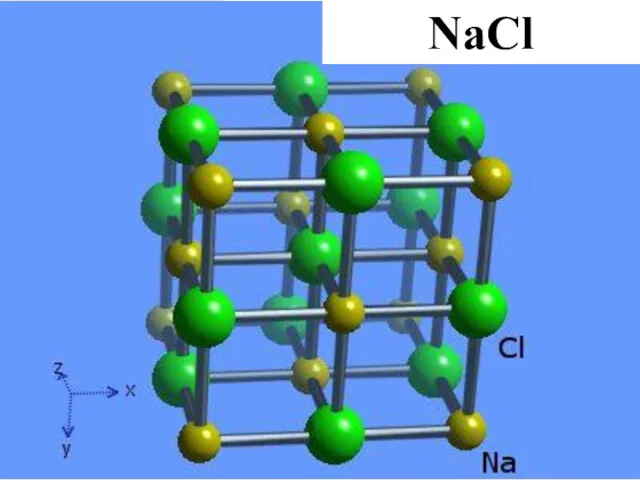
- 29. В соединениях с большой долей ионности связи возникают не молекулы, а твердые тела с ионным кристаллическим
- 31. Свойства ионной связи: - ненаправленность - ненасыщаемость
- 32. Ненаправленность и ненасыщаемость В ионном соединении каждый ион притягивает к себе независимо от направления неограниченное число
- 34. Na Cl NaCl
- 35. Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества При плавлении и растворении
- 36. Поляризация Это влияние друг на друга ионов, которое приводит к деформации электронных оболочек Причина - действие
- 37. Поляризуемость - деформация электронного облака в электрическом поле Поляризующая способность - деформирующее влияние на другие ионы
- 38. Поляризуемость иона возрастает с ув-м размеров иона Li+ – Na+ – K+ – Rb+ – Cs+
- 39. Поляризующая способность ионов зависит от заряда, размера и типа иона Чем > заряд иона, тем >
- 40. Катионы d-элементов обладают (при одном и том же заряде и близком радиусе) большей поляризующей способностью, чем
- 41. Влияние поляризации на свойства соединений: растворимость термическая устойчивость окраску
- 42. Пример AgCl хуже растворим в воде, чем NaCl и KСl Причина более сильное поляризующее действие Ag+
- 43. Пример: Оксо-кислоты менее устойчивы при нагревании, чем их соли Причина - сильное поляризующее действие Н+. Внедряясь
- 44. Металлическая связь образуется в металлах и их сплавах Осуществляется между ионами, атомами металлов и делокализованными электронами
- 45. Природа металлической связи основана на обобществлении валентных электронов, т.к. валентных электронов меньше, чем вакантных орбиталей, валентные
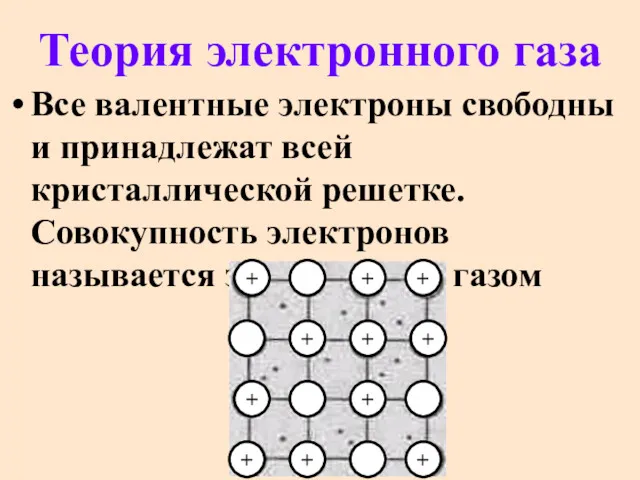
- 46. Теория электронного газа Все валентные электроны свободны и принадлежат всей кристаллической решетке. Совокупность электронов называется электронным
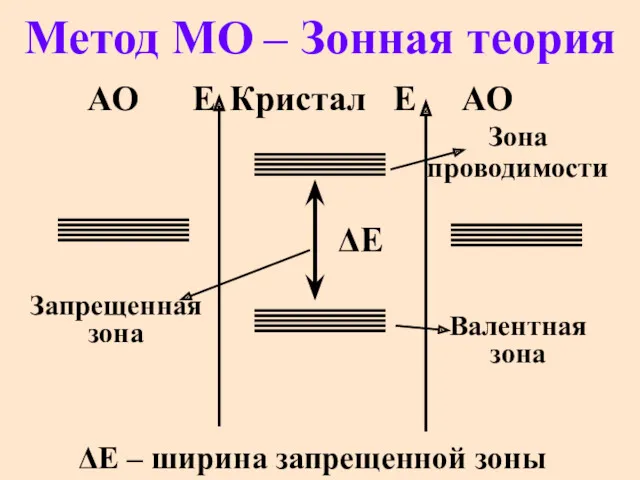
- 47. Метод МО – Зонная теория ΔЕ – ширина запрещенной зоны АО Е Кристал Е АО ΔЕ
- 48. ΔЕ = 0 для металлов ΔЕ ≥ 4,0 эВ для диэлектриков ΔЕ от 0 до 4,0
- 49. Межмолекулярные взаимодействия называют силами Ван дер Ваальса Обеспечивает переход из одного агрегатного состояния в другое, определяет
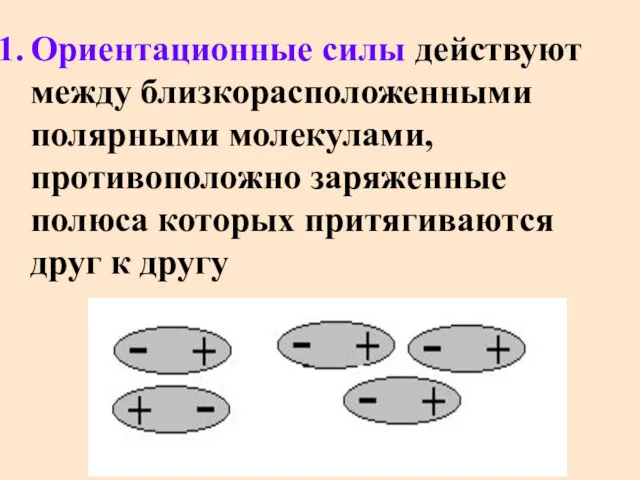
- 50. Ориентационные силы действуют между близкорасположенными полярными молекулами, противоположно заряженные полюса которых притягиваются друг к другу
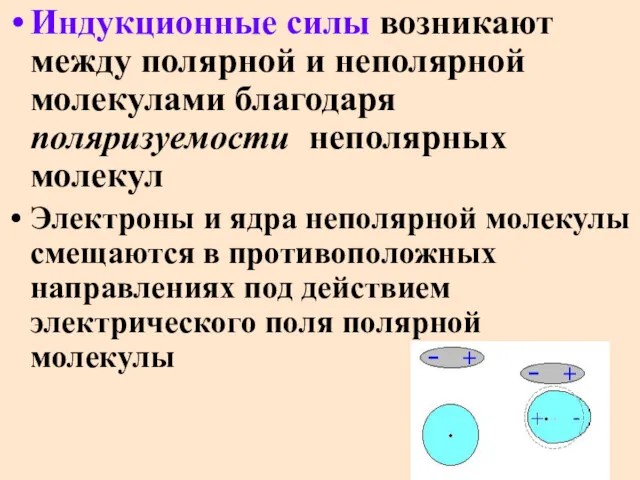
- 51. Индукционные силы возникают между полярной и неполярной молекулами благодаря поляризуемости неполярных молекул Электроны и ядра неполярной
- 52. Дисперсионное взаимодействие (наиболее универсальное) Возникает в неполярных молекулах, т.е. возникают мгновенные диполи в результате взаимного притяжения
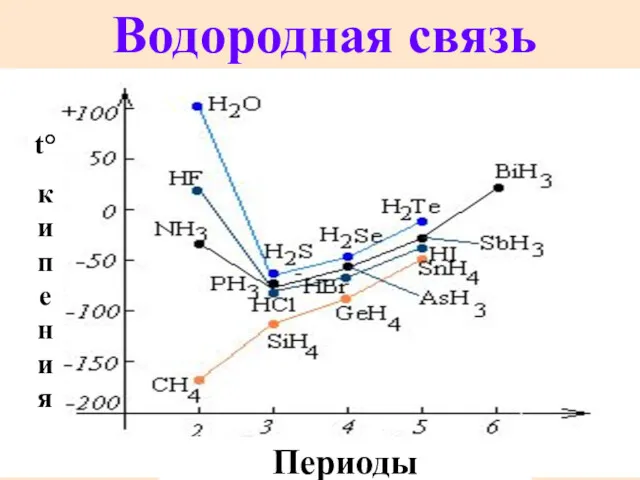
- 53. Водородная связь Периоды t° кипения
- 54. Водородная связь бывает внутримолекулярная (чаще в орг. молекулах) и межмолекулярная (HF, NH3, H2O, H2O2, H2SO4, H3PO4)
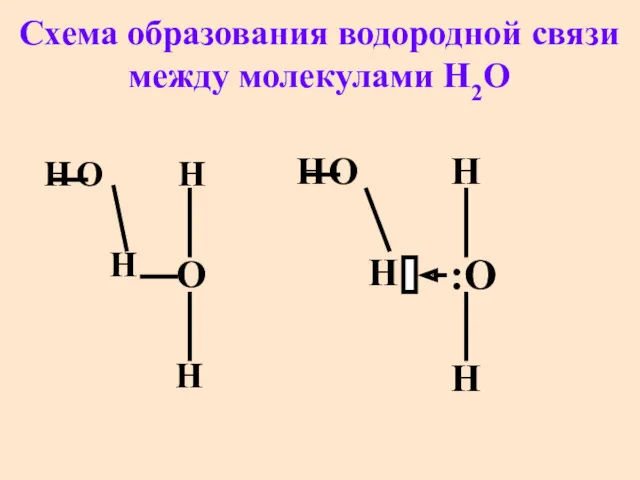
- 55. Cхема образования водородной связи между молекулами H2O Н О Н О Н Н Н О Н
- 57. Скачать презентацию

































 Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері Цікаві факти про хімію
Цікаві факти про хімію Алкены
Алкены Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Материаловедение и технология конструкционных материалов. Полимерное материаловедение
Материаловедение и технология конструкционных материалов. Полимерное материаловедение Газы, применяемые при сварке
Газы, применяемые при сварке Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Равновесные электрохимические системы
Равновесные электрохимические системы Химическая связь
Химическая связь Химические уравнения
Химические уравнения Научно – исследовательская работа Газированная вода - вред или польза?
Научно – исследовательская работа Газированная вода - вред или польза? Углеводы (сахариды)
Углеводы (сахариды) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Основные классы химических соединений
Основные классы химических соединений Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов Ациклические углеводороды
Ациклические углеводороды Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие Аминокислоты и белки. 9 класс
Аминокислоты и белки. 9 класс Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток
Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток Химическое равновесие в газах и растворах
Химическое равновесие в газах и растворах Проект: жило-было мыло
Проект: жило-было мыло