Содержание
- 2. Содержание Строение алкенов Изомерия и номенклатура алкенов Физические свойства Получение Химические свойства Применение алкенов Контрольные вопросы
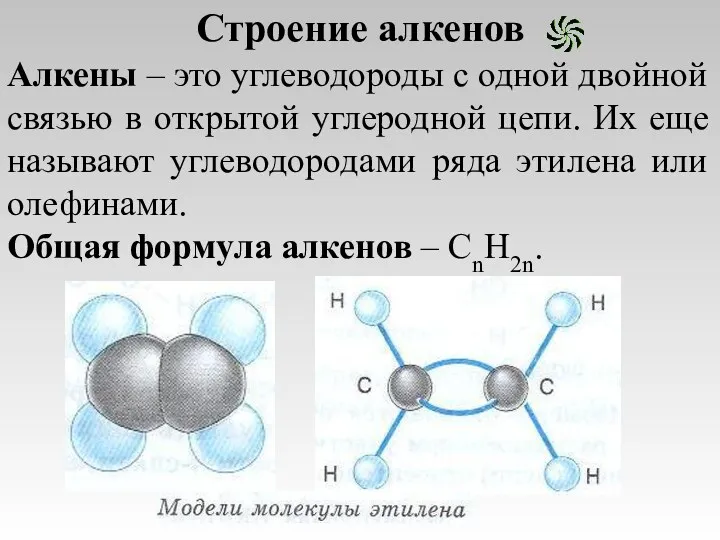
- 3. Строение алкенов Алкены – это углеводороды с одной двойной связью в открытой углеродной цепи. Их еще
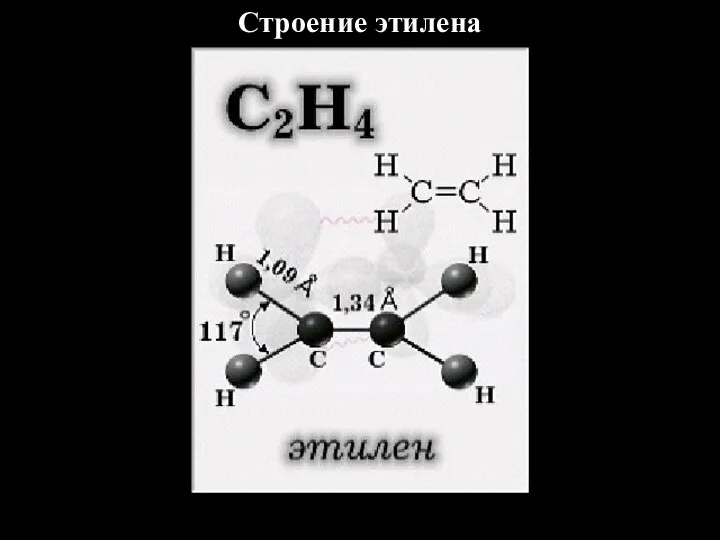
- 4. Строение этилена
- 5. Изомерия и номенклатура алкенов ен ан илен H2C = CH2 – этен (этилен) H2C = CH
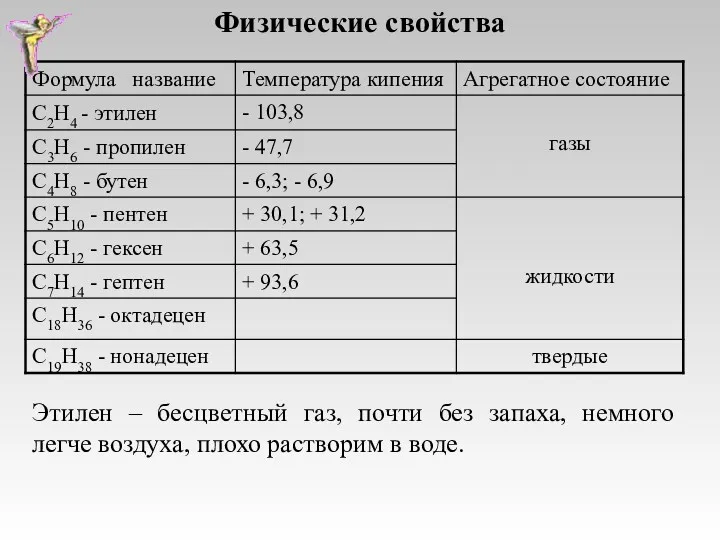
- 6. Физические свойства Этилен – бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде.
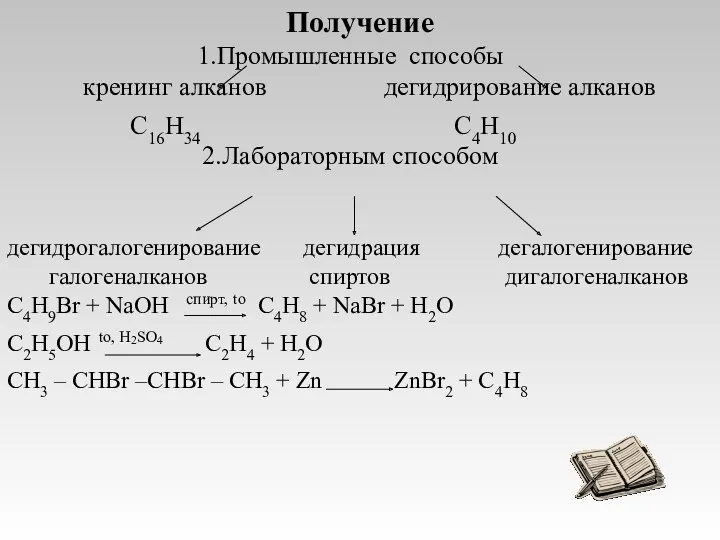
- 7. Получение Промышленные способы кренинг алканов дегидрирование алканов C16H34 C4H10 Лабораторным способом дегидрогалогенирование дегидрация дегалогенирование галогеналканов спиртов
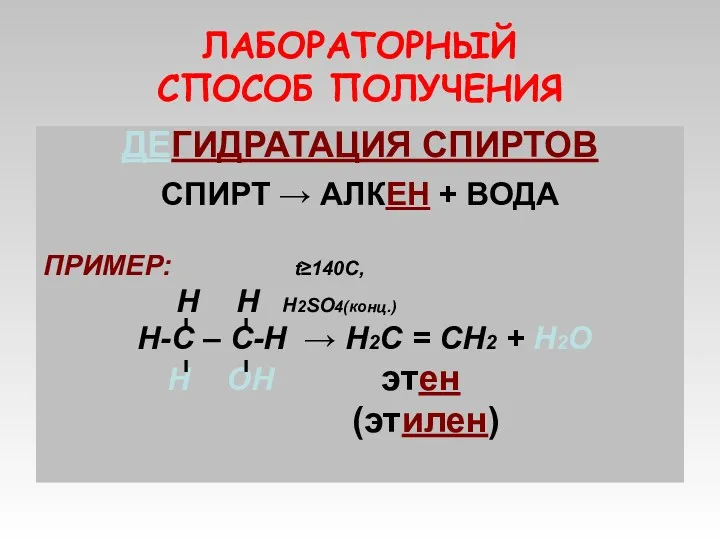
- 8. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
- 9. Получение алкенов КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИННОЙ УГЛЕРОДНОЙ
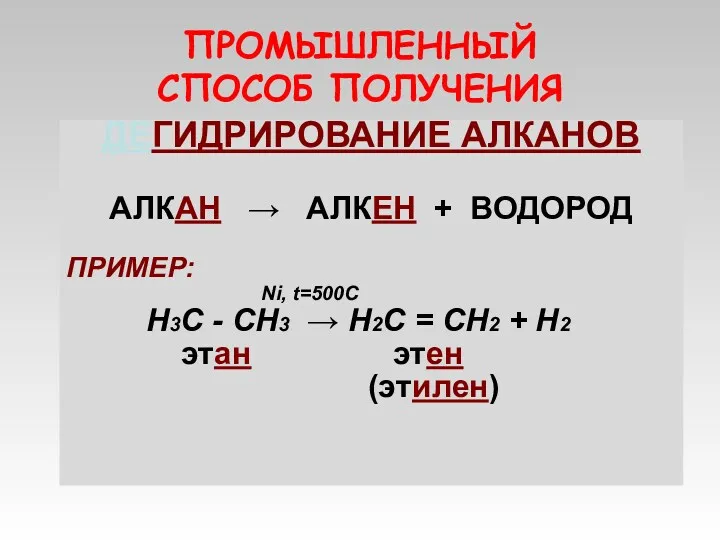
- 10. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
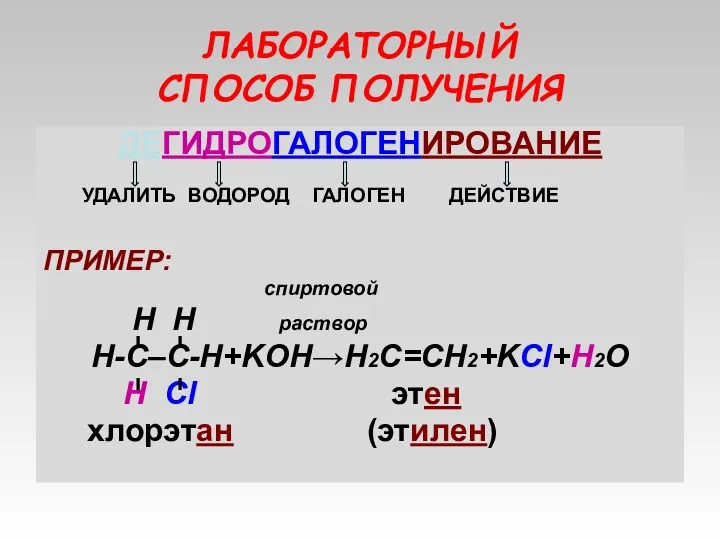
- 11. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
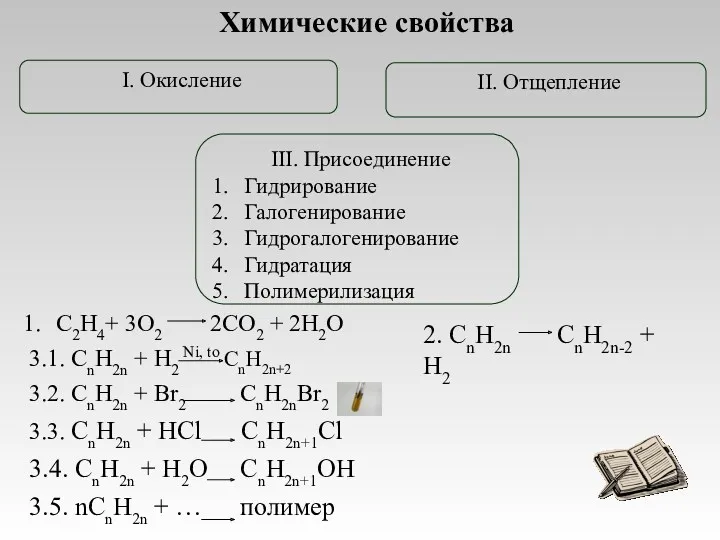
- 12. Химические свойства III. Присоединение Гидрирование Галогенирование Гидрогалогенирование Гидратация Полимерилизация
- 13. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] +
- 14. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
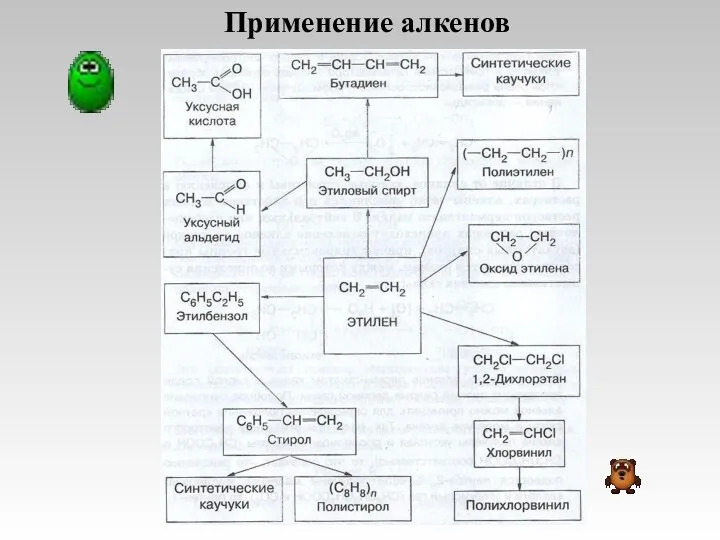
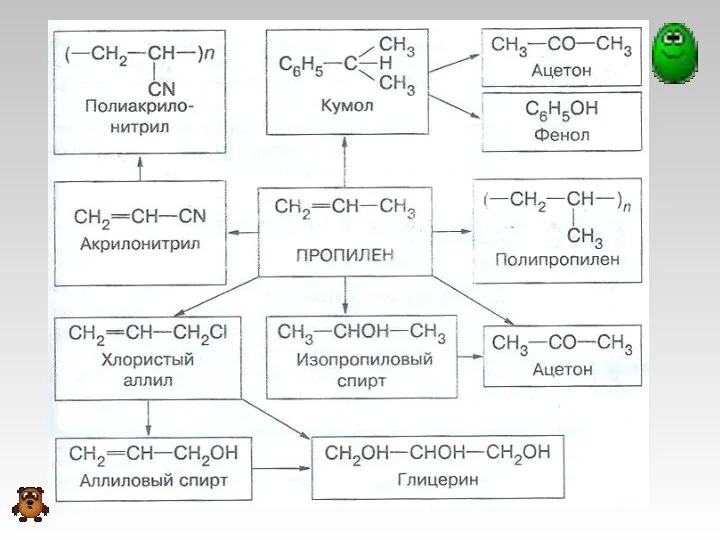
- 15. Применение алкенов
- 17. Контрольные вопросы 1. Вставьте в текст соответствующие слова и символы из скобок. Алкенами называются углеводороды, содержащие
- 18. 2. Алкены можно также назвать: а) этиленовыми углеводородами, б) олефиновыми углеводородами, в) непредельными углеводородами, г) все
- 19. 5. Соотнесите: тип углеводорода: 1) алканы, 2) алкены; формула: а) C2 H4, б) CH4, в) C7H16,
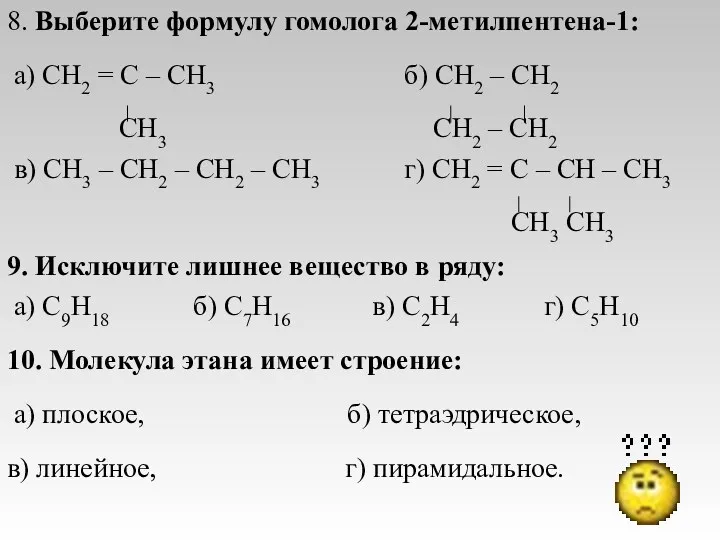
- 20. 8. Выберите формулу гомолога 2-метилпентена-1: а) CH2 = C – CH3 б) CH2 – CH2 CH3
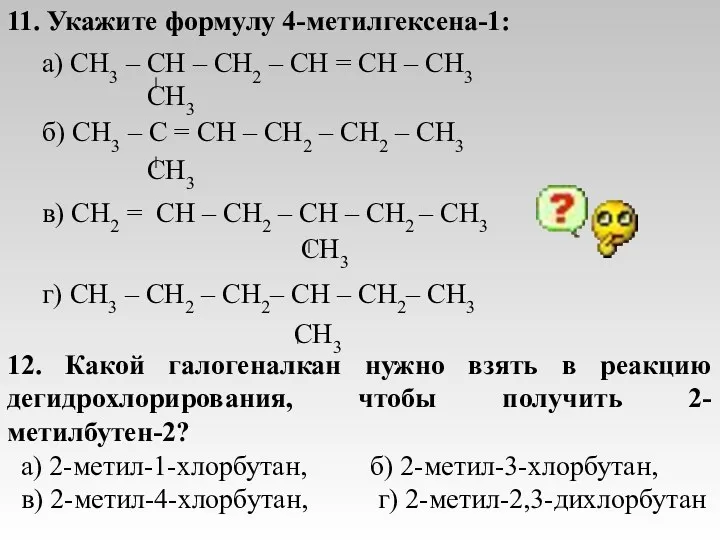
- 21. 11. Укажите формулу 4-метилгексена-1: а) CH3 – CH – CH2 – CH = CH – CH3
- 22. 13. Укажите формулу изомера 2,3-диметилпентена-2: а) CH3– CH = CH – CH – CH3 б) CH2
- 23. 15. Какой тип реакции не характерен для алкенов? а) замещение б) присоединение в) окисление г) полимеризации
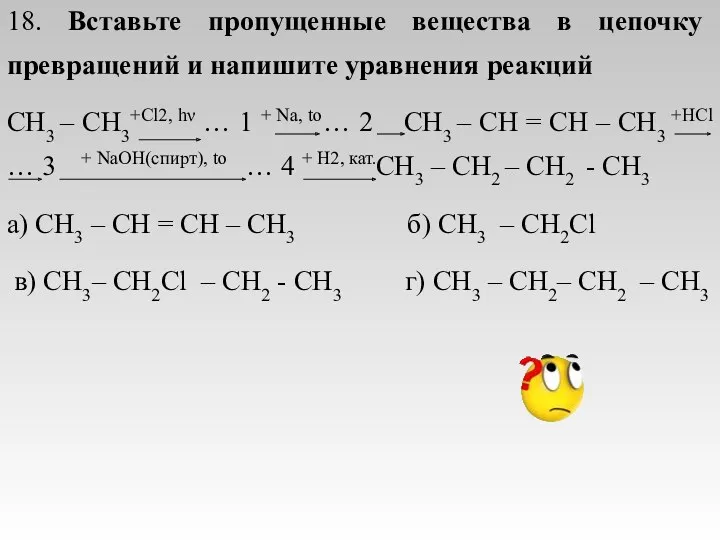
- 24. 18. Вставьте пропущенные вещества в цепочку превращений и напишите уравнения реакций CH3 – CH3+Cl2, hν …
- 26. Скачать презентацию










 Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10 Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях
Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях Изомерия. Кислотность органических соединений
Изомерия. Кислотность органических соединений Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Карбонильные соединения
Карбонильные соединения Alkaline earth metals
Alkaline earth metals Вуглеводи
Вуглеводи Яды и химикаты
Яды и химикаты Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Новые катализаторы
Новые катализаторы Зелёные камни
Зелёные камни Analytical chemistry methods
Analytical chemistry methods Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии Простые вещества неметаллы
Простые вещества неметаллы Аналитические методы
Аналитические методы Галогены. Хлор
Галогены. Хлор Классификация неорганических веществ. Оксиды и основания
Классификация неорганических веществ. Оксиды и основания Химиялық элемент оттегі
Химиялық элемент оттегі Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Минерал лазурит. Месторождения
Минерал лазурит. Месторождения Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Рідкі кристали
Рідкі кристали Химия в быту
Химия в быту Жесткость воды
Жесткость воды