Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о структурной и пространственной изомерии и о концепции протолитической теории кислотности
- 3. ПЛАН ЛЕКЦИИ Изомерия. Кислотность и основность органических соединений.
- 4. Для биоорганической и биологической химии изомерия является причиной разной биологической активности. То есть только определенные изомеры
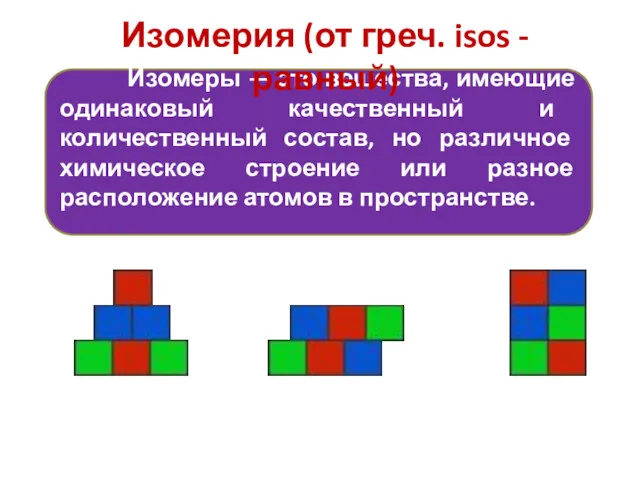
- 5. Изомеры — это вещества, имеющие одинаковый качественный и количественный состав, но различное химическое строение или разное
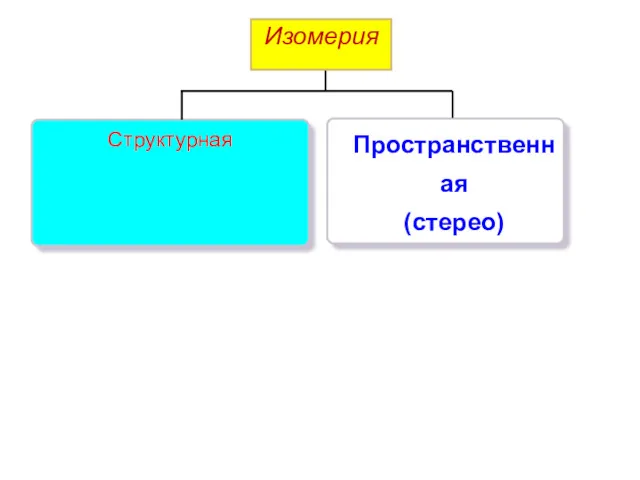
- 6. Изомерия Пространственная (стерео) Структурная
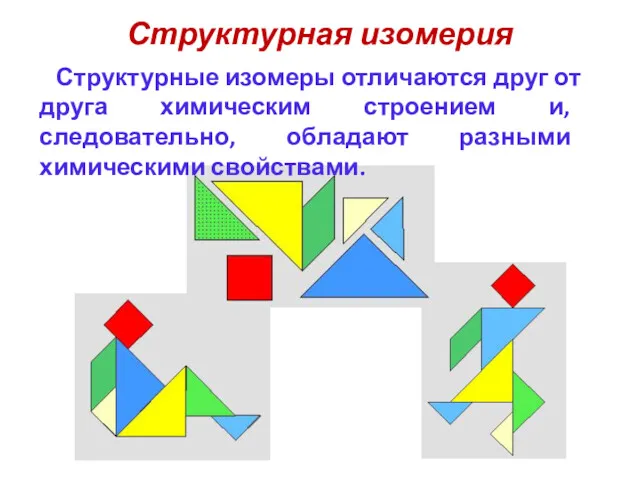
- 7. Структурная изомерия Структурные изомеры отличаются друг от друга химическим строением и, следовательно, обладают разными химическими свойствами.
- 8. Структурная изомерия Различают виды структурной изомерии: Изомерия углеродного скелета Изомерия положения кратной связи Изомерия положения функциональных
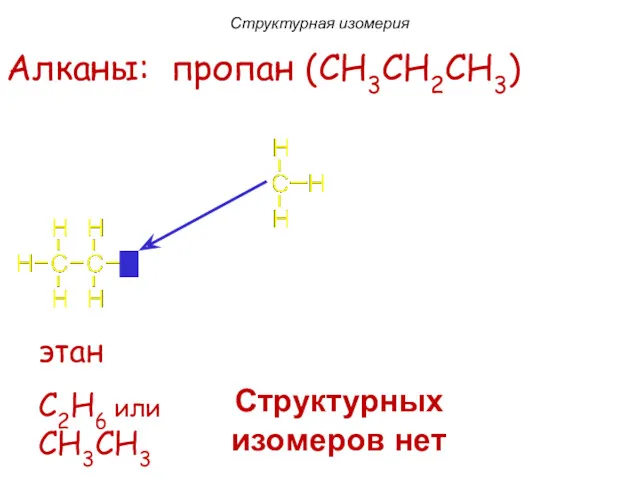
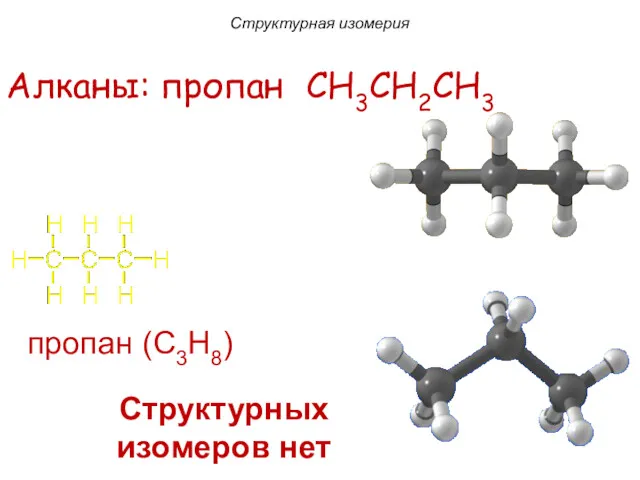
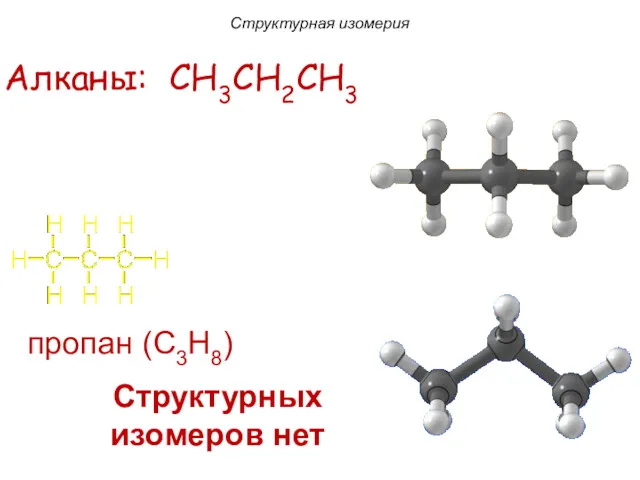
- 9. этан C2H6 или CH3CH3 Алканы: пропан (CH3CH2CH3) Структурных изомеров нет Структурная изомерия
- 10. пропан (C3H8) Алканы: пропан CH3CH2CH3 Структурных изомеров нет Структурная изомерия
- 11. пропан (C3H8) Алканы: CH3CH2CH3 Структурных изомеров нет Структурная изомерия
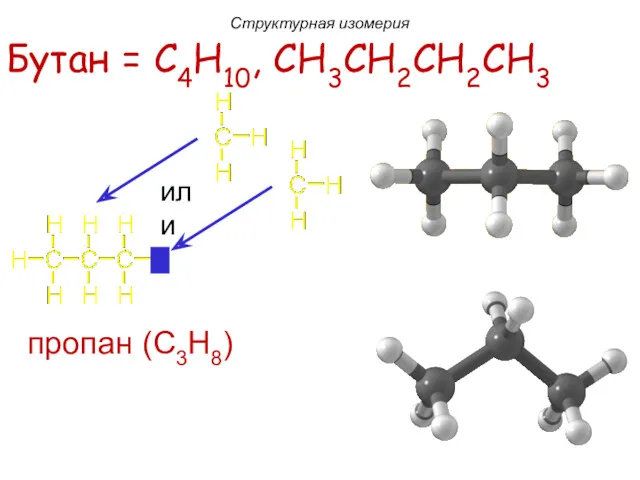
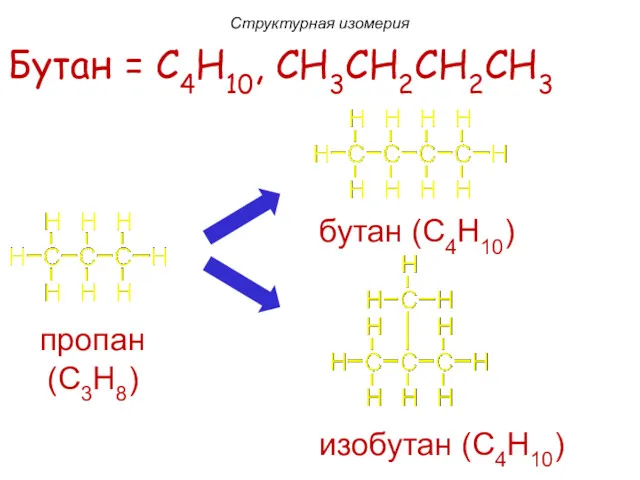
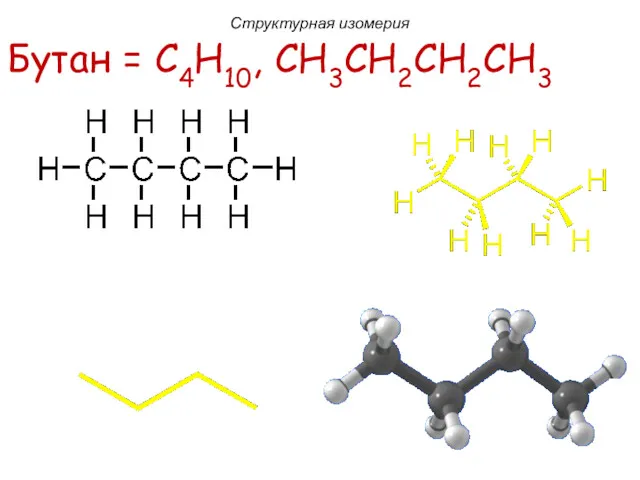
- 12. пропан (C3H8) Бутан = C4H10, CH3CH2CH2CH3 Структурная изомерия
- 13. Бутан = C4H10, CH3CH2CH2CH3 изобутан (C4H10) Структурная изомерия
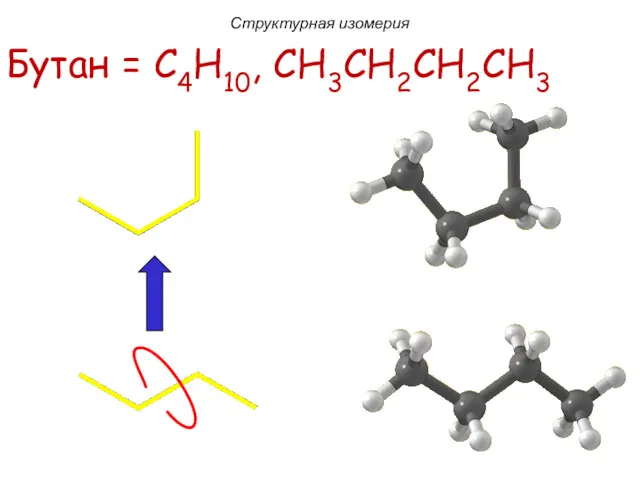
- 14. Бутан = C4H10, CH3CH2CH2CH3 Структурная изомерия
- 15. Бутан = C4H10, CH3CH2CH2CH3 Структурная изомерия
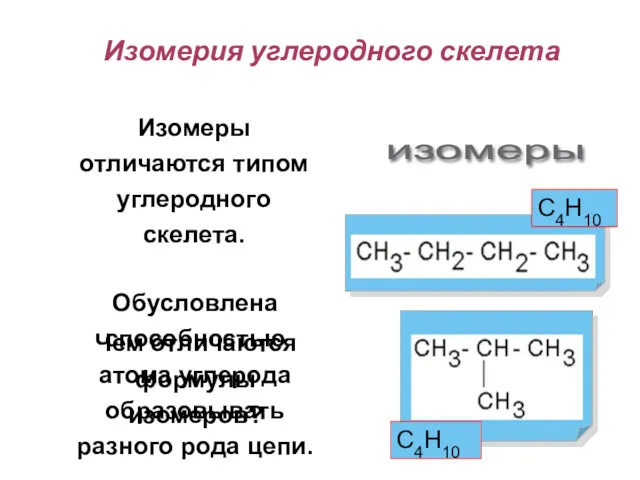
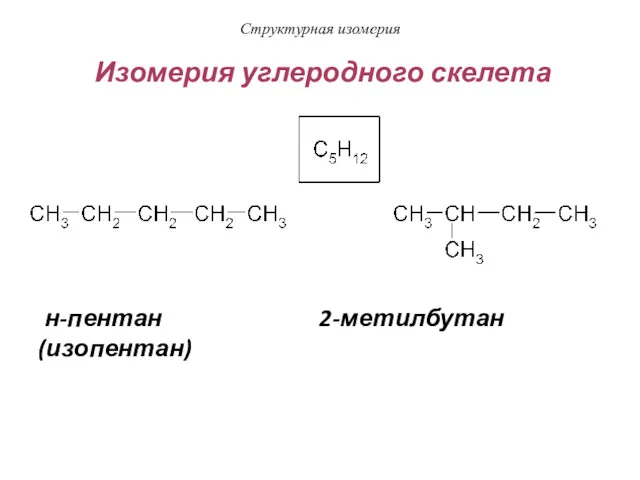
- 16. Обусловлена способностью атома углерода образовывать разного рода цепи. Чем отличаются формулы изомеров? Изомерия углеродного скелета Изомеры
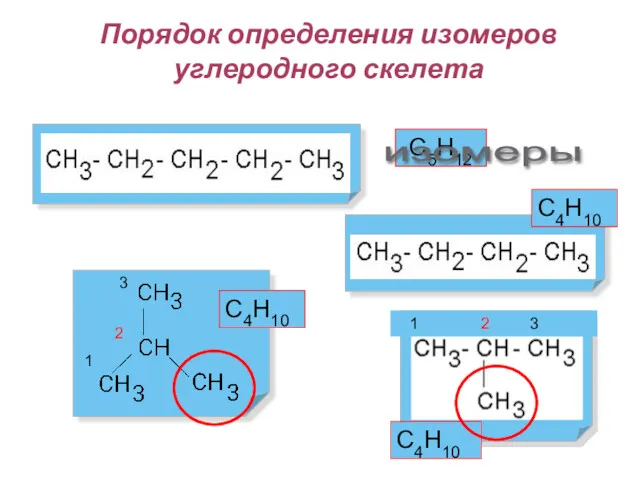
- 17. Порядок определения изомеров углеродного скелета 1 2 3 1 2 3 С5Н12 С4Н10 С4Н10 С4Н10 изомеры
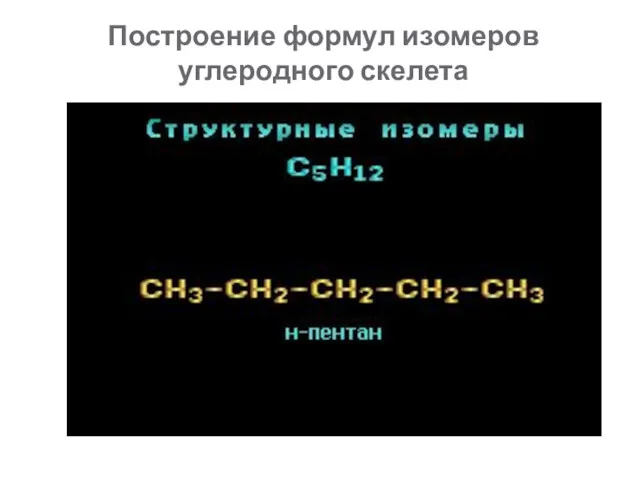
- 18. Построение формул изомеров углеродного скелета
- 19. Структурная изомерия Изомерия углеродного скелета н-пентан 2-метилбутан (изопентан)
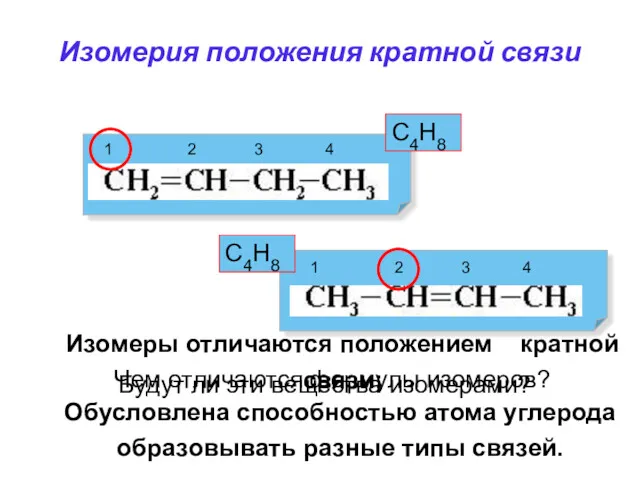
- 20. Обусловлена способностью атома углерода образовывать разные типы связей. Изомерия положения кратной связи С4Н8 С4Н8 Будут ли
- 21. Структурная изомерия Изомерия положения кратной связи С4Н8 CH2=CHCH2CH3 бутен-1 бутен-2
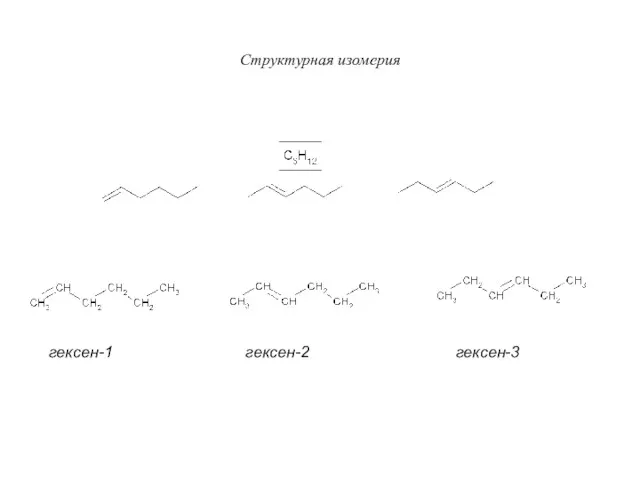
- 22. Структурная изомерия гексен-1 гексен-2 гексен-3
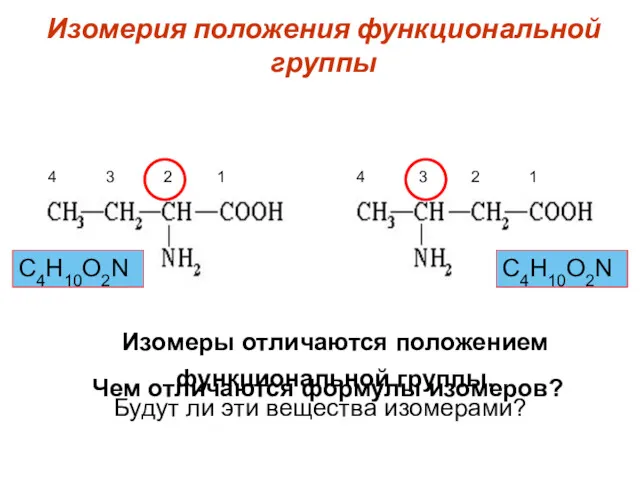
- 23. Изомерия положения функциональной группы Будут ли эти вещества изомерами? Чем отличаются формулы изомеров? Изомеры отличаются положением
- 24. Структурная изомерия Изомерия положения функциональных групп: бутанол-1
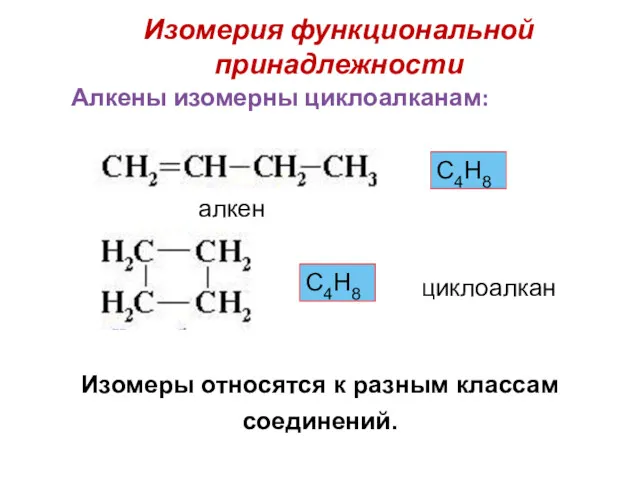
- 25. Изомерия функциональной принадлежности Изомеры относятся к разным классам соединений. С4Н8 С4Н8 алкен циклоалкан Алкены изомерны циклоалканам:
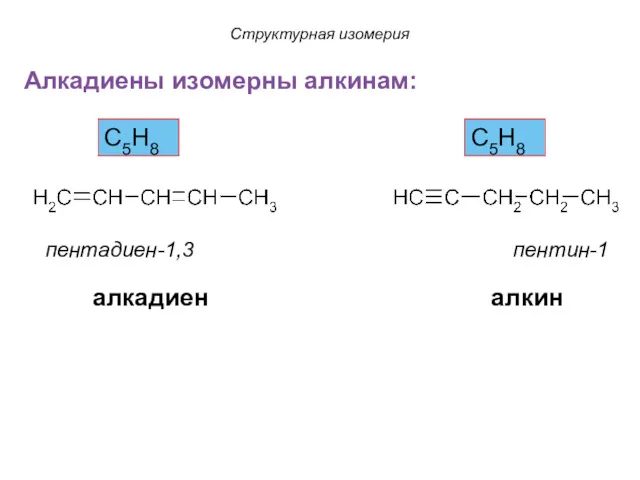
- 26. Алкадиены изомерны алкинам: пентадиен-1,3 пентин-1 С5Н8 С5Н8 алкадиен алкин Структурная изомерия
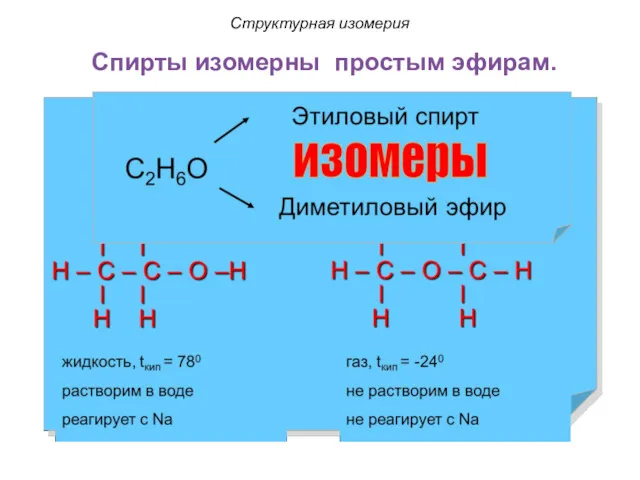
- 27. Спирты изомерны простым эфирам. Структурная изомерия
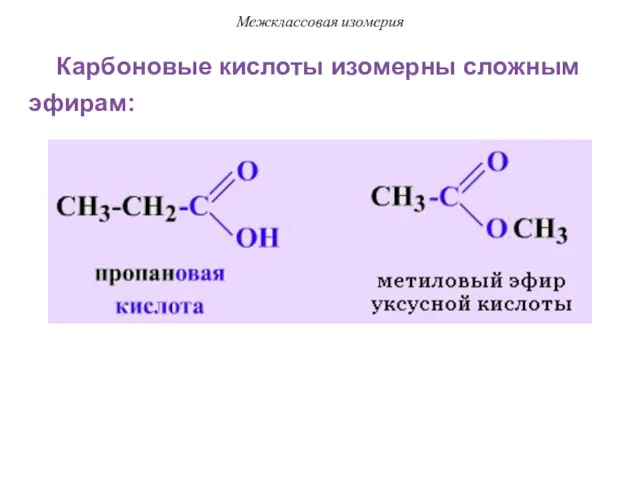
- 28. Межклассовая изомерия Карбоновые кислоты изомерны сложным эфирам:
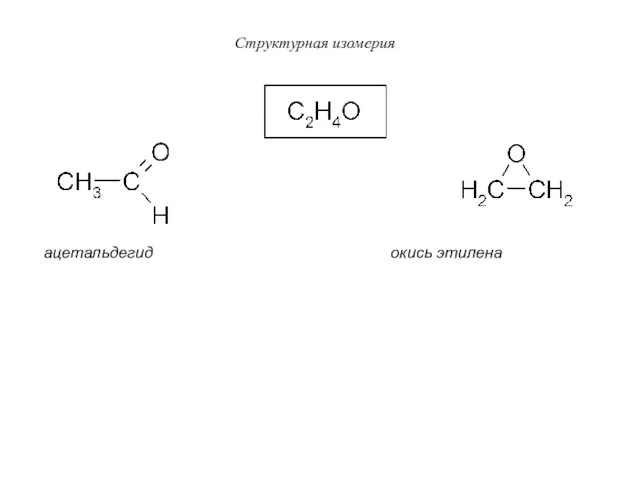
- 29. Структурная изомерия ацетальдегид окись этилена
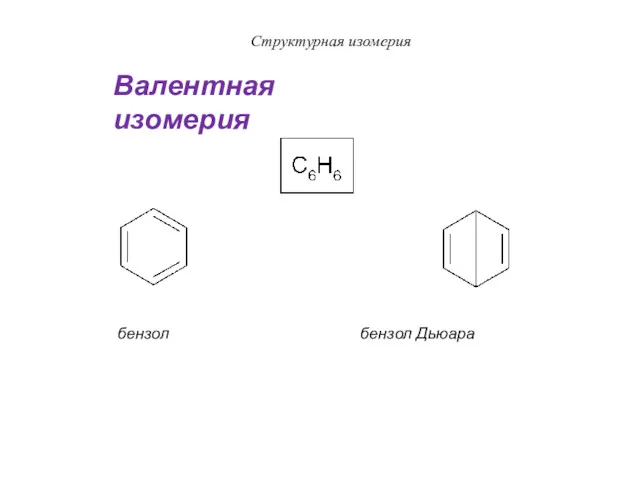
- 30. Структурная изомерия бензол бензол Дьюара Валентная изомерия
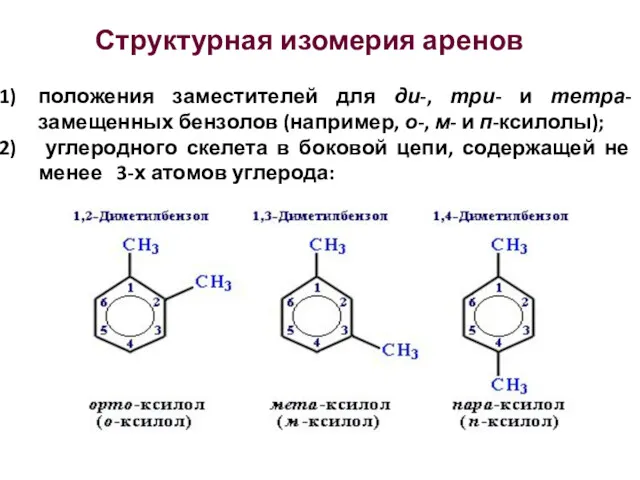
- 31. Структурная изомерия аренов положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
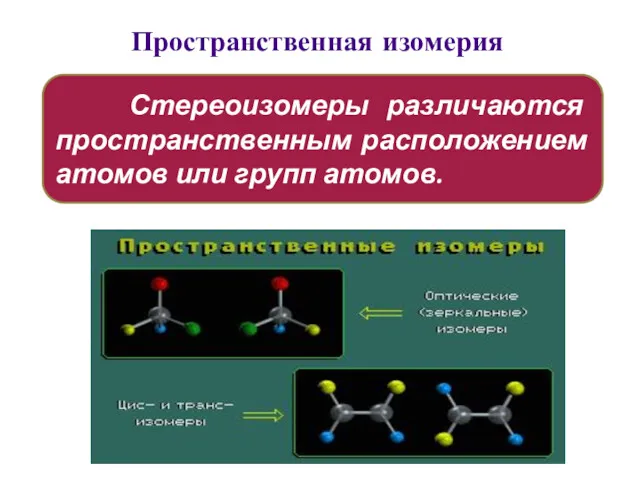
- 32. Пространственная изомерия Стереоизомеры различаются пространственным расположением атомов или групп атомов.
- 33. Различают виды стереоизомерии: энантиомерия σ–диастереомерия π-диастереомерия (геометрическая) конформационная изомерия Пространственная изомерия
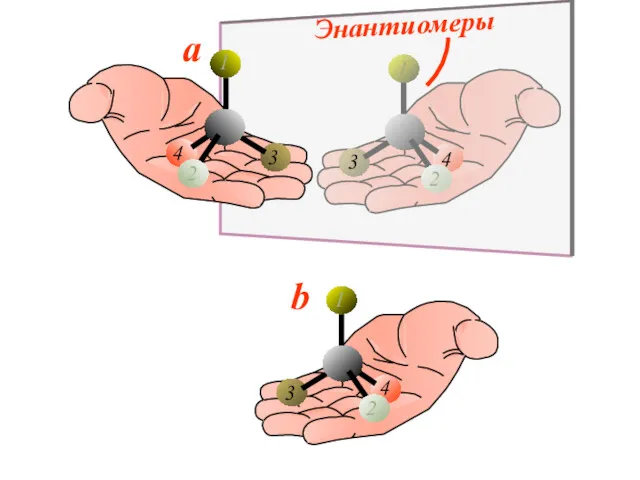
- 34. Энантиомеры – это изомеры, которые относятся друг к другу как предмет и несовместимое с ним в
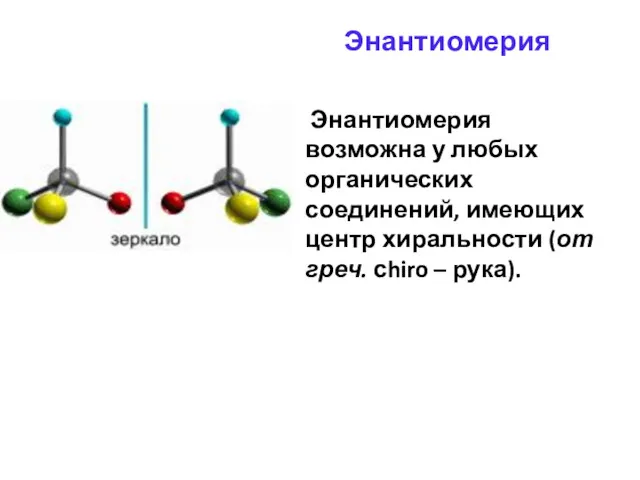
- 36. Энантиомерия Энантиомерия возможна у любых органических соединений, имеющих центр хиральности (от греч. сhiro – рука).
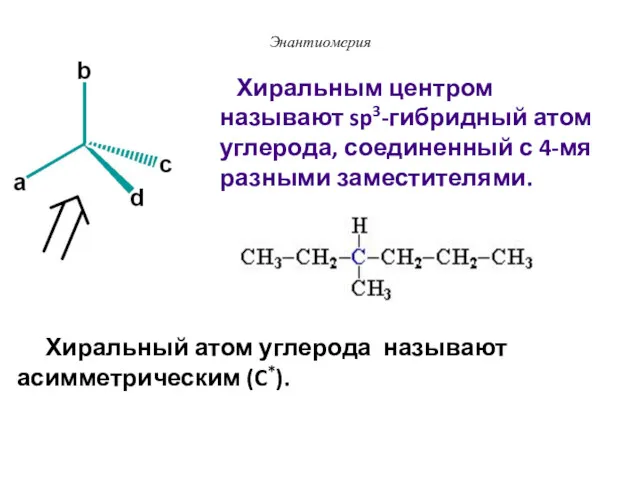
- 37. Энантиомерия Хиральный атом углерода называют асимметрическим (C*). Хиральным центром называют sp3-гибридный атом углерода, соединенный с 4-мя
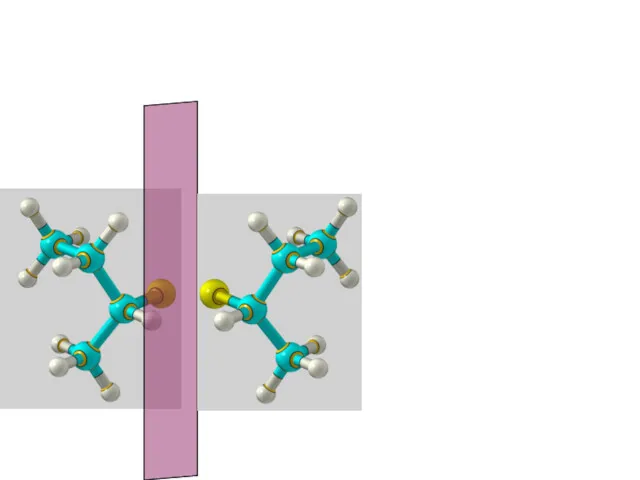
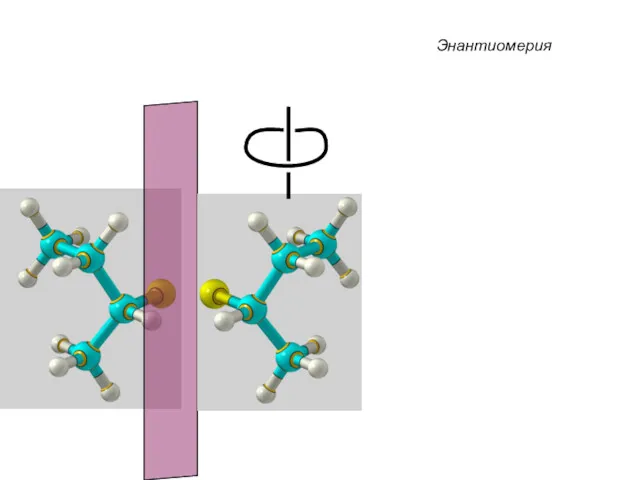
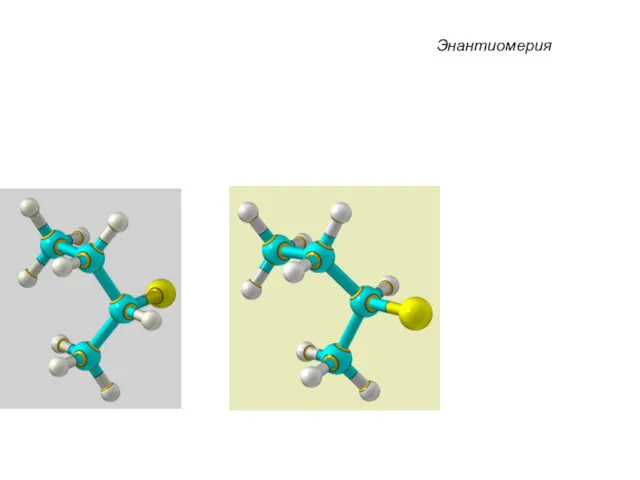
- 38. Энантиомерия Хиральные молекулы не могут быть совмещены в пространстве.
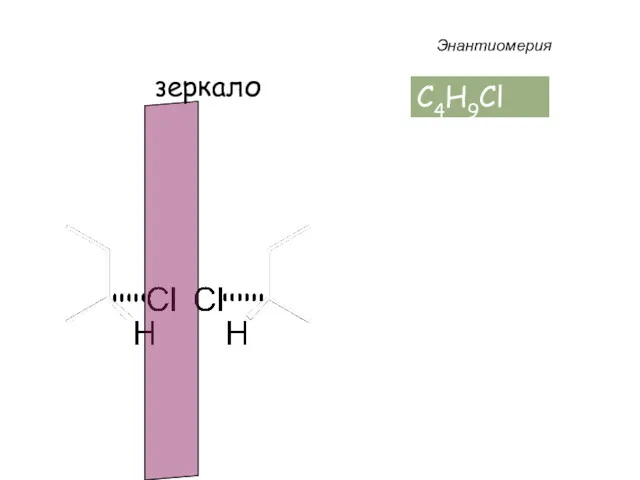
- 39. Энантиомерия C4H9Cl
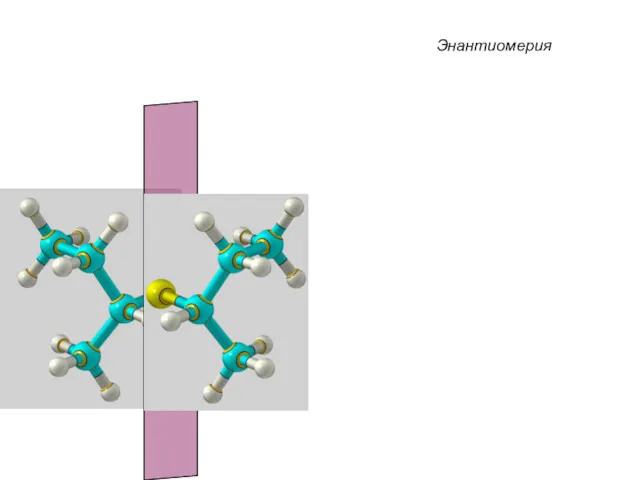
- 41. Энантиомерия
- 42. Энантиомерия
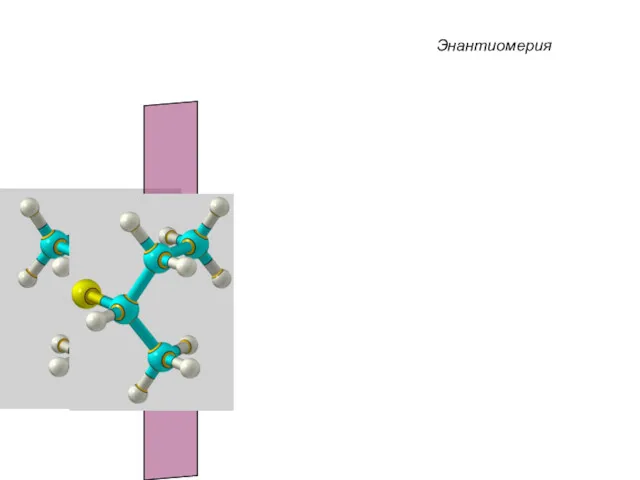
- 43. Энантиомерия
- 44. Энантиомерия
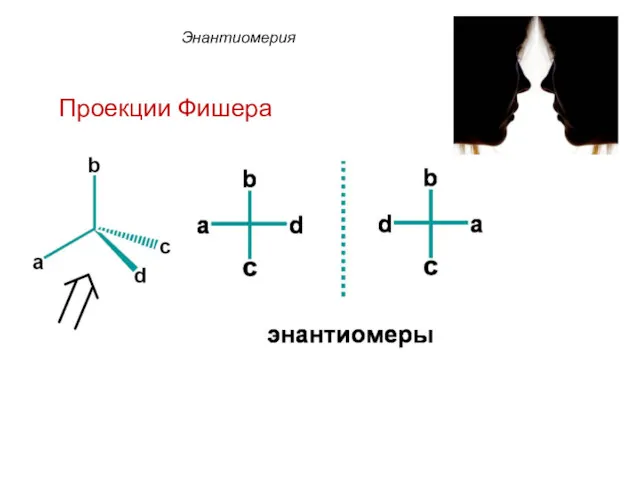
- 45. Пример: хиральная молекула 2-гидроксипропановая кислота СН3-СН(ОН)-СООН Для изображения энантиомеров на плоскости используют проекционные формулы Фишера. Энантиомерия
- 46. Энантиомерия Проекции Фишера
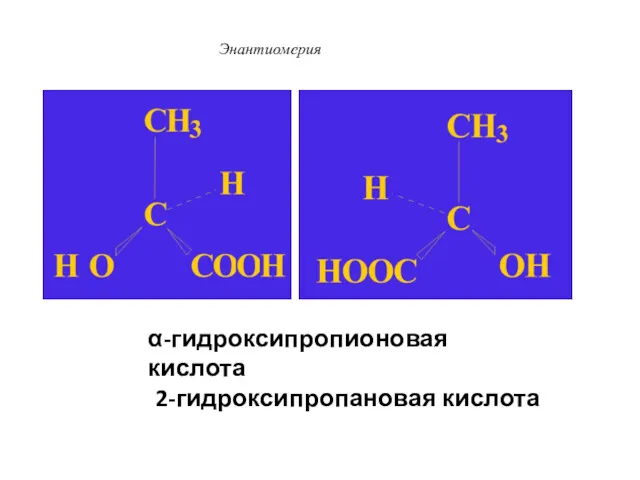
- 47. Энантиомерия α-гидроксипропионовая кислота 2-гидроксипропановая кислота
- 48. Энантиомерия α-гидроксипропионовая кислота
- 49. Энантиомерия В зависимости от конфигурации хирального центра различают D- и L- конфигурации (формы). В D-форме функциональная
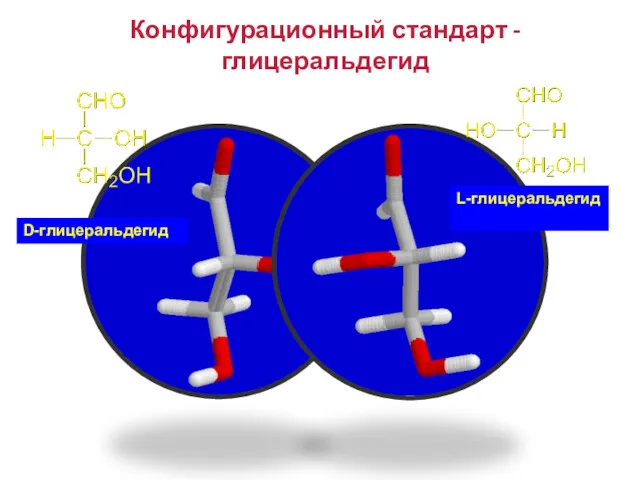
- 50. Конфигурационный стандарт - глицеральдегид D-глицеральдегид L-глицеральдегид
- 51. Сравнение конфигурации исследуемого соединения с глицериновым альдегидом производят путем серии химических превращений, не затрагивающих центр хиральности.
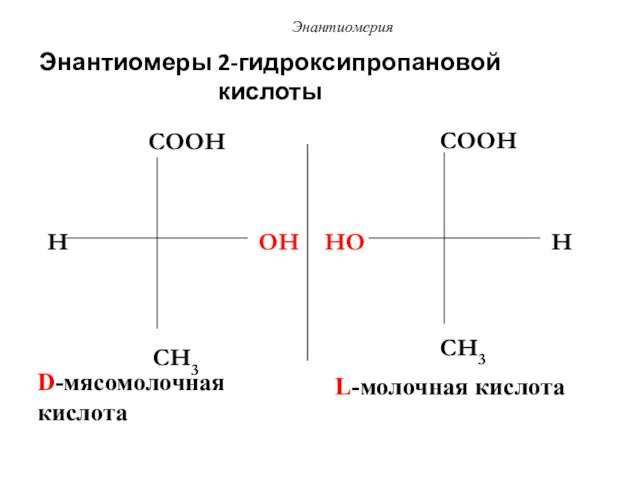
- 52. Энантиомеры 2-гидроксипропановой кислоты H COOH OH CH3 HO COOH H CH3 D-мясомолочная кислота L-молочная кислота Энантиомерия
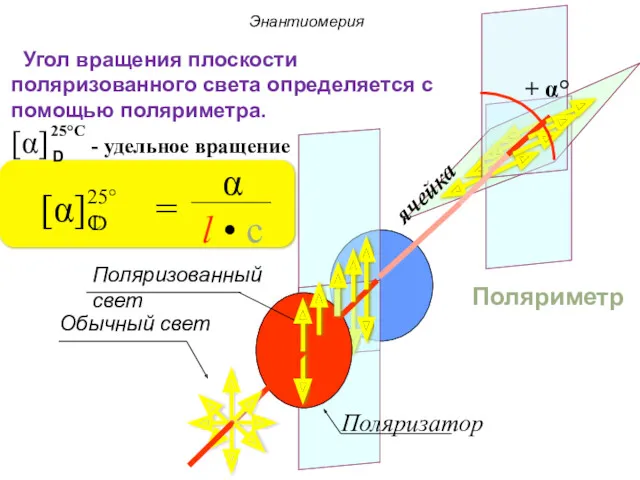
- 53. Энантиомерия Энантиомеры обладают оптической активностью. Они способны вращать плоскость поляризации света. Оптическая активность энантиомеров исследуется с
- 54. ячейка Поляриметр Угол вращения плоскости поляризованного света определяется с помощью поляриметра. [α] - удельное вращение Энантиомерия
- 55. Энантиомерия Энантиомеры способны отклонять поляризованный луч либо влево, либо вправо, т.е. они являются оптическими антиподами. У
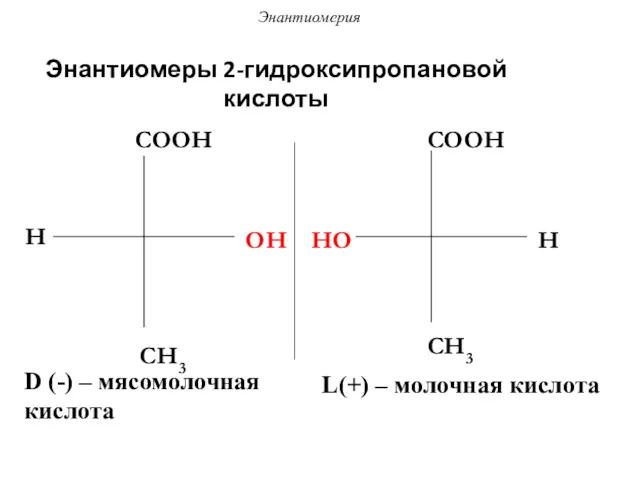
- 56. Энантиомерия У 2-гидроксипропановой кислоты D-изомер является левовращающим (-): D (-); α= -2,6° L-изомер является правовращающим(+): L
- 57. Энантиомеры 2-гидроксипропановой кислоты H COOH OH CH3 HO COOH H CH3 D (-) – мясомолочная кислота
- 58. Энантиомерия Энантиомеры обладают одинаковыми физическими и химическими свойствами, но являются оптическими антиподами, т.е. имеют противоположную оптическую
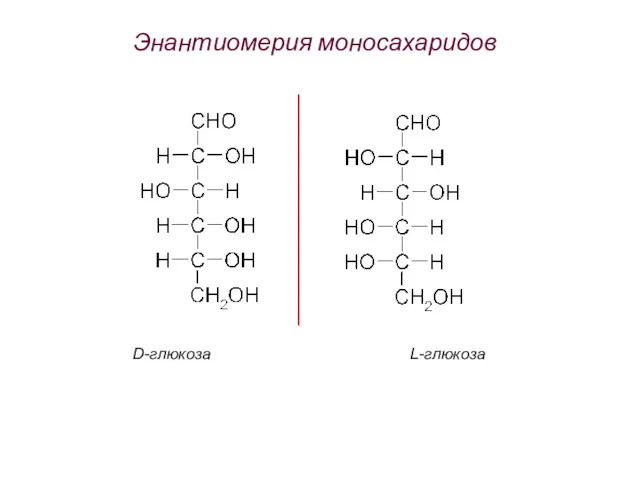
- 59. Энантиомерия моносахаридов D-глюкоза L-глюкоза
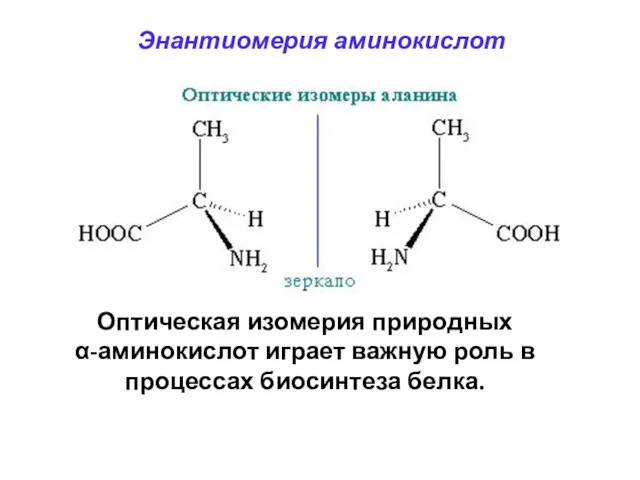
- 60. Энантиомерия аминокислот Оптическая изомерия природных α-аминокислот играет важную роль в процессах биосинтеза белка.
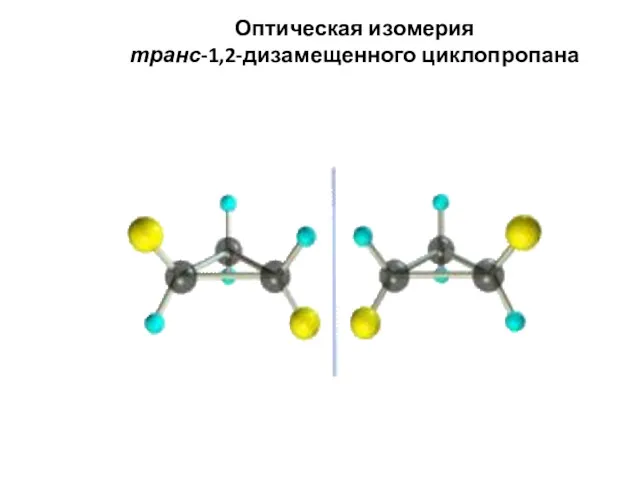
- 61. Оптическая изомерия транс-1,2-дизамещенного циклопропана
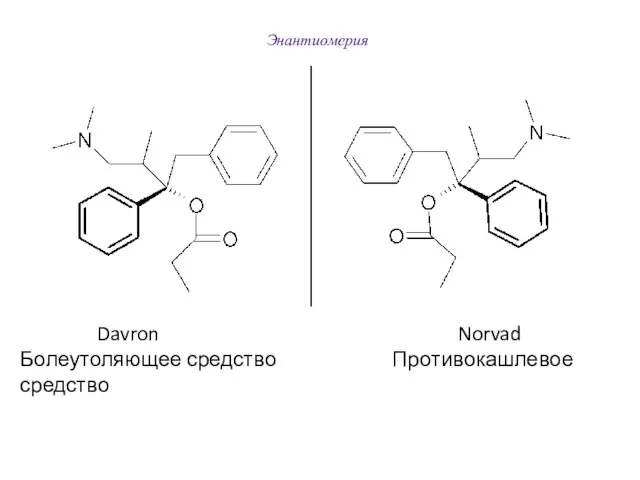
- 62. Энантиомерия Davron Norvad Болеутоляющее средство Противокашлевое средство
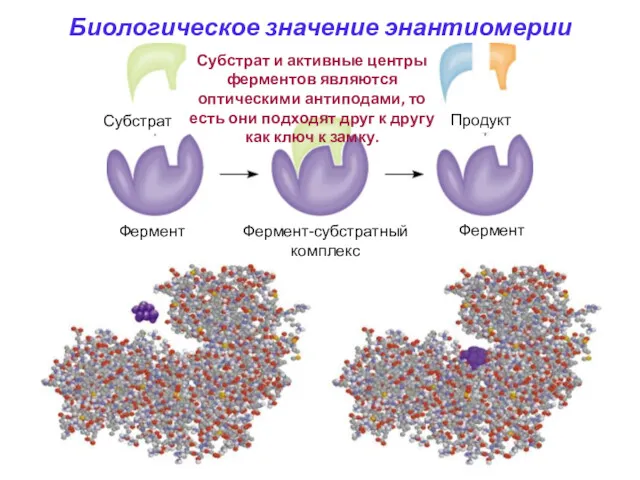
- 63. Субстрат и активные центры ферментов являются оптическими антиподами, то есть они подходят друг к другу как
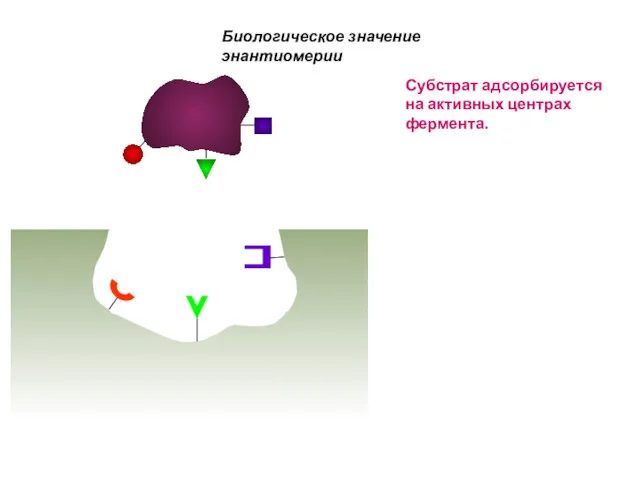
- 64. Биологическое значение энантиомерии Субстрат адсорбируется на активных центрах фермента.
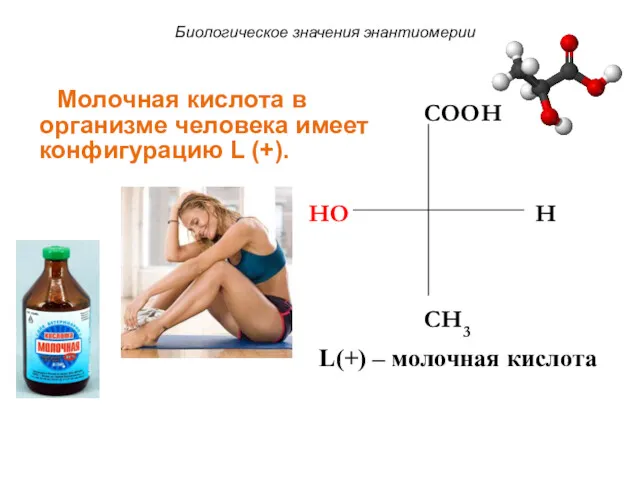
- 65. HO COOH H CH3 L(+) – молочная кислота Биологическое значения энантиомерии Молочная кислота в организме человека
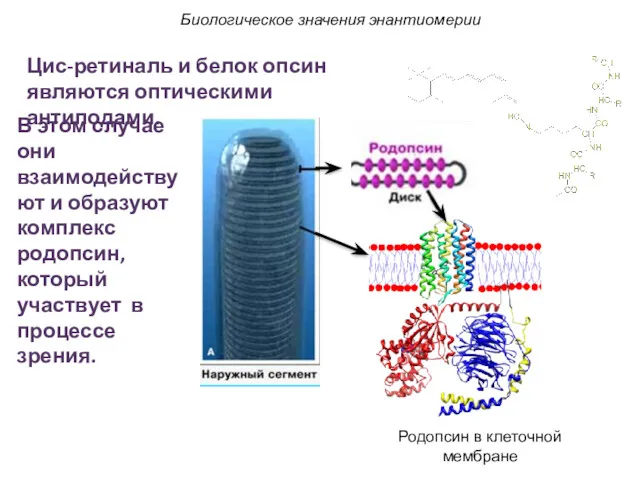
- 66. Биологическое значения энантиомерии В этом случае они взаимодействуют и образуют комплекс родопсин, который участвует в процессе
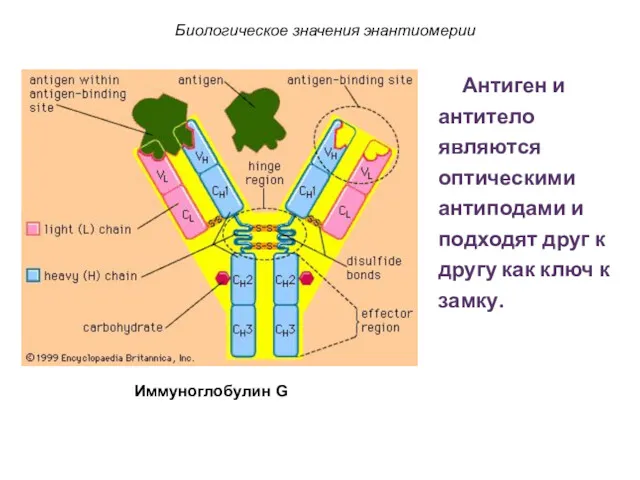
- 67. Биологическое значения энантиомерии Антиген и антитело являются оптическими антиподами и подходят друг к другу как ключ
- 68. σ - Диастереомерия σ-Диастереомерия возникает в молекулах с 2 и более центрами хиральности.
- 69. Число стереоизомеров (Z) рассчитывают по формуле Фишера: Z =2n , где n-число центров хиральности. σ -
- 70. D-, L-определяющим является гидроксил при нижнем асимметрическом атоме углерода (кроме оксикислот и аминокислот). Если заместители находятся
- 71. σ - Диастереомерия Пример: 2,3,4 – тригидроксибутаналь СН2(ОН)-СН(ОН)-СН(ОН)-СОН n=2; Z = 22 =4 стереоизомера, две пары
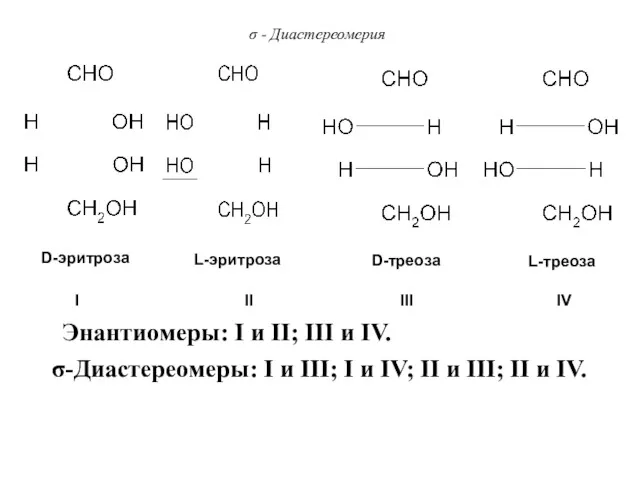
- 72. σ - Диастереомерия D-эритроза L-эритроза D-треоза L-треоза σ-Диастереомеры: I и III; I и IV; II и
- 73. σ - Диастереомерия σ– Диастереомеры имеют разные физические и химические свойства, и физиологическое действие.
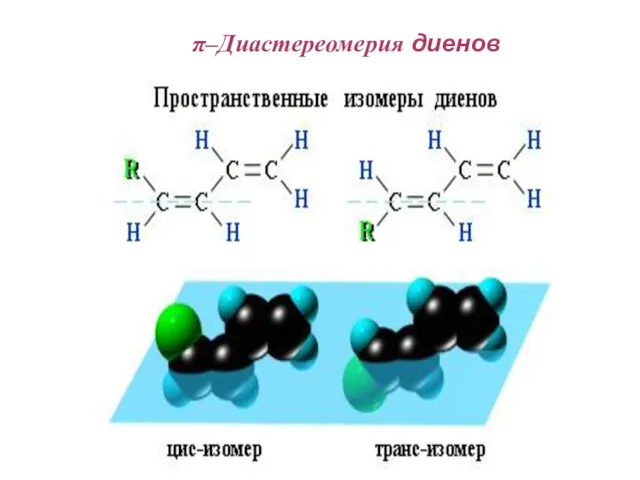
- 74. π - Диастереомерия π-Диастереомеры (цис- и транс-) - это стереоизомеры, отличающиеся друг от друга различным пространственным
- 75. Геометрическая изомерия
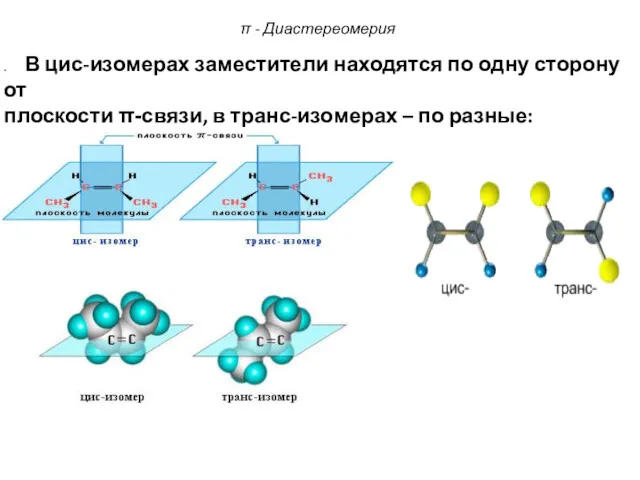
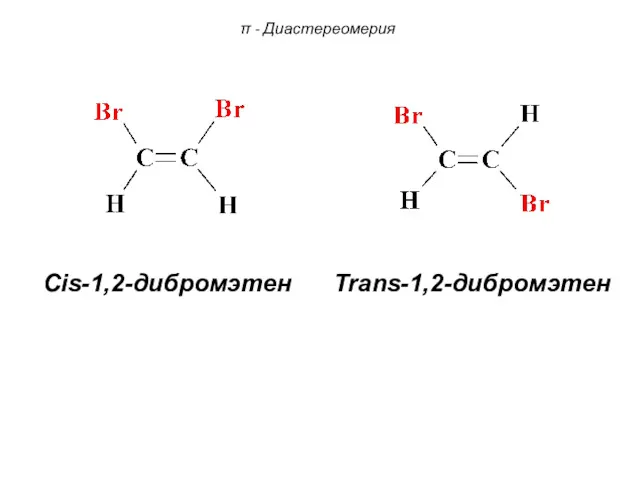
- 76. π - Диастереомерия . В цис-изомерах заместители находятся по одну сторону от плоскости π-связи, в транс-изомерах
- 77. Cis-1,2-дибромэтен Trans-1,2-дибромэтен π - Диастереомерия
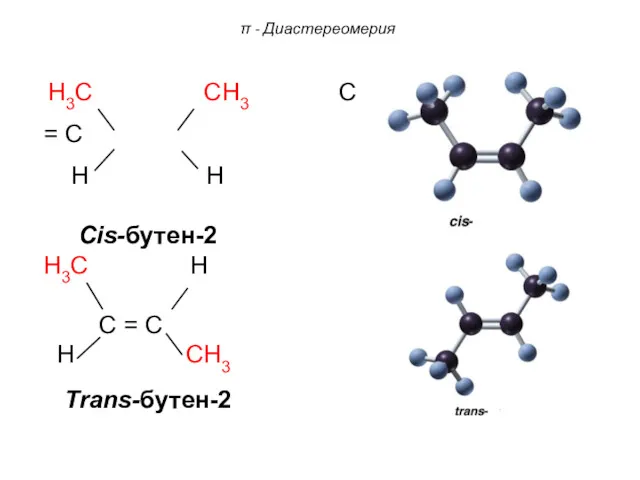
- 78. H3C CH3 C = C H H Cis-бутен-2 H3C H C = C H CH3 Trans-бутен-2
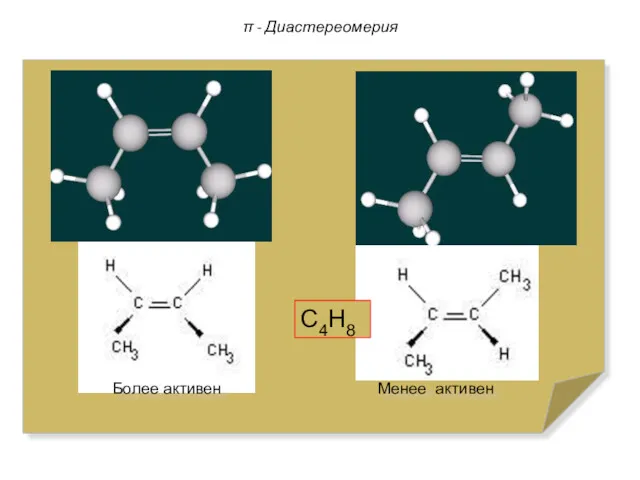
- 79. π - Диастереомерия С4Н8
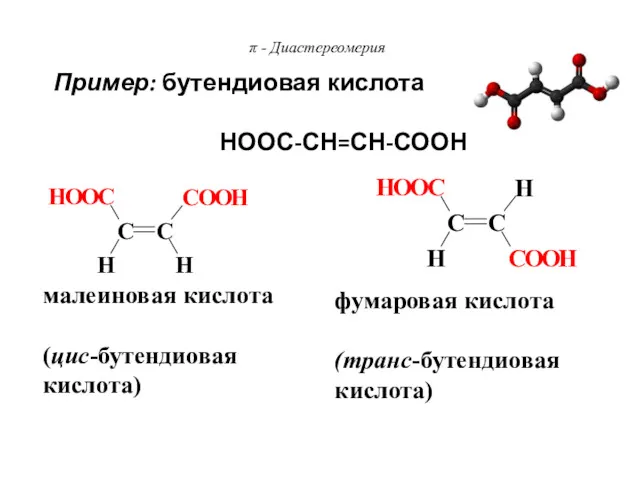
- 80. π - Диастереомерия малеиновая кислота (цис-бутендиовая кислота) фумаровая кислота (транс-бутендиовая кислота) Пример: бутендиовая кислота НООС-СН=СН-СООН
- 81. π - Диастереомерия π-Диастереомеры отличаются друг от друга по физическим и химическим свойствам, а также по
- 82. π - Диастереомерия Фумаровая кислота содержится как в растительных, так и животных организмах, где она образуется
- 83. π–Диастереомерия диенов
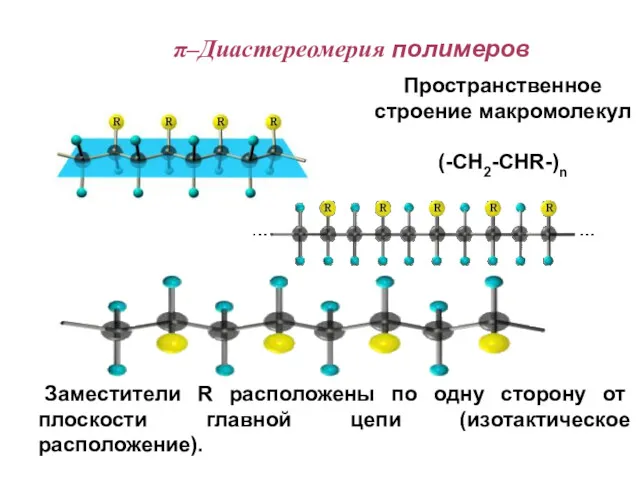
- 84. Заместители R расположены по одну сторону от плоскости главной цепи (изотактическое расположение). Пространственное строение макромолекул (-CH2-CHR-)n
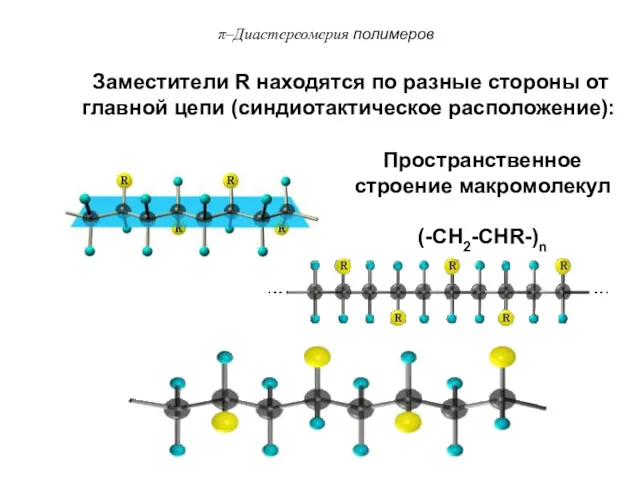
- 85. Заместители R находятся по разные стороны от главной цепи (синдиотактическое расположение): Пространственное строение макромолекул (-CH2-CHR-)n π–Диастереомерия
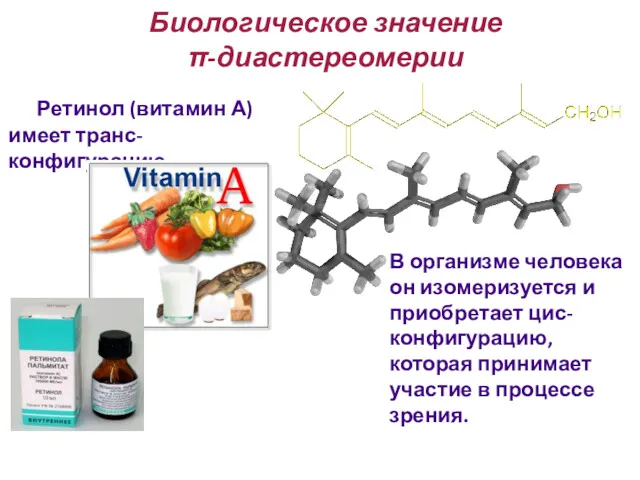
- 86. Биологическое значение π-диастереомерии Ретинол (витамин А) имеет транс-конфигурацию. В организме человека он изомеризуется и приобретает цис-
- 87. Биологическое значение π-диастереомерии Высшие ненасыщенные жирные кислоты в составе липидов имеют цис-конфигурацию. Это обусловливает их укороченный
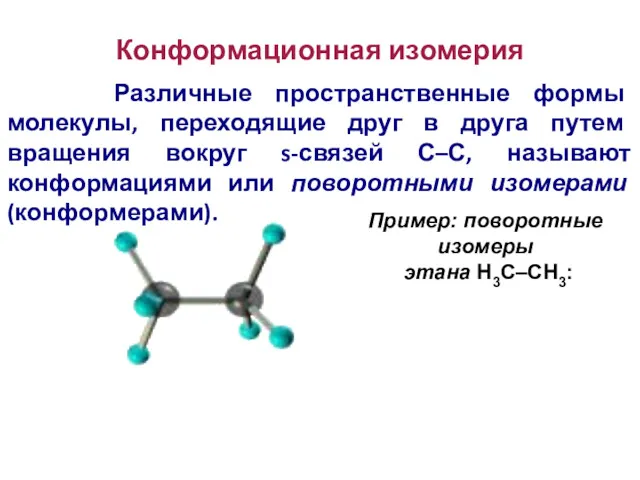
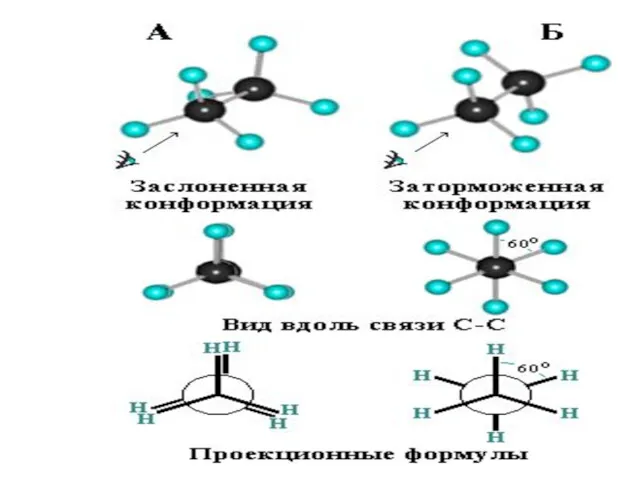
- 88. Конформационная изомерия Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг s-связей С–С, называют
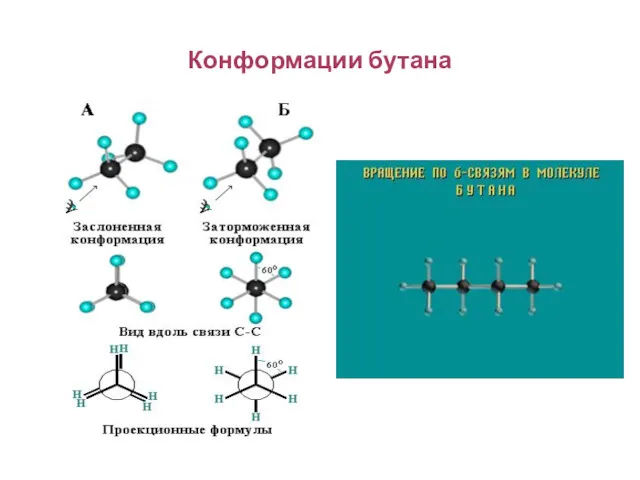
- 90. Конформации бутана
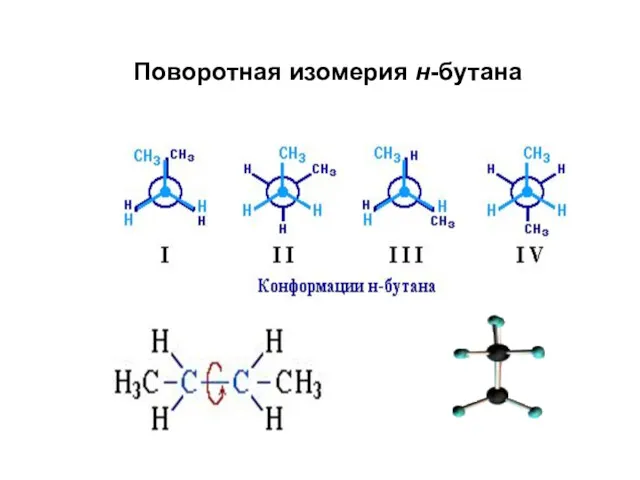
- 91. Поворотная изомерия н-бутана
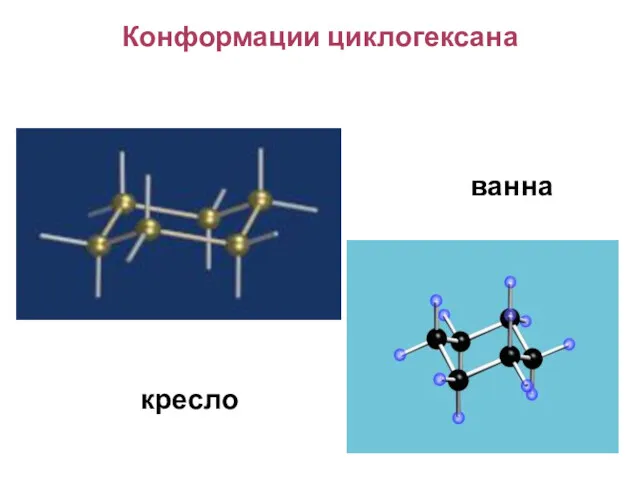
- 92. Конформации циклогексана ванна кресло
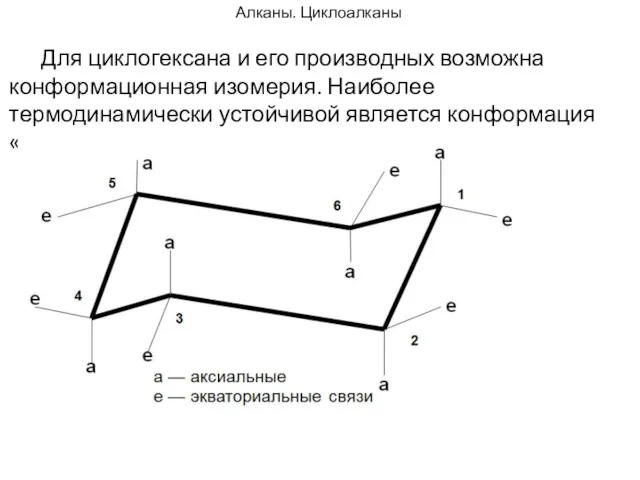
- 93. Алканы. Циклоалканы Для циклогексана и его производных возможна конформационная изомерия. Наиболее термодинамически устойчивой является конформация «кресло».
- 94. Кислотность органических соединений Кислотно-основные свойства органических веществ рассматривают, основываясь на положениях протонной теории кислот и оснований
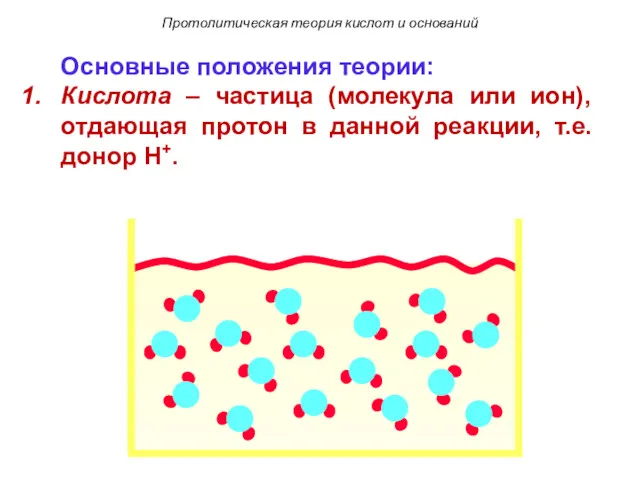
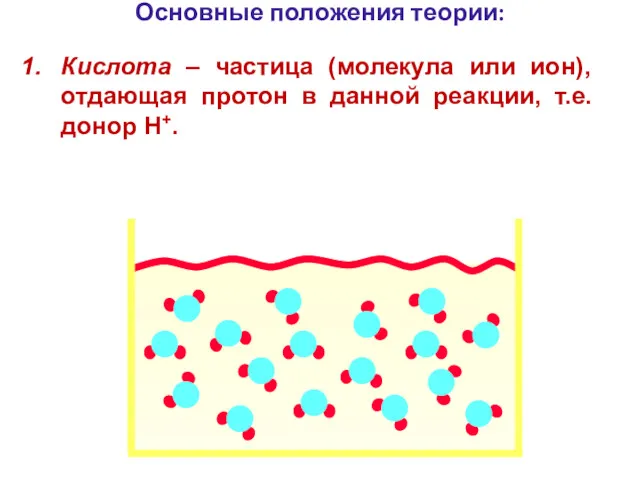
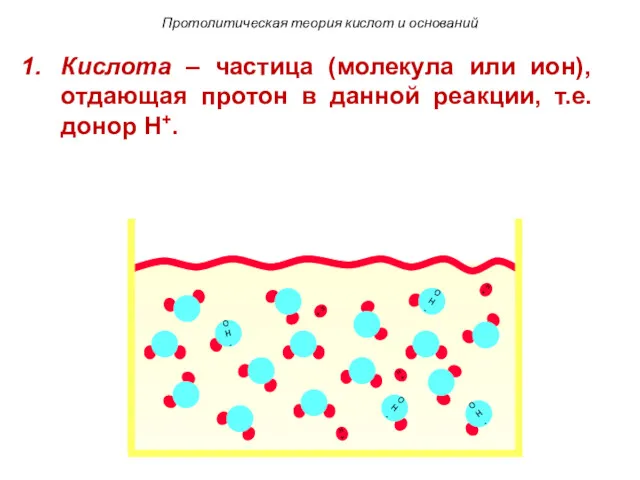
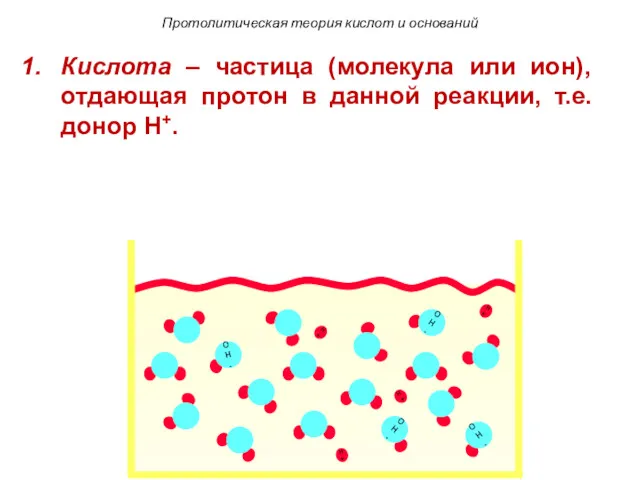
- 95. Основные положения теории: Кислота – частица (молекула или ион), отдающая протон в данной реакции, т.е. донор
- 96. Основные положения теории: Кислота – частица (молекула или ион), отдающая протон в данной реакции, т.е. донор
- 97. H+ H+ H+ H+ Протолитическая теория кислот и оснований Кислота – частица (молекула или ион), отдающая
- 98. H+ H+ H+ H+ Протолитическая теория кислот и оснований Кислота – частица (молекула или ион), отдающая
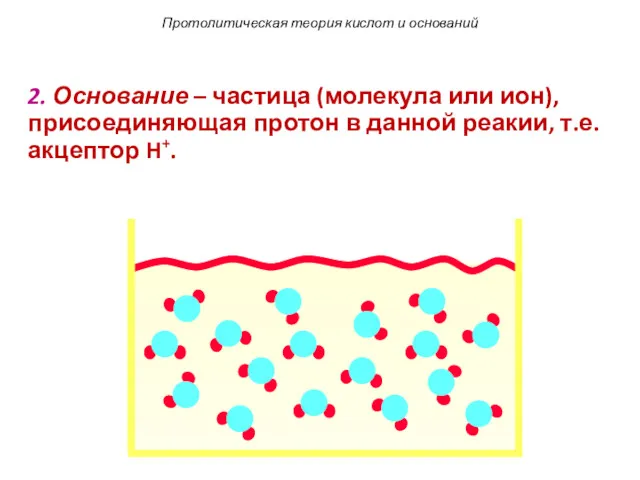
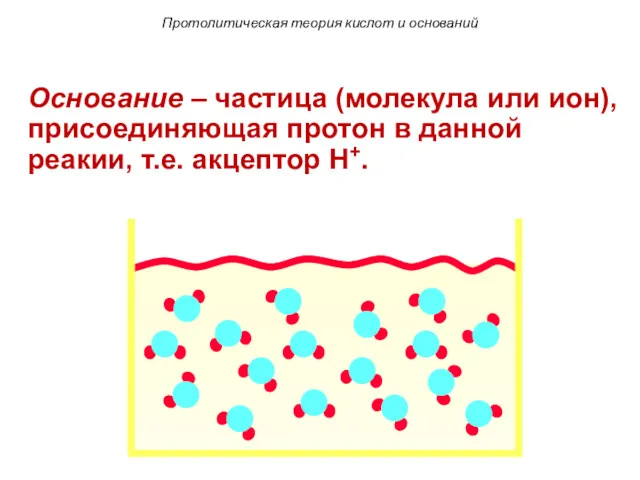
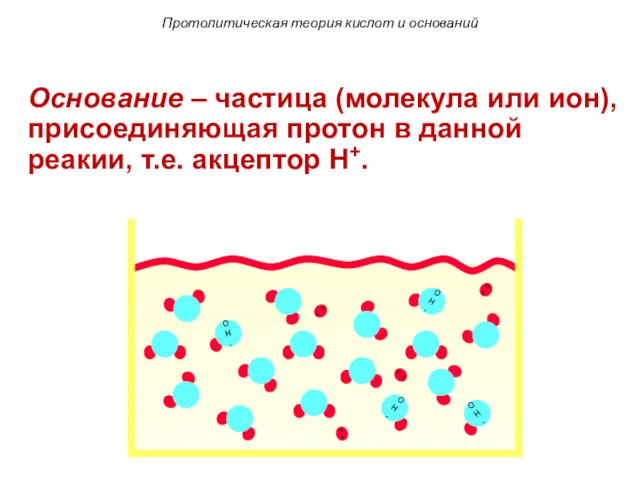
- 99. 2. Основание – частица (молекула или ион), присоединяющая протон в данной реакии, т.е. акцептор H+. Протолитическая
- 100. Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая протон в данной реакии,
- 101. H+ H+ H+ H+ Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая
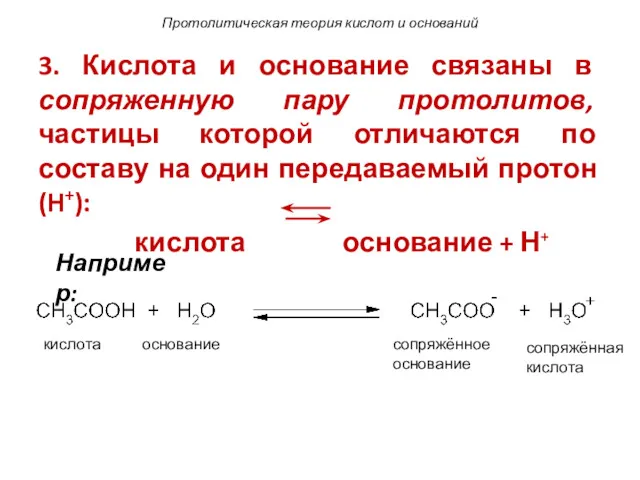
- 102. Протолитическая теория кислот и оснований 3. Кислота и основание связаны в сопряженную пару протолитов, частицы которой
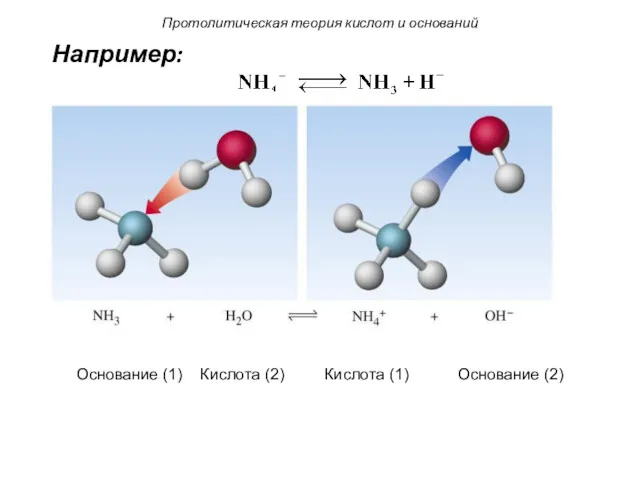
- 103. Протолитическая теория кислот и оснований Основание (1) Кислота (2) Кислота (1) Основание (2) Например:
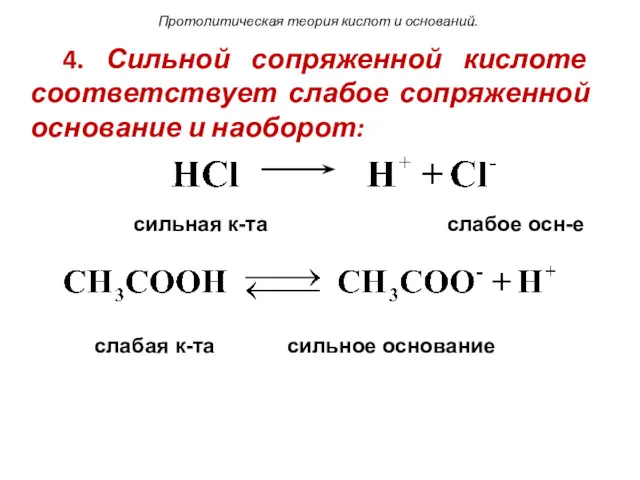
- 104. Протолитическая теория кислот и оснований. 4. Сильной сопряженной кислоте соответствует слабое сопряженной основание и наоборот: сильная
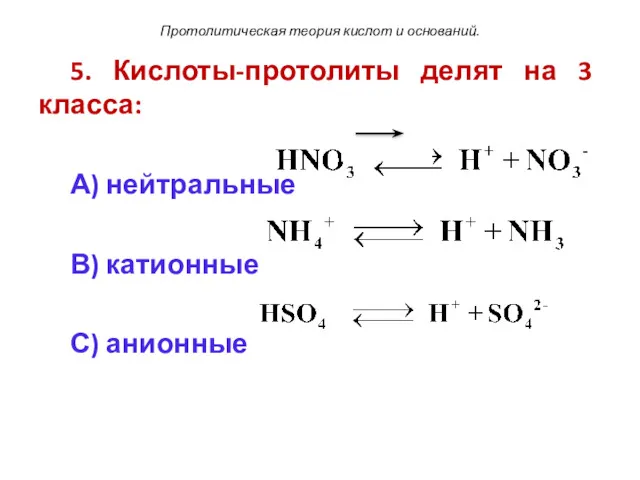
- 105. Протолитическая теория кислот и оснований. 5. Кислоты-протолиты делят на 3 класса: А) нейтральные В) катионные С)
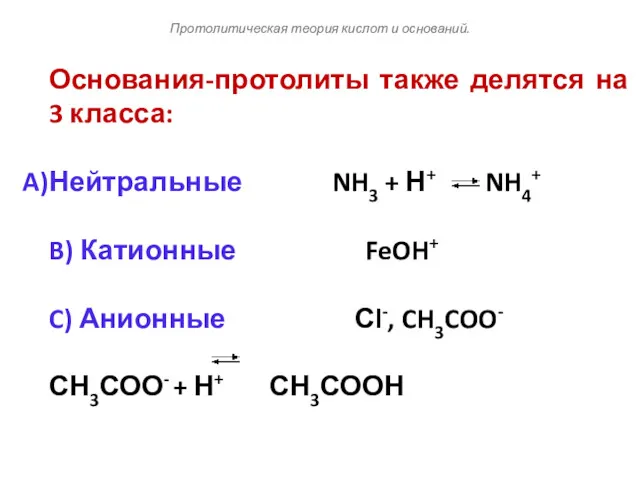
- 106. Основания-протолиты также делятся на 3 класса: Нейтральные NH3 + Н+ NH4+ B) Катионные FeOH+ C) Анионные
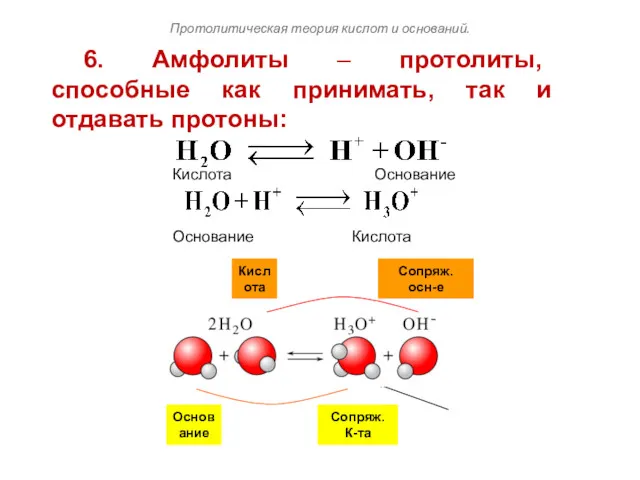
- 107. Кислота Сопряж. осн-е Основание Сопряж. К-та 6. Амфолиты – протолиты, способные как принимать, так и отдавать
- 108. Константа кислотности. 7. Количественно сила кислот-протолитов оценивается величиной константы кислотности (Ка). Ка характеризует момент химического равновесия
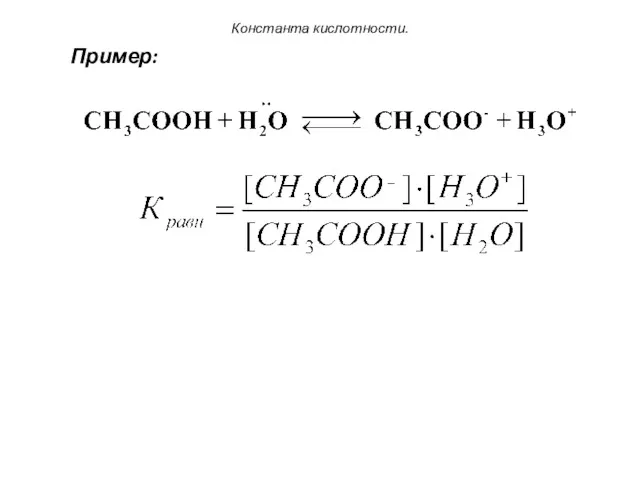
- 109. Константа кислотности. Пример:
- 110. Константа кислотности. Перемножим обе части уравнения на постоянную величину молярной концентрации воды: Таким образом, чем выше
- 111. На практике используют показатель константы кислотности (pKa): Чем меньше значение pKa, тем сильнее кислота. Протолитическая теория
- 112. Кислотность органических соединений Большинство органических соединений можно рассматривать как кислоты, поскольку в их молекулах содержатся ковалентные
- 113. Кислотность органических соединений Формулы и названия веществ рКа С2Н5ОН этанол 18 С2Н5SH этантиол 10,5 С2Н5NH2 этанамин
- 114. Кислотность органических соединений На стабильность аниона оказывают влияние следующие факторы: 1. Природа элемента в кислотном центре.
- 115. Кислотность органических соединений Поскольку кислород является более электроотрицательным элементом, то связь О-Н более полярна, чем N-H,
- 116. Кислотность органических соединений б) поляризуемость элемента в кислотном центре. Сравним кислотные свойства веществ с одинаковыми радикалами:
- 117. Кислотность органических соединений Благодаря большему радиусу и более высокой поляризуемости атома серы, отрицательный заряд в анионе
- 118. Кислотность органических соединений 2.Влияние сопряжения на стабильность аниона Пример: Этанол СН3–СН2–ОН рКа=18 Фенол С6Н5 –ОН рКа=9,9
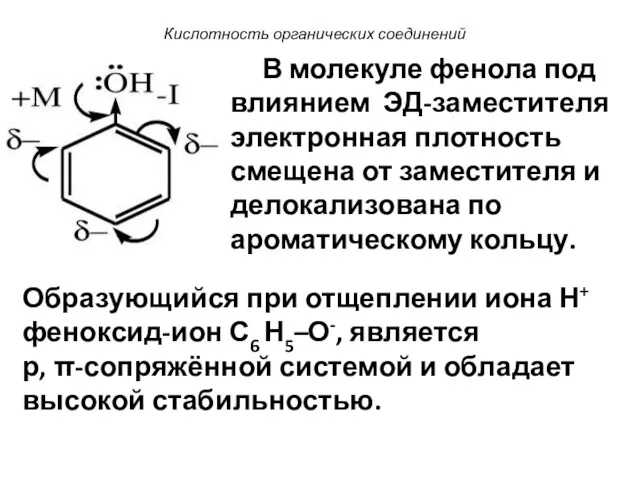
- 119. Кислотность органических соединений В молекуле фенола под влиянием ЭД-заместителя электронная плотность смещена от заместителя и делокализована
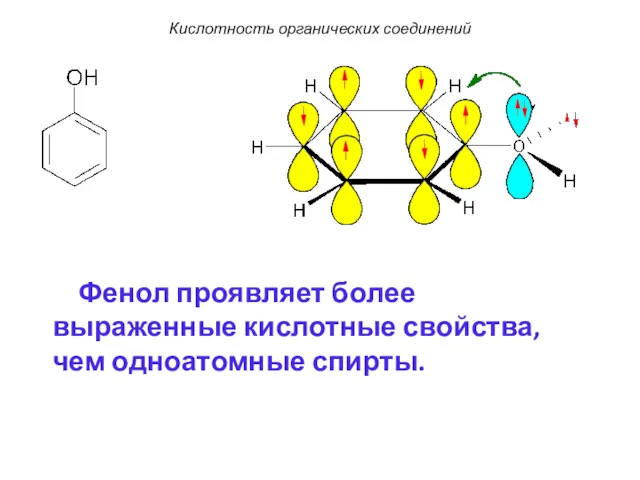
- 120. Фенол проявляет более выраженные кислотные свойства, чем одноатомные спирты. Кислотность органических соединений
- 121. Кислотность органических соединений 3. Влияние заместителей на стабильность аниона Пример: СН3–СН2–СООН рКа=4,9 пропановая к-та СН3–СН (ОН)–СООН
- 122. Кислотность органических соединений 4. Влияние растворителя на стабильность аниона В водных растворах анионы гидратированы, что повышает
- 124. Скачать презентацию







































 Дифузія в побуті
Дифузія в побуті Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Основные понятия и законы химии
Основные понятия и законы химии Получение металлов. (9 класс)
Получение металлов. (9 класс) Коллоидно-дисперсные системы
Коллоидно-дисперсные системы Алюминий и его соединения
Алюминий и его соединения Металлы. Лекция № 9
Металлы. Лекция № 9 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека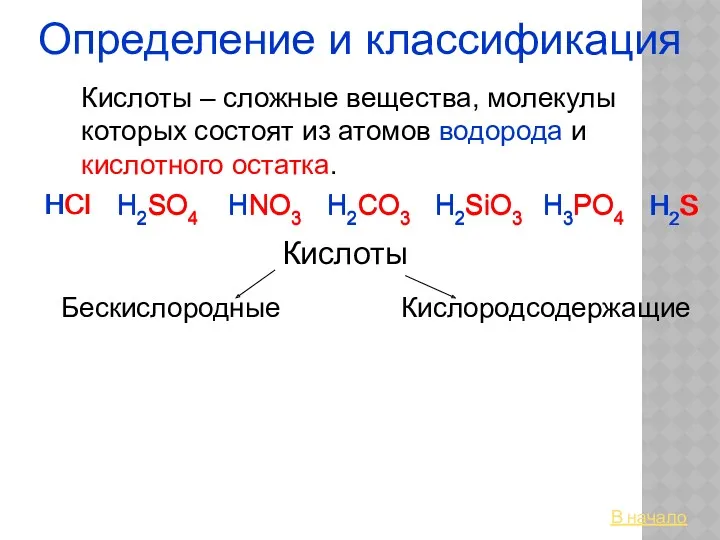 Кислоты. Определение и классификация
Кислоты. Определение и классификация Простые вещества - неметаллы
Простые вещества - неметаллы Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Карбоновые кислоты
Карбоновые кислоты Химический элемент кремний
Химический элемент кремний Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Массовая доля вещества в растворе
Массовая доля вещества в растворе Карбоновые кислоты
Карбоновые кислоты Висбрекинг (перспективный процесс ТК)
Висбрекинг (перспективный процесс ТК) Интересные свойства редких металлов
Интересные свойства редких металлов Materials. Metals non-metals
Materials. Metals non-metals Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Алкалоиды, производные тропана
Алкалоиды, производные тропана Химические реакторы
Химические реакторы Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Analytical methods in modern research. Chromatography
Analytical methods in modern research. Chromatography Интеллектуальная игра Знатоки по химии
Интеллектуальная игра Знатоки по химии Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены