Содержание
- 2. КИСЛОТЫ Изучите материал презентации. Сделайте конспект со слайдов 7,9, 11, 13, 14, 15- можно записать лишь
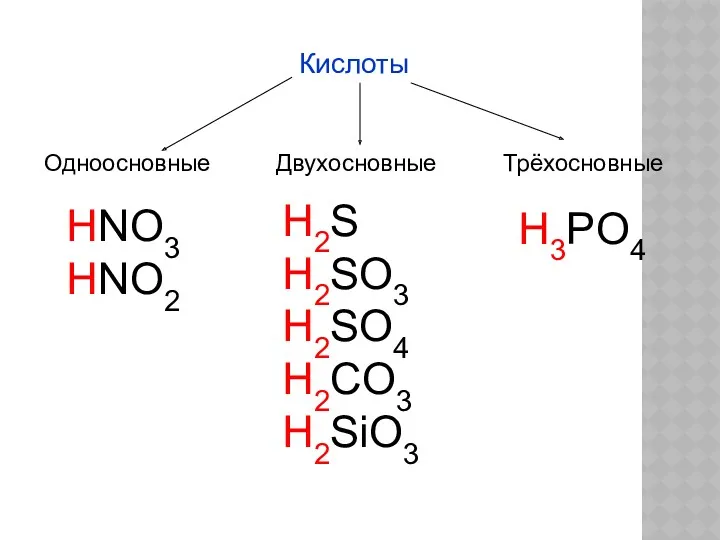
- 3. Кислоты Одноосновные Двухосновные Трёхосновные HNO3 HNO2 H2S H2SO3 H2SO4 H2CO3 H2SiO3 H3PO4
- 4. КЛАССИФИКАЦИЯ КИСЛОТ
- 5. КИСЛОТЫ- ЭЛЕКТРОЛИТЫ, ПРИ ДИССОЦИАЦИИ КОТОРЫХ ОБРАЗУЮТСЯ КАТИОНЫ ВОДОРОДА И АНИОНЫ КИСЛОТНЫХ ОСТАТКОВ HCL H++CL- H2SO4 3H++PO43-
- 6. НОМЕНКЛАТУРА КИСЛОТ Бескислородные кислоты: К названию кислотообразующего элемента добавляют гласную «о» и слова «водородная кислота» H2S
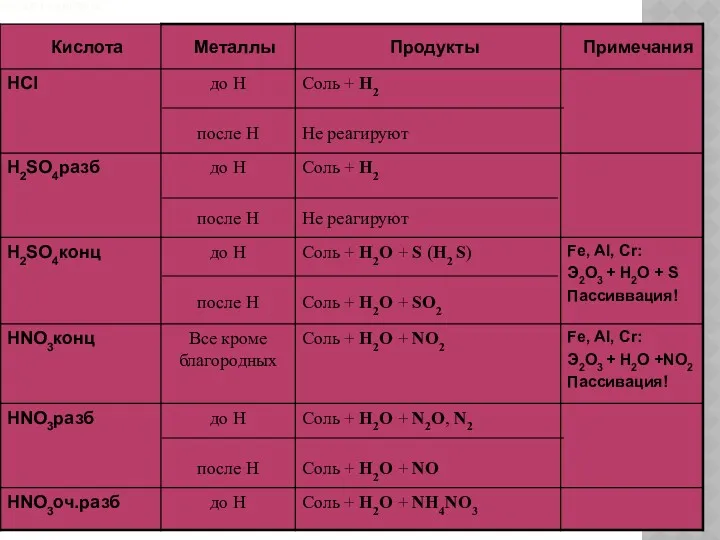
- 7. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с
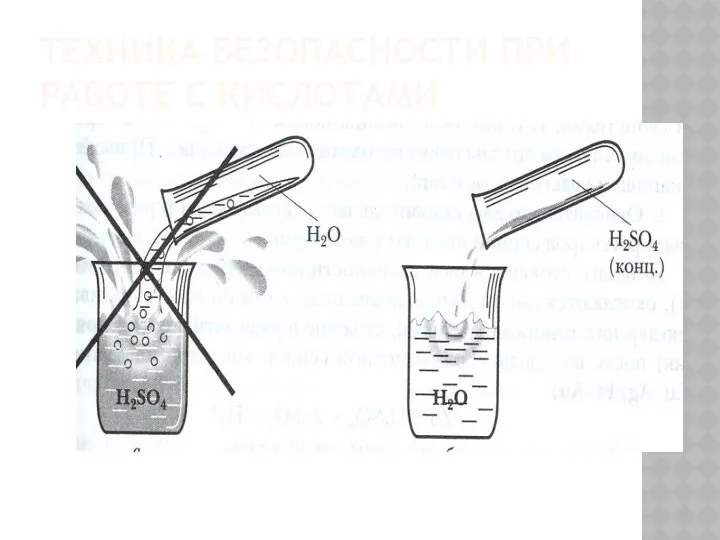
- 8. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С КИСЛОТАМИ
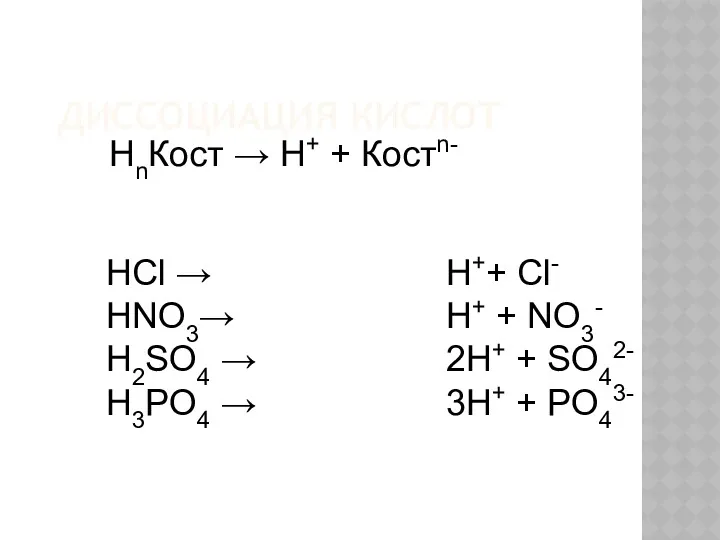
- 9. ДИССОЦИАЦИЯ КИСЛОТ HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl-
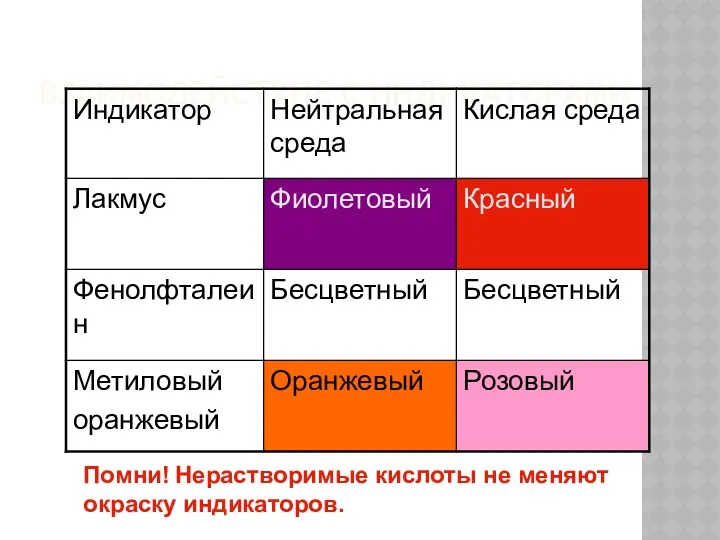
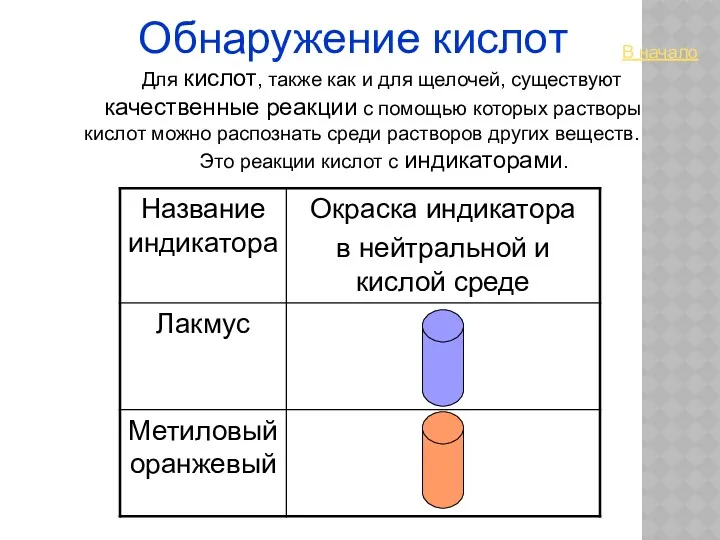
- 10. ВЗАИМОДЕЙСТВИЕ С ИНДИКАТОРАМИ Помни! Нерастворимые кислоты не меняют окраску индикаторов.
- 11. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al
- 12. МЕТАЛЛ + КИСЛОТА
- 13. ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота →
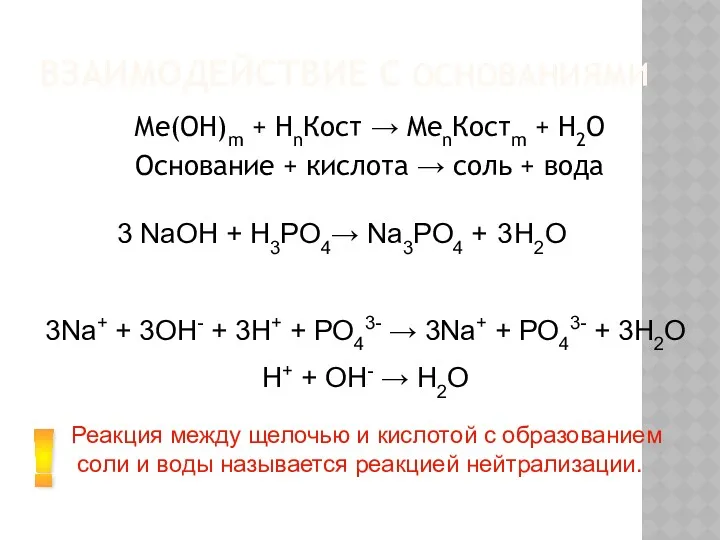
- 14. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль +
- 15. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота
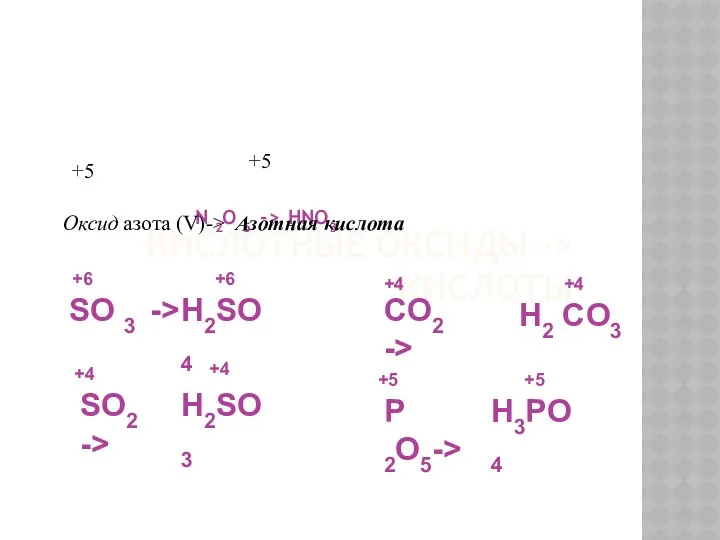
- 16. КИСЛОТНЫЕ ОКСИДЫ -> КИСЛОТЫ N 2O 5 -> HNO3 +5 +5 Оксид азота (V)-> Азотная кислота
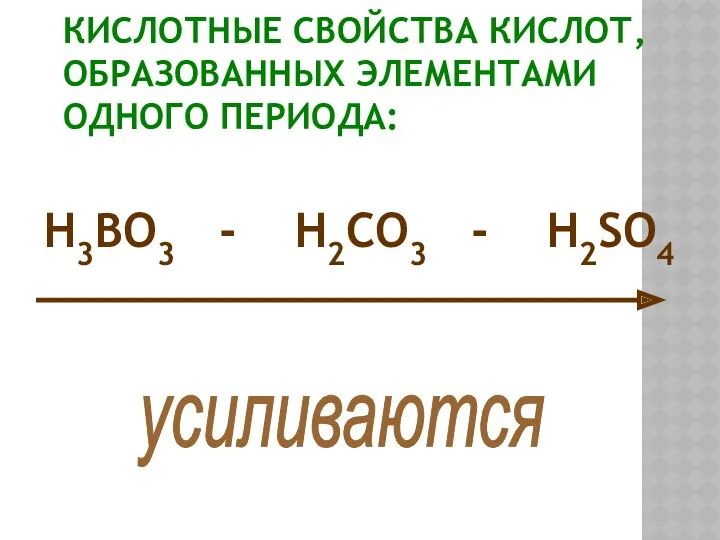
- 17. КИСЛОТНЫЕ СВОЙСТВА КИСЛОТ, ОБРАЗОВАННЫХ ЭЛЕМЕНТАМИ ОДНОГО ПЕРИОДА: H3BO3 - H2CO3 - H2SO4 усиливаются
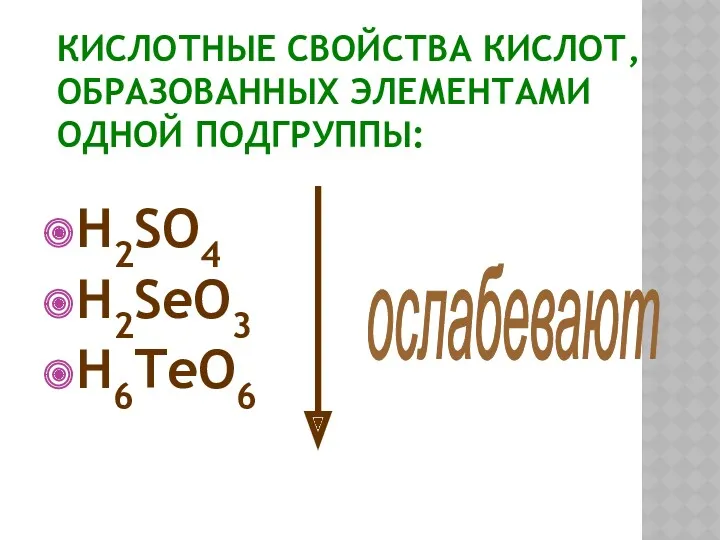
- 18. КИСЛОТНЫЕ СВОЙСТВА КИСЛОТ, ОБРАЗОВАННЫХ ЭЛЕМЕНТАМИ ОДНОЙ ПОДГРУППЫ: H2SO4 H2SeO3 H6TeO6 ослабевают
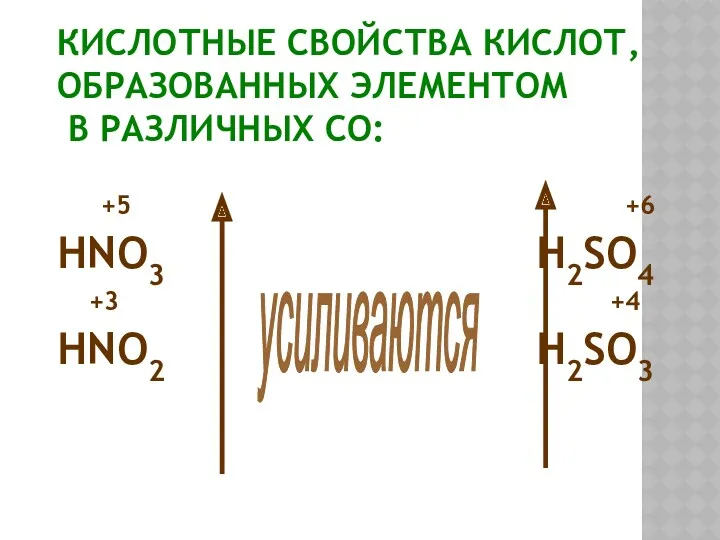
- 19. КИСЛОТНЫЕ СВОЙСТВА КИСЛОТ, ОБРАЗОВАННЫХ ЭЛЕМЕНТОМ В РАЗЛИЧНЫХ СО: +5 +6 HNO3 H2SO4 +3 +4 HNO2 H2SO3
- 20. Серная кислота – бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная
- 21. Угольная кислота H2CO3 УГОЛЬНАЯ КИСЛОТА - очень слабая и непрочная кислота. Образуется при растворении диоксида углерода
- 22. СОЛЯНАЯ КИСЛОТА - бесцветная, «дымящая» на воздухе жидкость. Составная часть желудочного сока. Соляная кислота НCl В
- 23. Органические кислоты, встречаемые вами в повседневной жизни Щавелевая Лимонная Уксусная Молочная Аскорбиновая В начало
- 24. КИСЛОТЫ В БЫТУ
- 25. Газообразный водород совершенно безвкусен. Зато некоторые вещества, в молекулах которых есть атомы водорода, довольно часто оказываются
- 26. Области применения кислот: Азотная кислота широко используется для производства удобрений, красителей, лаков, пластмасс, лекарственных и взрывчатых
- 27. Фосфорная кислота используется в составах для обезжиривания металлических поверхностей перед нанесением защитных покрытий, входит в состав
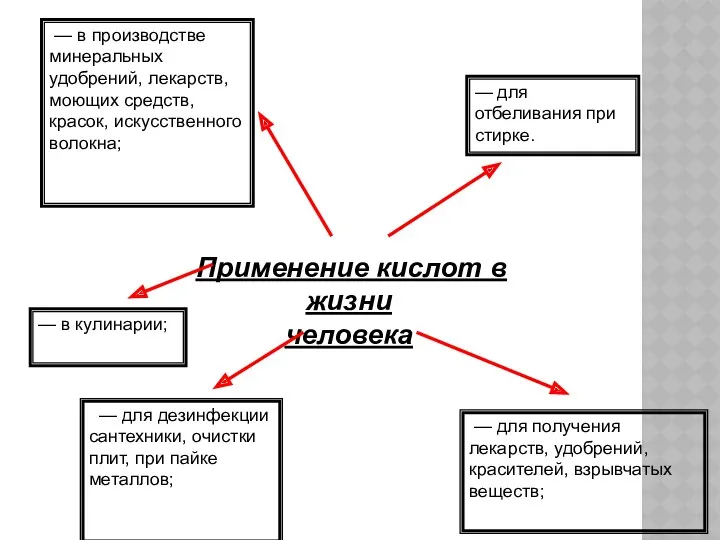
- 28. Применение кислот в жизни человека
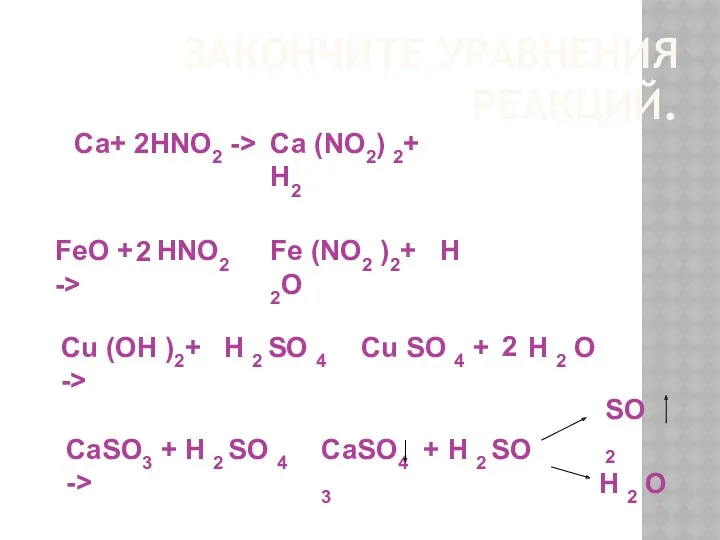
- 29. ЗАКОНЧИТЕ УРАВНЕНИЯ РЕАКЦИЙ. Са+ HNO2 -> Са (NO2) 2+ H2 2 FeO + HNO2 -> Fe
- 30. 1.Формула кислоты это: 1) КOH 2) CаCl2 3) HCL 4) SO2 2. С раствором серной кислоты
- 31. 4. Степень окисления серы в серной кислоте 1) +3; 2) +4; 3) +5; 4) +6. 5.Степень
- 32. 8. Реакция между магнием и соляной кислотой относится к реакциям 1) соединения; 3) разложения; 2) обмена;
- 33. 10.К сильным кислотам относятся вещества ряда 1) HC l; H Br; H2S 2) H2S; H2SO3; H2SO4
- 34. Обнаружение кислот Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых растворы
- 35. Техника безопасности При растворении серной кислоты нужно вливать её тонкой струёй в воду при помешивании В
- 36. ЗНАЧЕНИЕ КИСЛОТ В ЖИЗНИ ЧЕЛОВЕКА Пищевкусовые добавки Консервирование Производство лекарственных средств, красителей, полимеров, взрывчатых веществ, удобрений,
- 38. Скачать презентацию






















 Альдегіди. Будова молекул
Альдегіди. Будова молекул Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Алюминий и его соединения
Алюминий и его соединения Решение заданий по теме Химические свойства основных классов неорганических веществ
Решение заданий по теме Химические свойства основных классов неорганических веществ Смеси, растворы. Тест
Смеси, растворы. Тест Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Азотная кислота и ее соли
Азотная кислота и ее соли Коррозия металлов
Коррозия металлов Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Органічні розчинники
Органічні розчинники Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) История открытия химических веществ
История открытия химических веществ Защитно-декоративные покрытия
Защитно-декоративные покрытия Титриметрический метод анализа
Титриметрический метод анализа Основные классы неорганических соединений
Основные классы неорганических соединений Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Понятие биогенности химических элементов
Понятие биогенности химических элементов Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Происхождение названий минералов
Происхождение названий минералов