Содержание
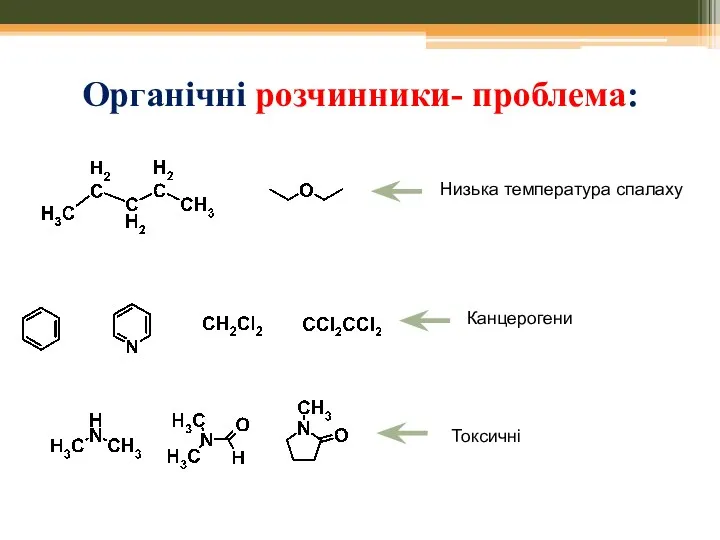
- 2. Органічні розчинники- проблема: Часто є леткими органічними сполуками –руйнація озонового шару; формування смогу Часто є легкозаймистими
- 3. Органічні розчинники- використання: Екстракція Аналітична хімія, Електрохімія 3. Органічна хімія 4. Полімерна хімія, хімія матеріалів 5.
- 4. Органічні розчинники- проблема: генотоксичний канцероген канцероген канцероген The acute toxicity of n-hexane is rather low. However,
- 5. Органічні розчинники- проблема: Низька температура спалаху Канцерогени Токсичні
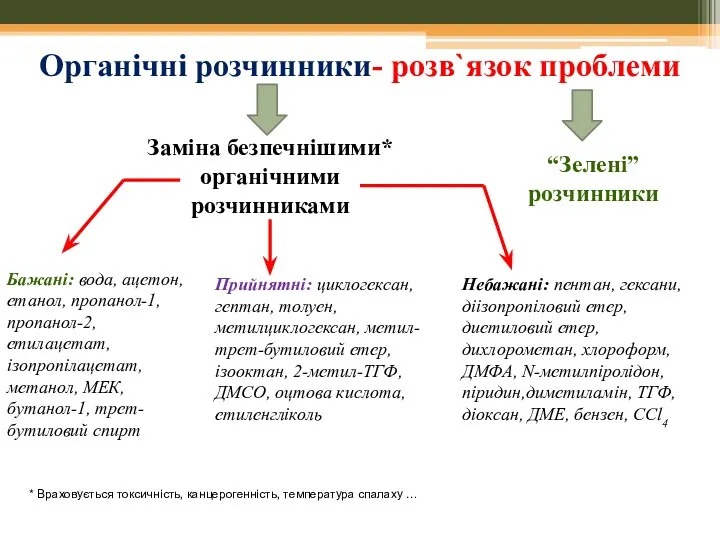
- 6. Органічні розчинники- розв`язок проблеми Заміна безпечнішими* органічними розчинниками “Зелені” розчинники Прийнятні: циклогексан, гептан, толуен, метилциклогексан, метил-трет-бутиловий
- 7. “Green chemistry tools to influence a medicinal chemistry and research chemistry based organization” Dunn and Perry,
- 8. “Green chemistry tools to influence a medicinal chemistry and research chemistry based organization” Dunn and Perry,
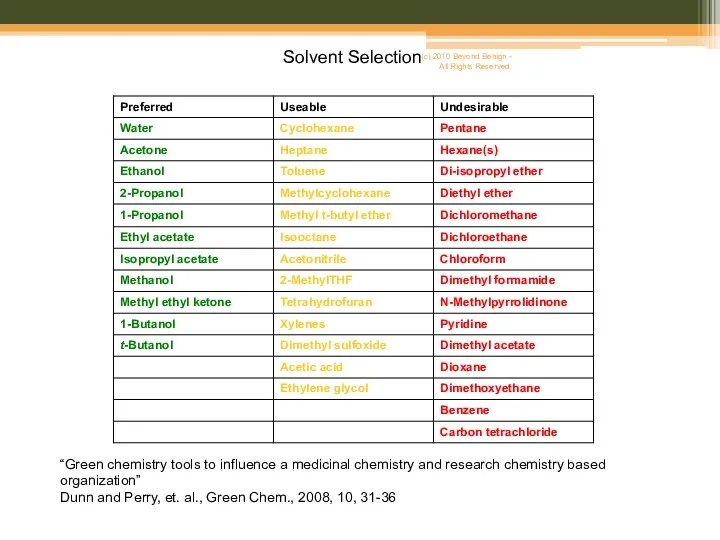
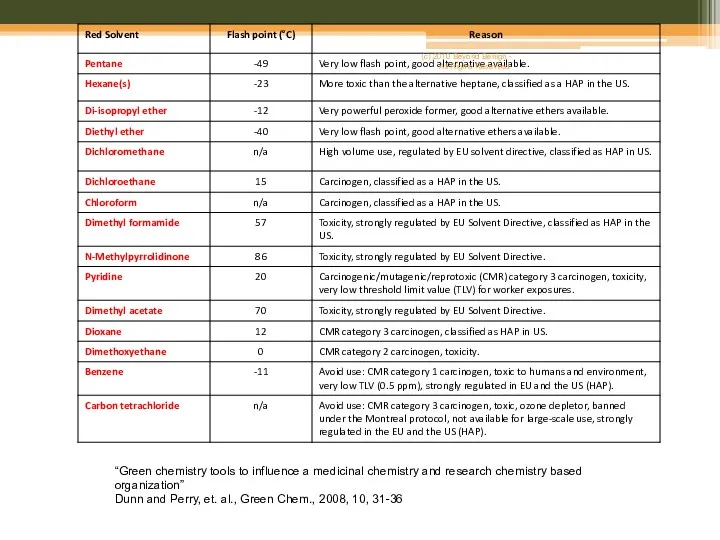
- 9. Solvent replacement table “Green chemistry tools to influence a medicinal chemistry and research chemistry based organization”
- 10. Pfizer’s results Use of Solvent Replacement Guide resulted in: 50% reduction in chlorinated solvent use across
- 11. “Зелені” розчинники: Низька токсичність Доступні для повторного використання Інертні Не забруднюють цільовий продукт 5. Можуть бути
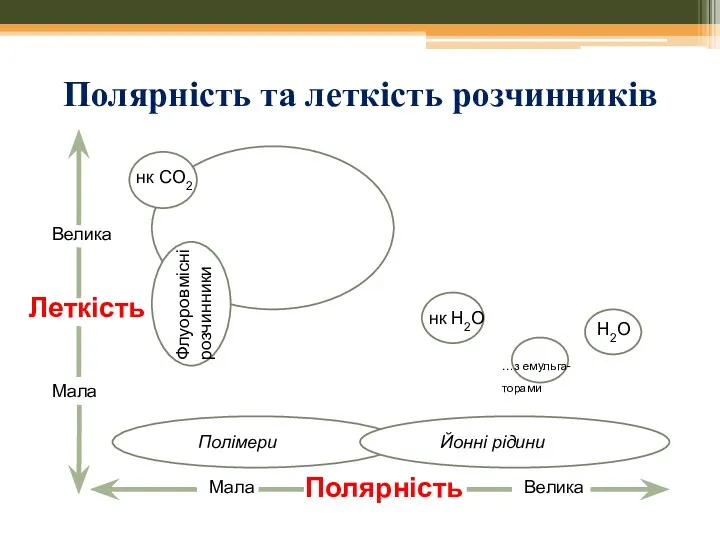
- 12. Полярність та леткість розчинників Велика Леткість Полярність Мала Мала Велика П Полімери П Йонні рідини нк
- 13. “Зелені” розчинники Синтез без розчинників. Синтези у воді Надкритичні рідини Розчинники з відновлюваних ресурсів Йонні рідини.
- 14. No Coopora nisi Fluida The best solvent is no solvent !
- 15. Синтез без розчинників
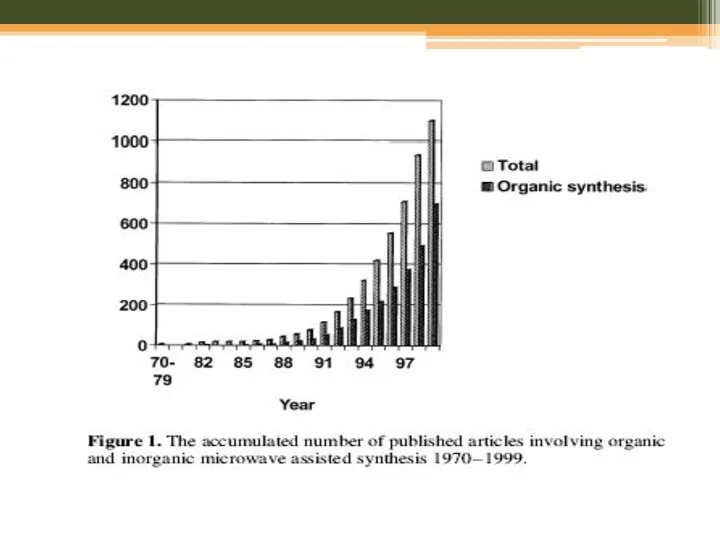
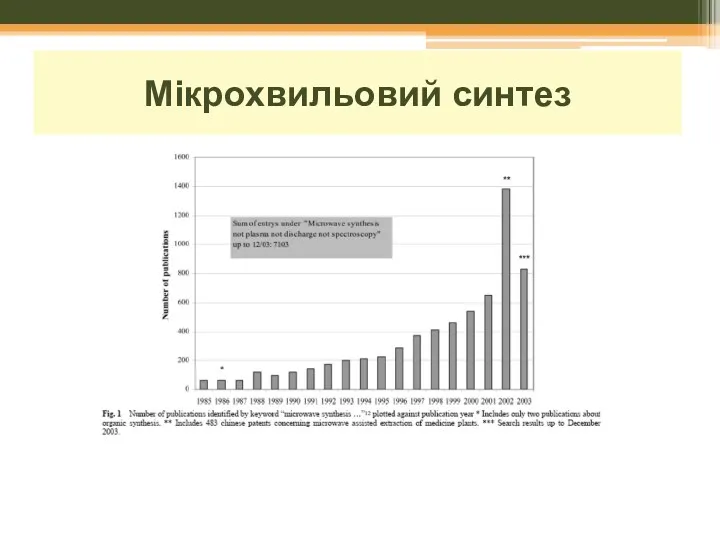
- 17. Мікрохвильовий синтез
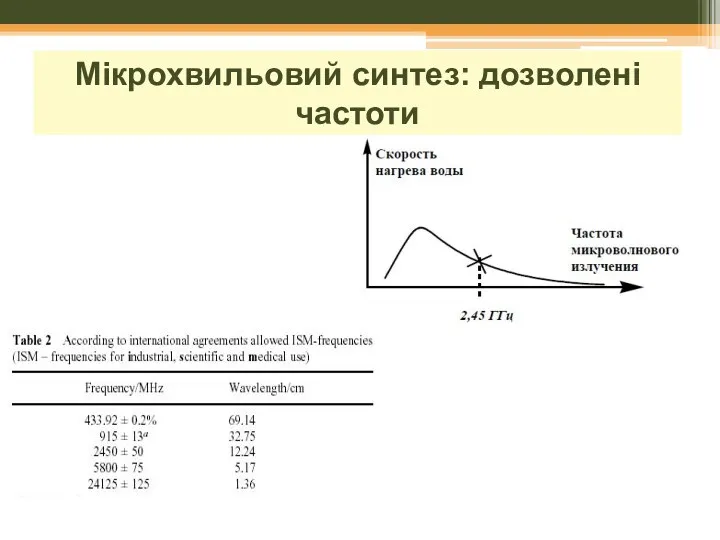
- 19. Мікрохвильовий синтез: дозволені частоти
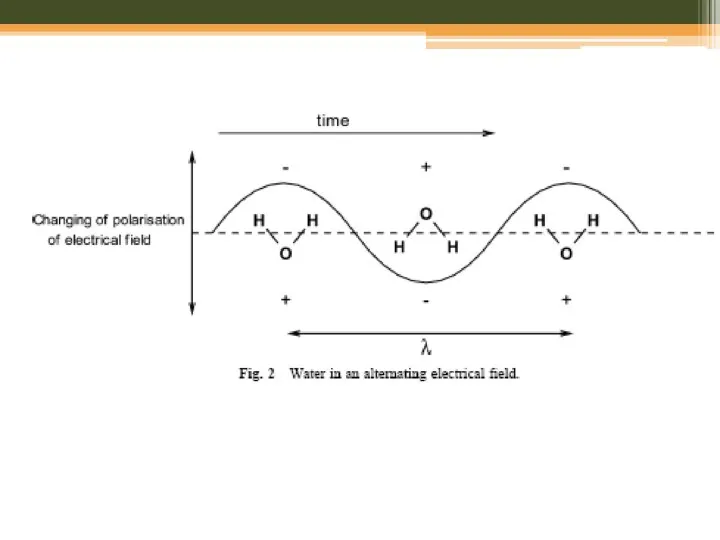
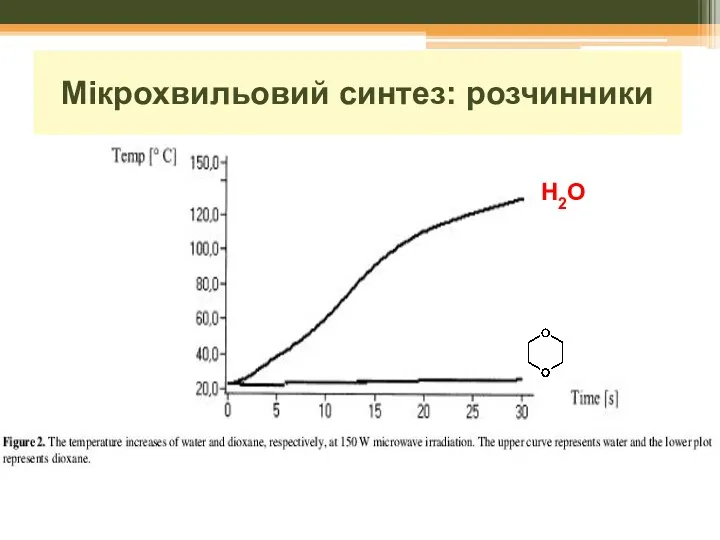
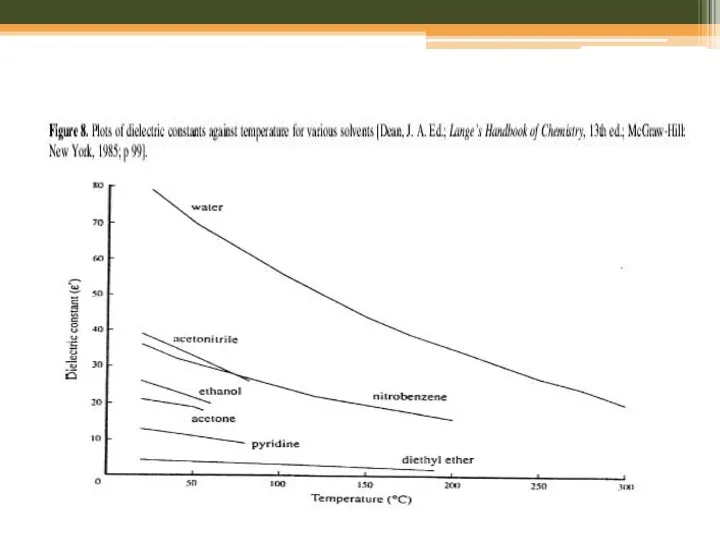
- 20. Мікрохвильовий синтез: розчинники H2O
- 22. Мікрохвильовий синтез: апаратура
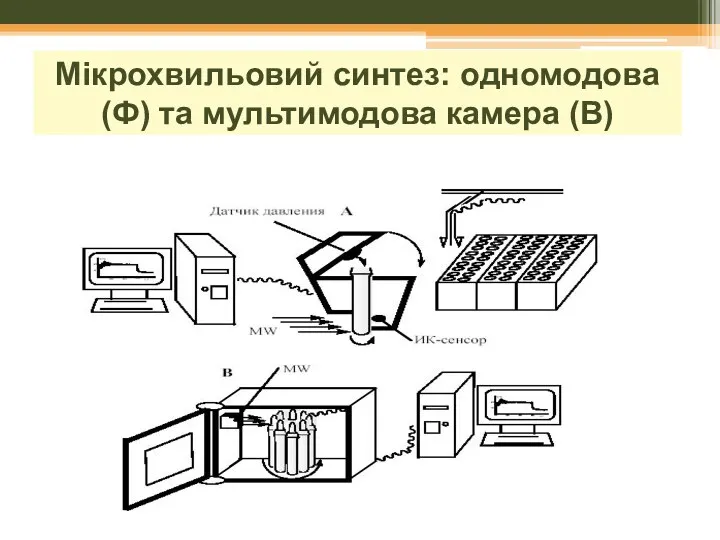
- 23. с одномодовой A и мультимодовой B камерами: Мікрохвильовий синтез: одномодова (Ф) та мультимодова камера (В)
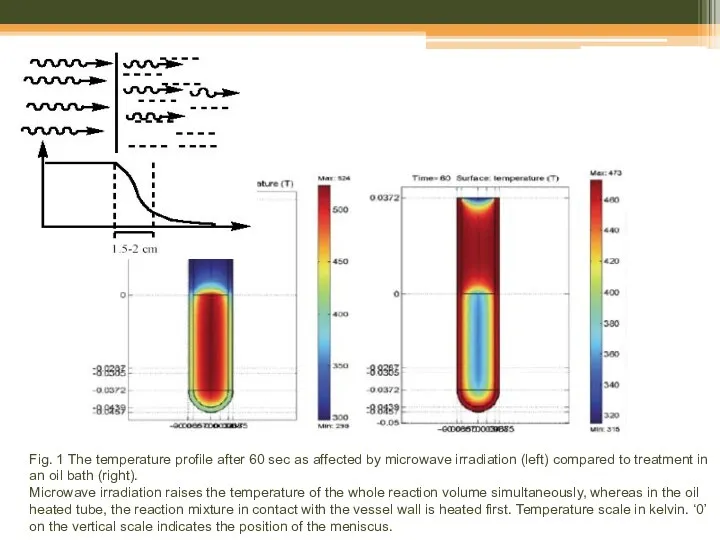
- 24. Fig. 1 The temperature profile after 60 sec as affected by microwave irradiation (left) compared to
- 25. Мікрохвильовий синтез: масштабування
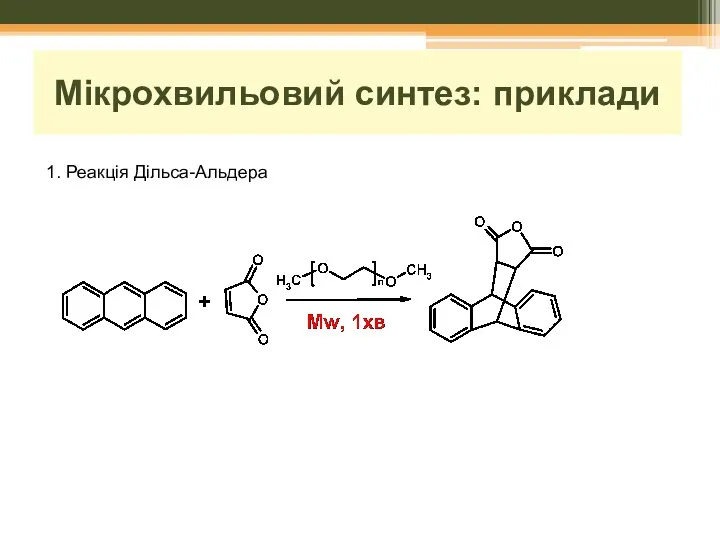
- 26. Мікрохвильовий синтез: приклади 1. Реакція Дільса-Альдера
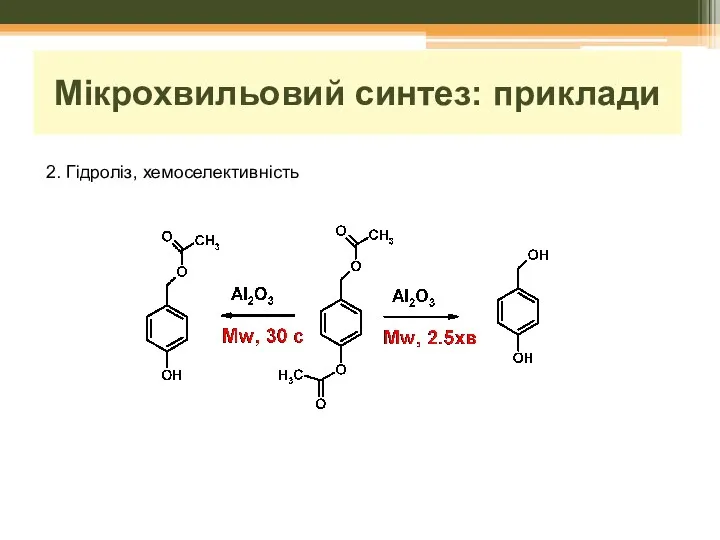
- 27. Мікрохвильовий синтез: приклади 2. Гідроліз, хемоселективність
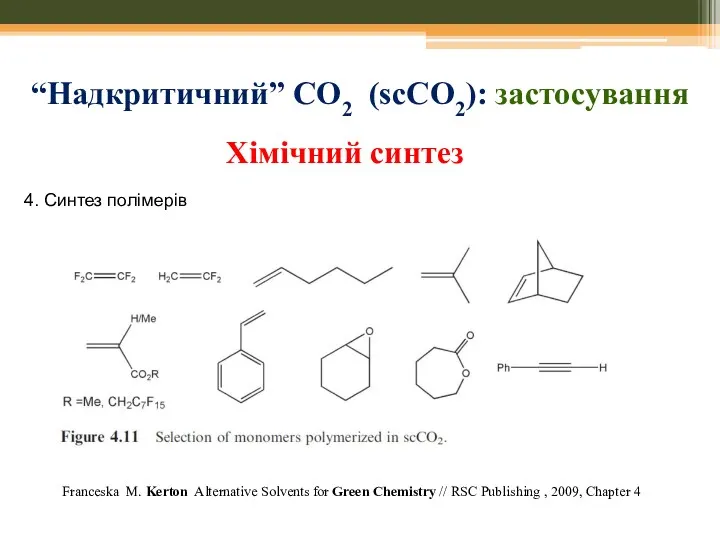
- 28. Мікрохвильовий синтез: приклади 3. Синтези без розчинників M. Nuchter, B. Ondruschka, W. Bonrath and A. Gum
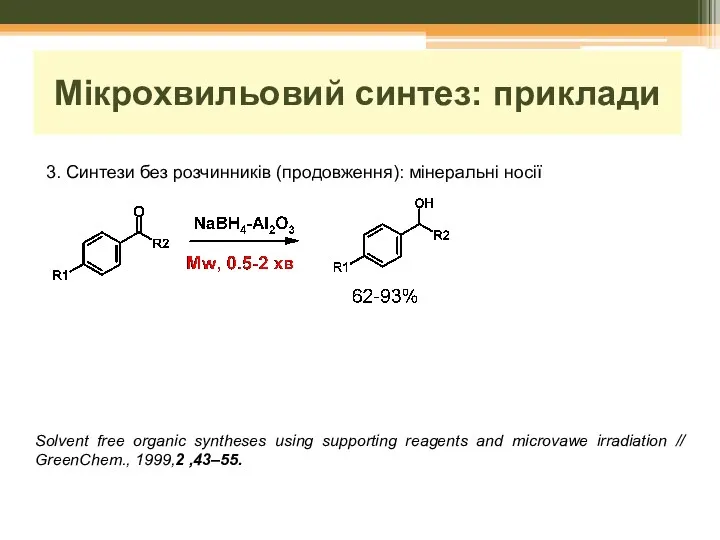
- 29. Мікрохвильовий синтез: приклади 3. Синтези без розчинників (продовження): мінеральні носії Solvent free organic syntheses using supporting
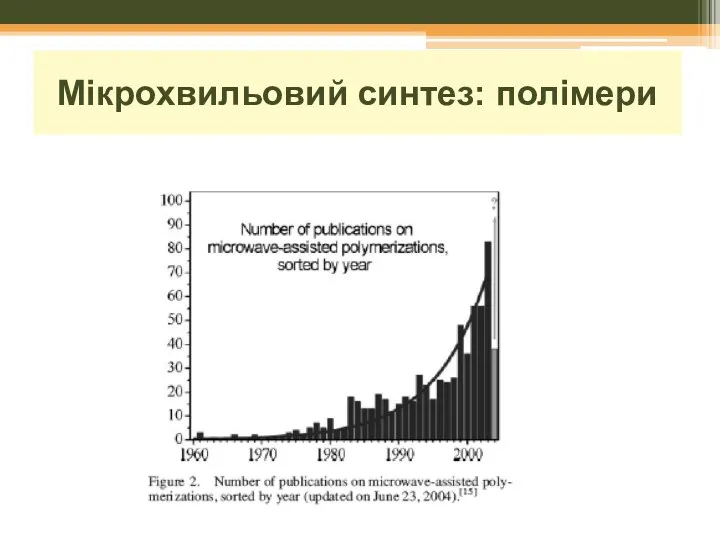
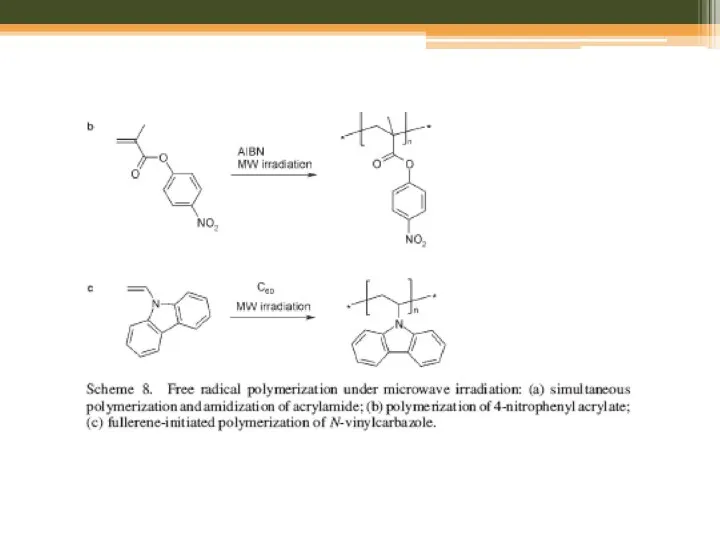
- 30. Мікрохвильовий синтез: полімери
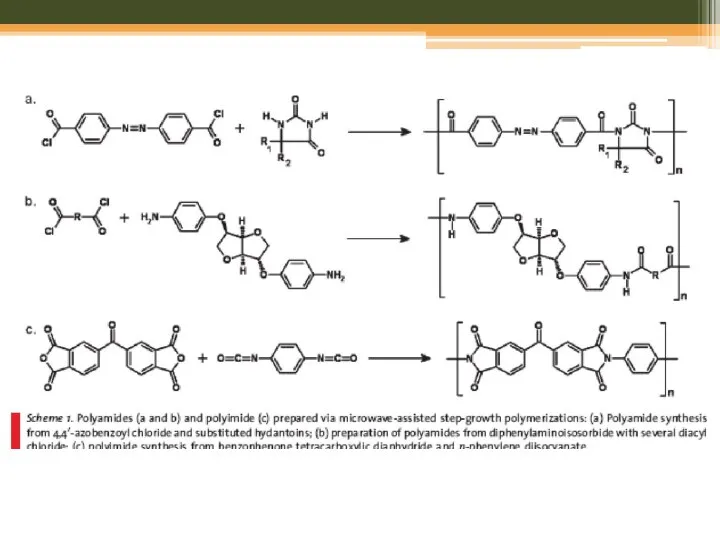
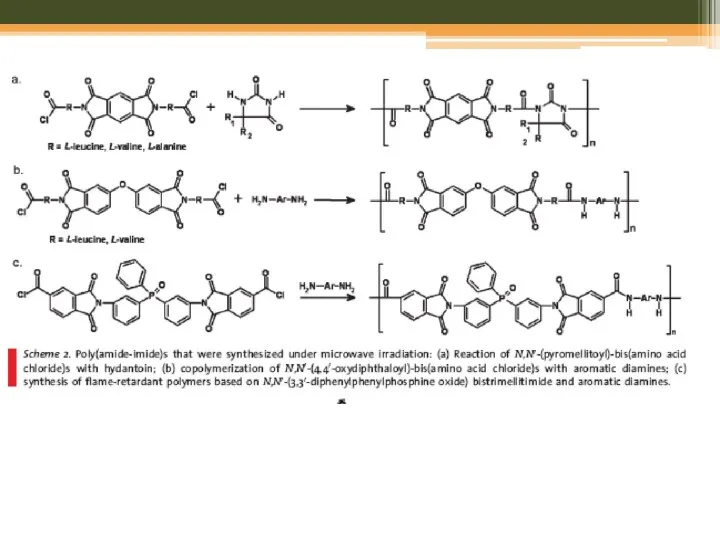
- 31. Step-Growth Polymerization Polyamides, Polyimides, and Poly(amide-imide)s
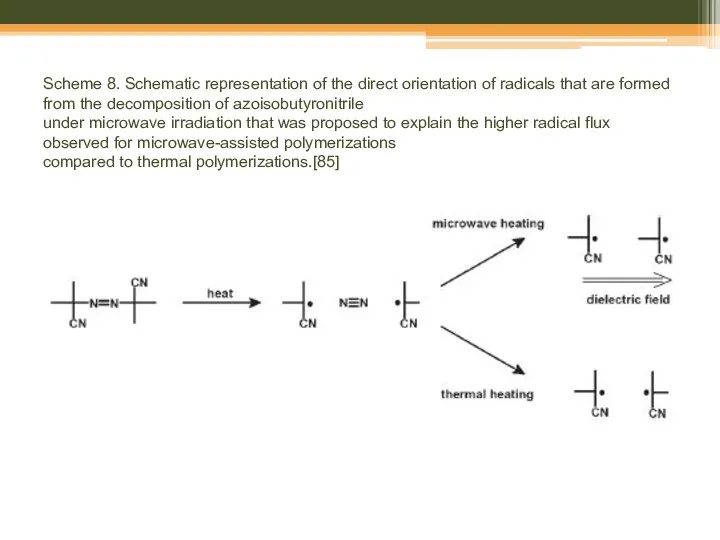
- 34. Scheme 8. Schematic representation of the direct orientation of radicals that are formed from the decomposition
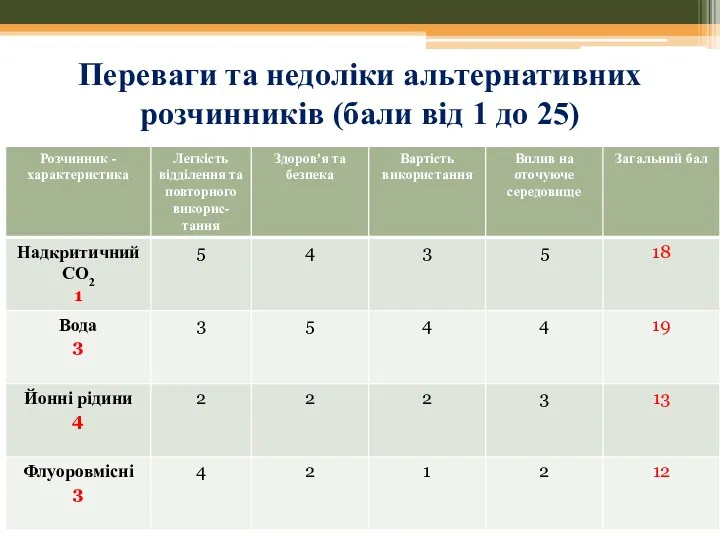
- 36. Переваги та недоліки альтернативних розчинників (бали від 1 до 25)
- 37. Переваги та недоліки альтернативних розчинників (від 1 до 25) Franceska M. Kerton Alternative Solvents for Green
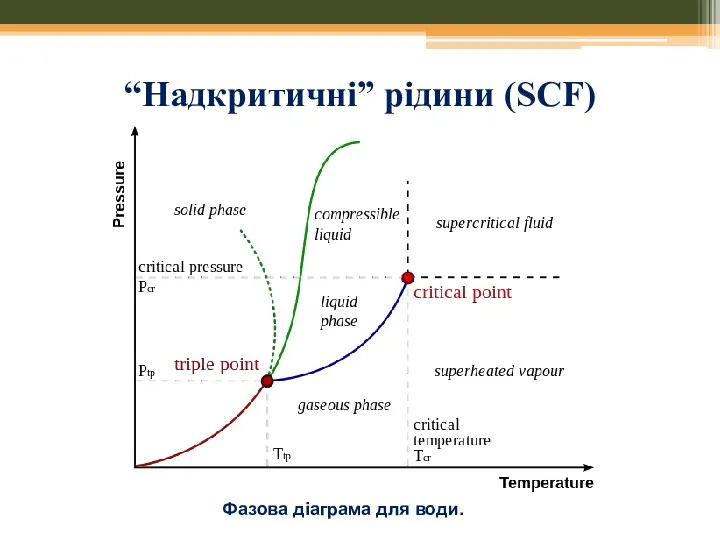
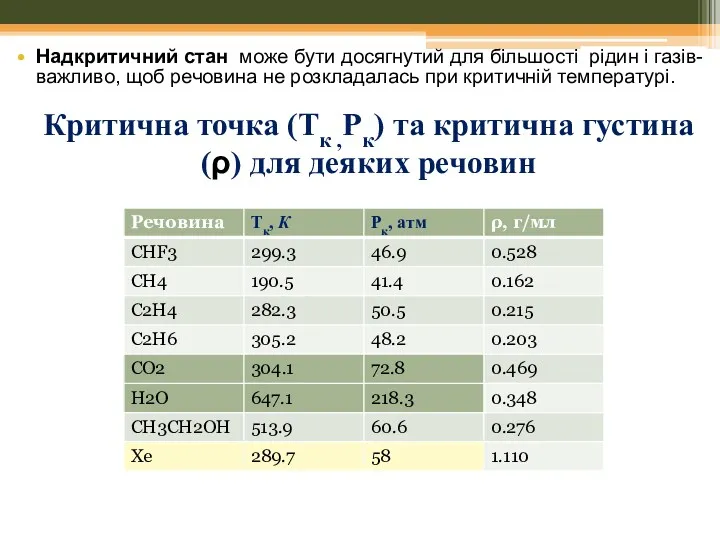
- 38. “Надкритичні” рідини (SCF) Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing , 2009,
- 39. “Надкритичні” рідини (SCF) Фазова діаграма для води.
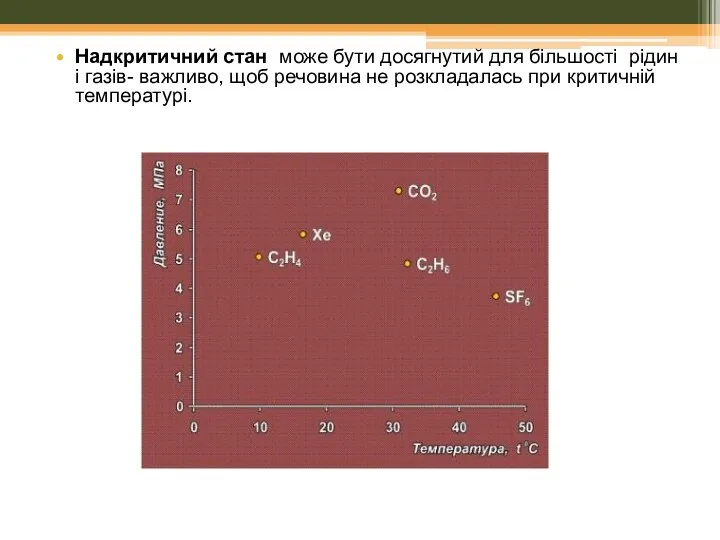
- 40. Надкритичний стан може бути досягнутий для більшості рідин і газів- важливо, щоб речовина не розкладалась при
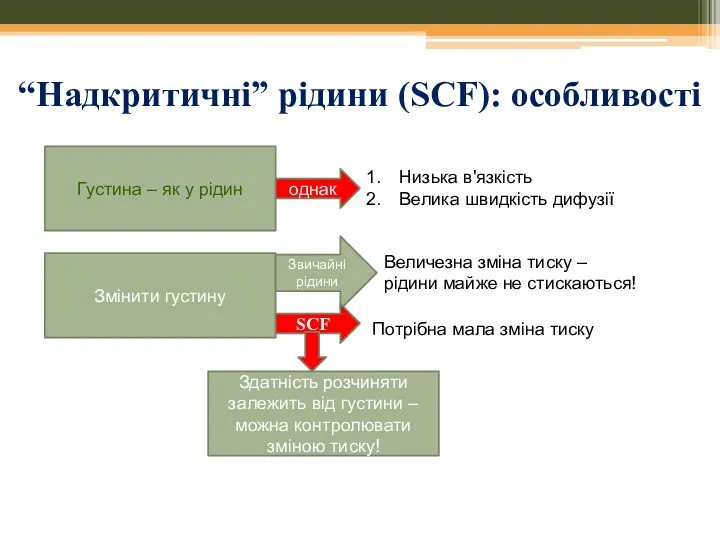
- 41. “Надкритичні” рідини (SCF): особливості Густина – як у рідин однак Низька в'язкість Велика швидкість дифузії Змінити
- 42. Надкритичний стан може бути досягнутий для більшості рідин і газів- важливо, щоб речовина не розкладалась при
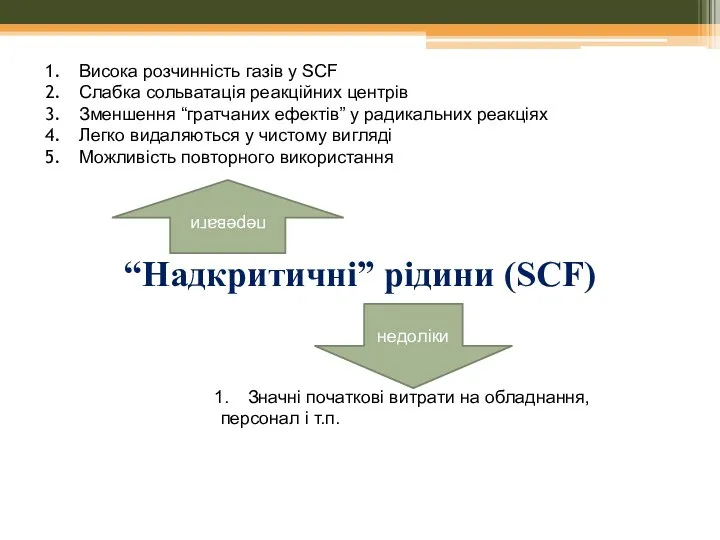
- 43. “Надкритичні” рідини (SCF) переваги Висока розчинність газів у SCF Слабка сольватація реакційних центрів Зменшення “гратчаних ефектів”
- 44. “Надкритичні” рідини (SCF) Висока розчинність газів: у суміші надкритичних Н2 та СО2 при 50 оС концентрація
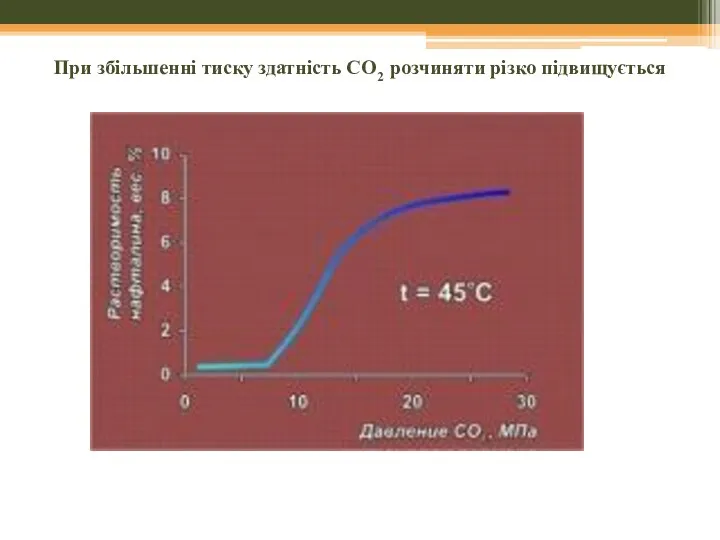
- 45. При збільшенні тиску здатність СО2 розчиняти різко підвищується
- 46. “Надкритичний” СО2 (scCO2) Дешевий Продукт ферментації та горіння Нетоксичний Не горить Не є ЛОС Відносно інертний
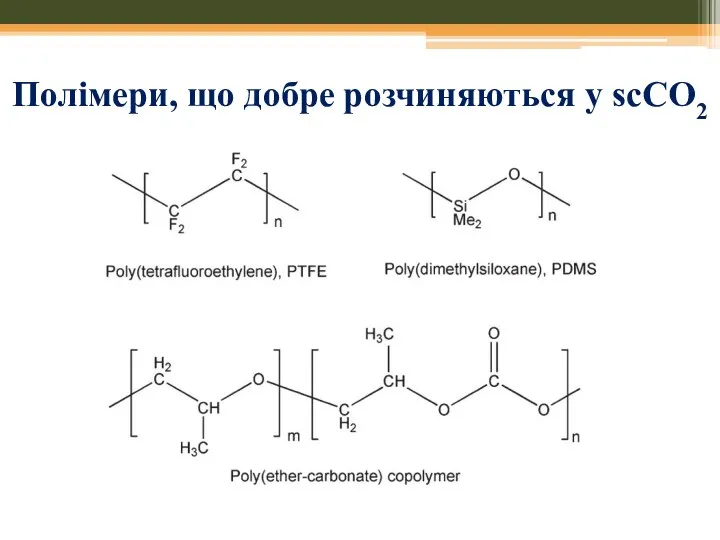
- 47. Полімери, що добре розчиняються у scCO2
- 48. “Надкритичний” СО2 (scCO2): застосування Хімічно чистий Нетоксичний Не горить Стабільний Безбарвний Без запаху Без смаку Косметична
- 49. “Надкритичний” СО2 (scCO2): застосування Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing ,
- 51. “Надкритичний” СО2 (scCO2): застосування Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing ,
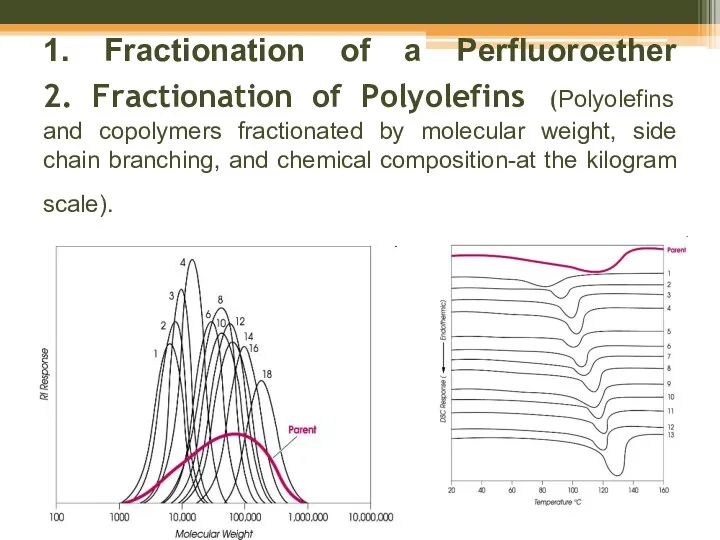
- 52. 1. Fractionation of a Perfluoroether 2. Fractionation of Polyolefins (Polyolefins and copolymers fractionated by molecular weight,
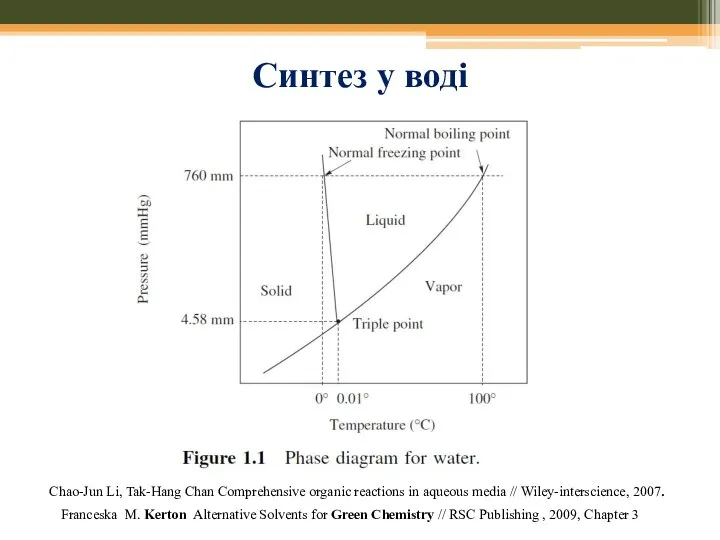
- 53. Синтез у воді Chao-Jun Li, Tak-Hang Chan Comprehensive organic reactions in aqueous media // Wiley-interscience, 2007.
- 54. Синтез у воді: переваги Chao-Jun Li, Tak-Hang Chan Comprehensive organic reactions in aqueous media // Wiley-interscience,
- 55. Застосування води: варіанти Chao-Jun Li, Tak-Hang Chan Comprehensive organic reactions in aqueous media // Wiley-interscience, 2007.
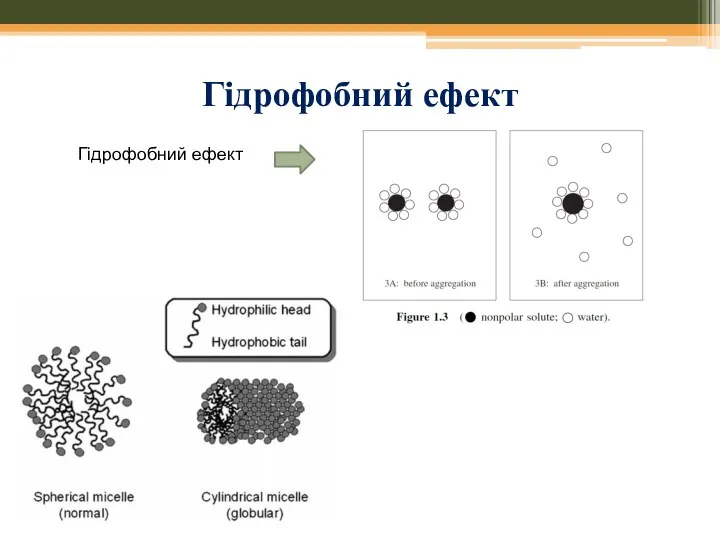
- 56. Гідрофобний ефект Гідрофобний ефект
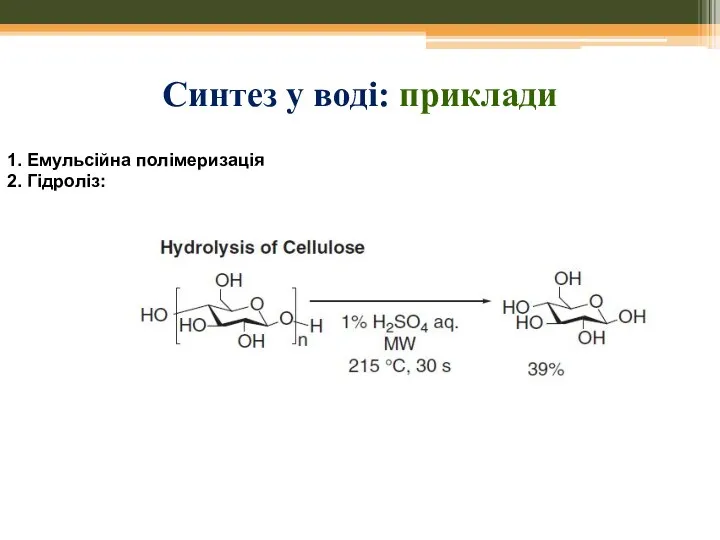
- 57. 1. Емульсійна полімеризація 2. Гідроліз: Синтез у воді: приклади
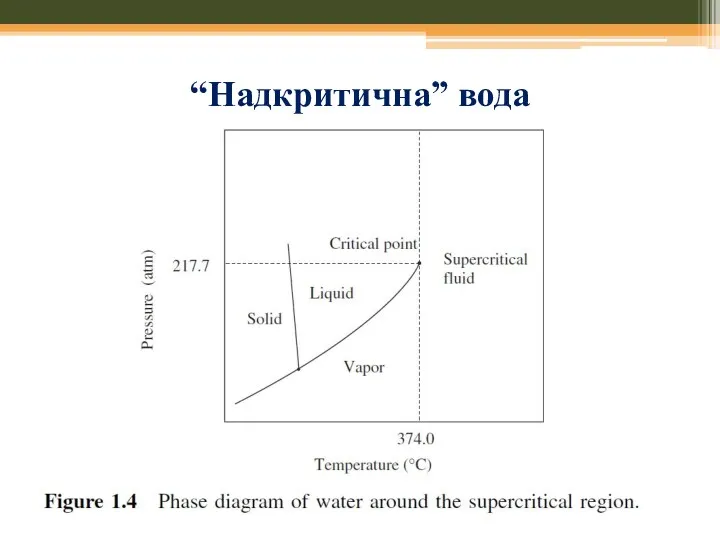
- 58. “Надкритична” вода
- 59. “Надкритична” вода Висока розчинність газів у scH2O Гідроліз Реакції окислення Хімічний синтез
- 60. “Надкритична” вода (sc H2O) Висока розчинність газів у scH2O Реакції окислення Хімічний синтез ! Відмінне середовище
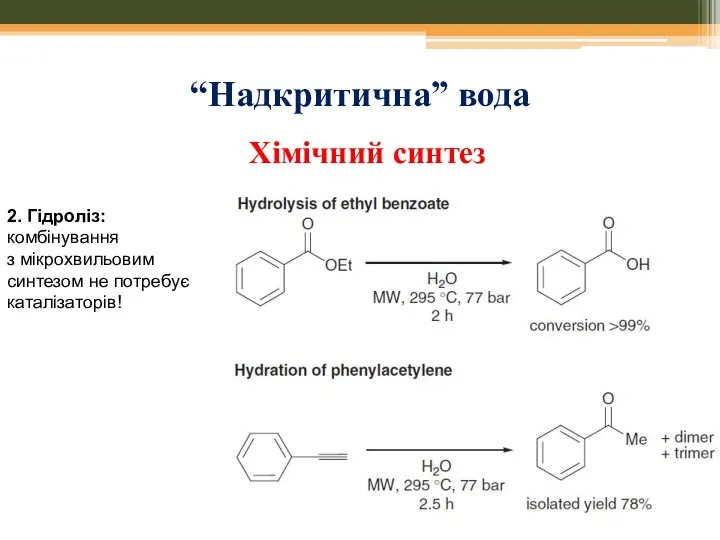
- 61. “Надкритична” вода 2. Гідроліз: комбінування з мікрохвильовим синтезом не потребує каталізаторів! Хімічний синтез
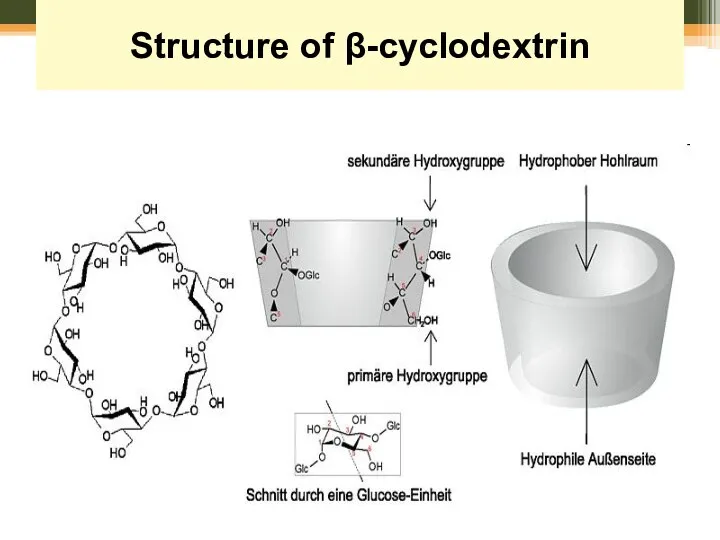
- 62. Синтези у воді Structure of β-cyclodextrin
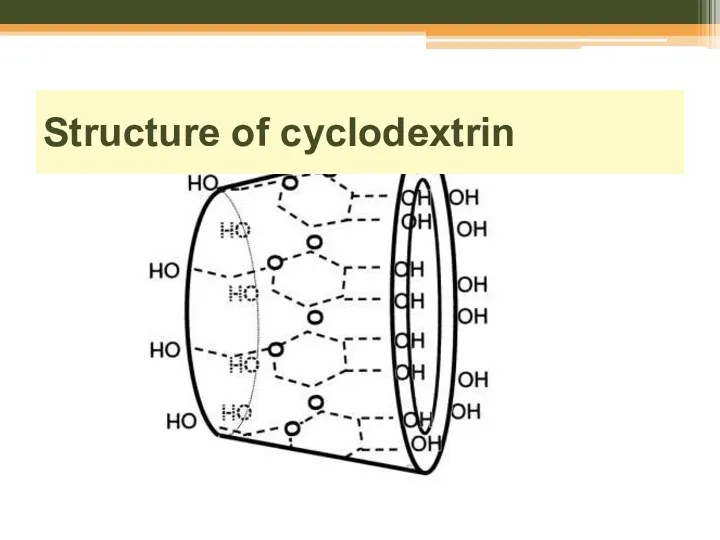
- 63. Structure of cyclodextrin
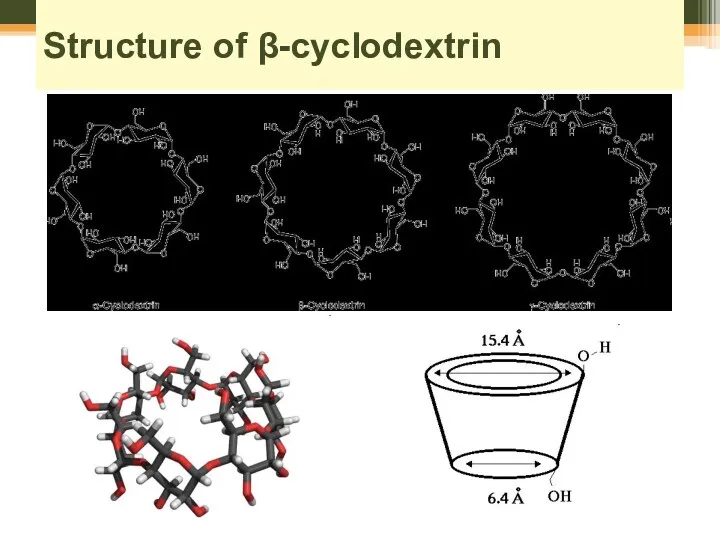
- 64. Structure of β-cyclodextrin
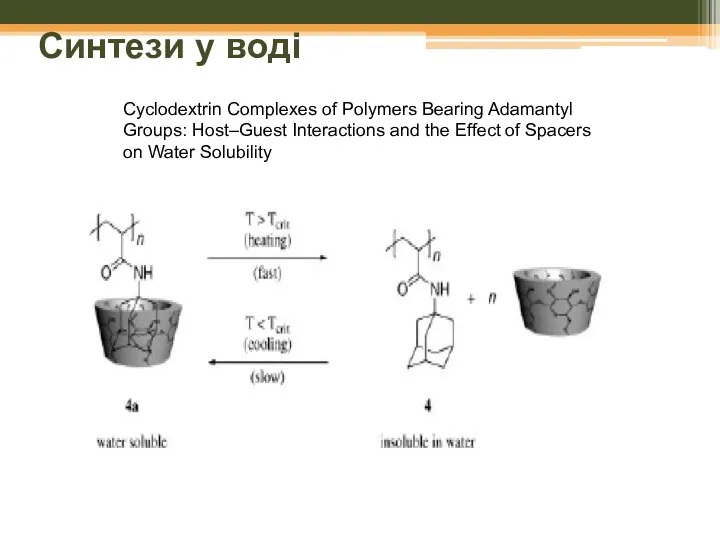
- 65. Синтези у воді Cyclodextrin Complexes of Polymers Bearing Adamantyl Groups: Host–Guest Interactions and the Effect of
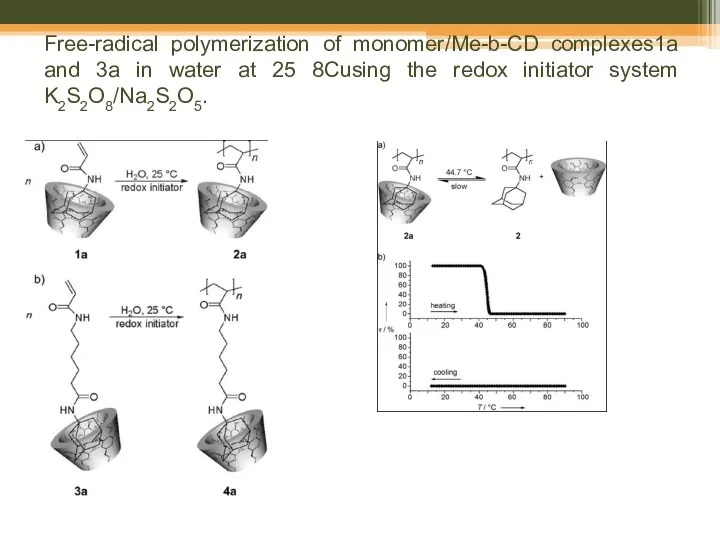
- 66. Free-radical polymerization of monomer/Me-b-CD complexes1a and 3a in water at 25 8Cusing the redox initiator system
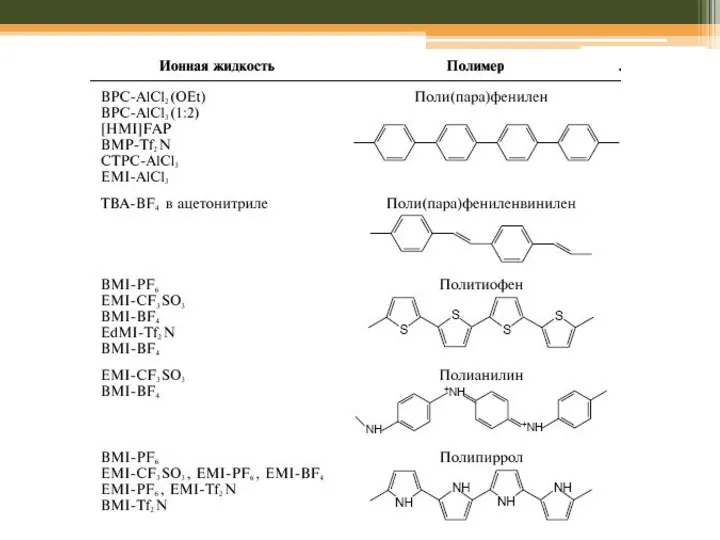
- 67. Йонні рідини Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing , 2009, Chapter
- 68. Йонні рідини: переваги Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing , 2009,
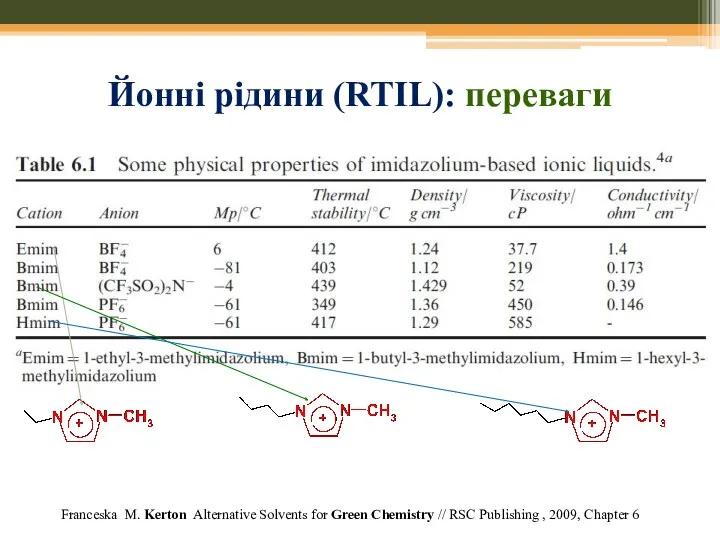
- 69. Йонні рідини (RTIL): переваги Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing ,
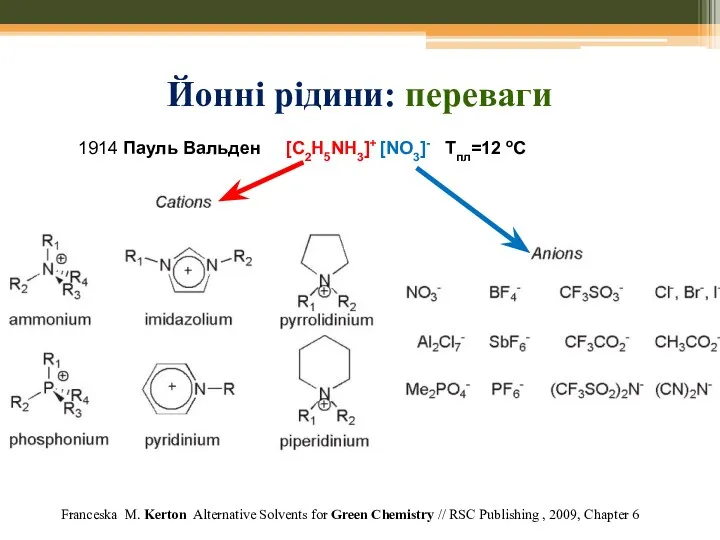
- 70. Йонні рідини: переваги Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing , 2009,
- 71. Йонні рідини: можливі проблеми Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing ,
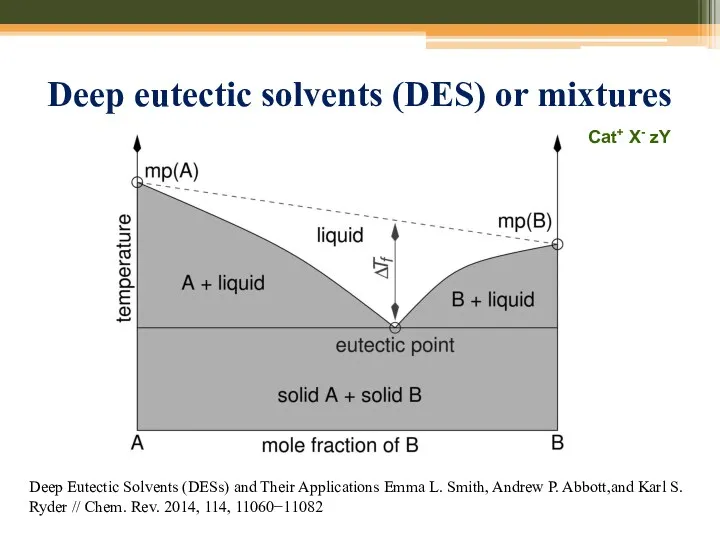
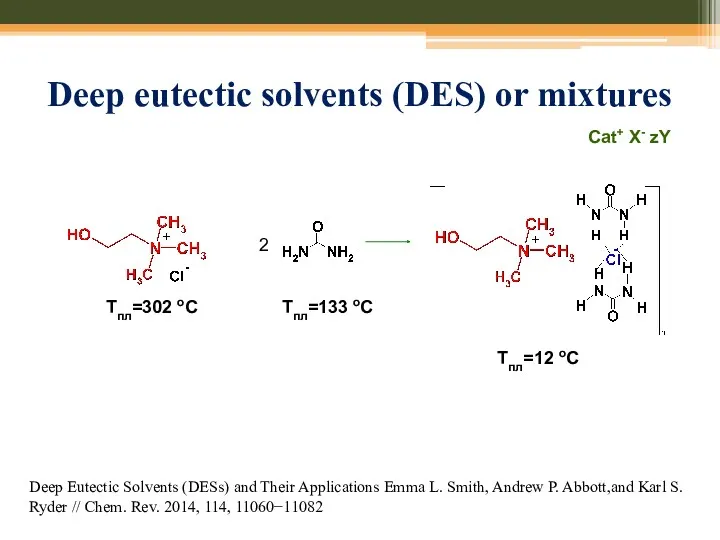
- 73. Deep eutectic solvents (DES) or mixtures Deep Eutectic Solvents (DESs) and Their Applications Emma L. Smith,
- 74. Deep eutectic solvents (DES) or mixtures Deep Eutectic Solvents (DESs) and Their Applications Emma L. Smith,
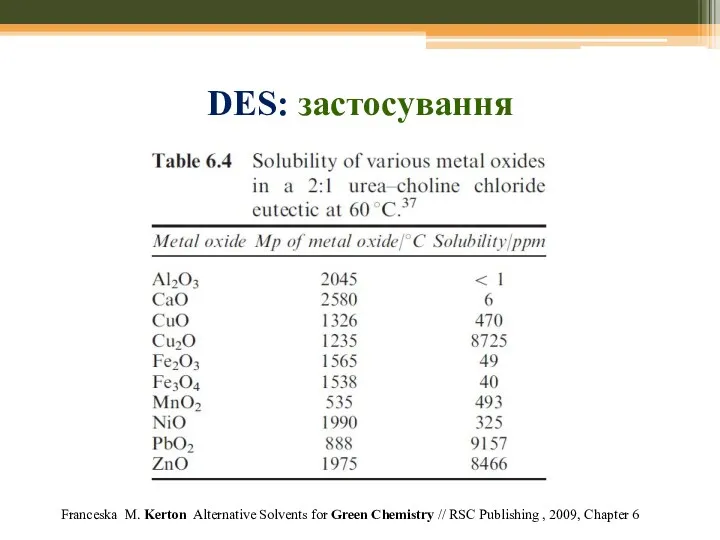
- 75. Franceska M. Kerton Alternative Solvents for Green Chemistry // RSC Publishing , 2009, Chapter 6 DES:
- 77. Скачать презентацию


























 Производство ацетальдегида
Производство ацетальдегида Коррозия металлов
Коррозия металлов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Титриметрический анализ
Титриметрический анализ O-alkylation catalysts
O-alkylation catalysts Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Алкени i Алкіни. Загальна та молекулярні формули, структурна ізомерія, систематична номенклатура
Алкени i Алкіни. Загальна та молекулярні формули, структурна ізомерія, систематична номенклатура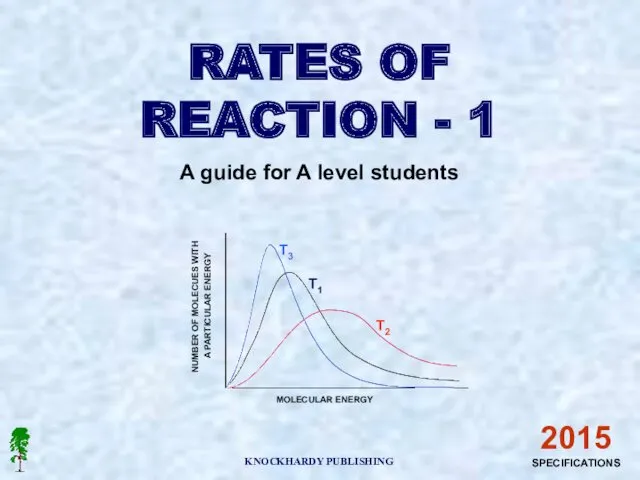 Number of molecues with a particular energy
Number of molecues with a particular energy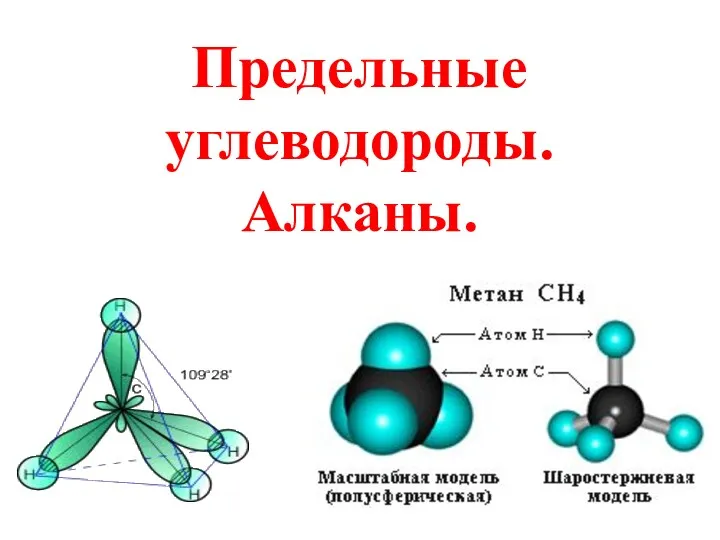 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи
Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи Химия и современный быт человека
Химия и современный быт человека Понятие об алкинах
Понятие об алкинах Витамины. Ашылу тарихы
Витамины. Ашылу тарихы Токсикология пестицидов
Токсикология пестицидов Органическая химия
Органическая химия Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Теоретическая электрохимия
Теоретическая электрохимия Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1 Одноатомные спирты
Одноатомные спирты Кремний и его соединения
Кремний и его соединения Титанның химиялық элементі
Титанның химиялық элементі Anionic Polymerization
Anionic Polymerization Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Трансмиссионные масла
Трансмиссионные масла Общая химия
Общая химия Кристаллические решетки
Кристаллические решетки